添加糖蜜和乙酸对西藏发酵全混合日粮青贮发酵品质及有氧稳定性影响
2014-01-02邱小燕原现军郭刚闻爱友余成群巴桑邵涛
邱小燕,原现军,郭刚,3,闻爱友,余成群,巴桑,邵涛*
(1.南京农业大学动物科学技术学院饲草调制加工与贮藏研究所,江苏 南京210095;2.怀化学院生命科学系,湖南 怀化418100;3.山西农业大学动物科技学院,山西 太谷030800;4.中国科学院地理科学与资源研究所,北京100101;5.西藏日喀则地区草原工作站,西藏 日喀则857000)
奶牛养殖业是西藏畜牧业的重要组成部分,直接关系到西藏农业经济的发展。西藏自然条件恶劣,土壤贫瘠,冬寒期长达7个多月,优质饲草资源匮乏,长期以来奶牛饲养水平低,影响了其生长发育及生产性能。发酵全混合日粮(fermented total mixed ration,FTMR)[1]是厌氧条件下发酵而成、营养均衡的全价饲料,可以有效地利用饲草资源,提高奶牛产奶量、乳蛋白率和能量转化率。西藏是我国青稞的主产区,每年伴随大量的青稞秸秆产生,利用其调制成FTMR饲料既可为奶牛提供营养均衡的日粮,又可以扩大饲料来源。青稞秸秆水溶性碳水化合物含量低、粗纤维含量高,影响了FTMR的发酵品质,同时在FTMR转运及开窖饲喂过程中,易发生有氧变质,降低FTMR饲料的适口性和营养价值。因此,研究提高FTMR饲料的发酵品质和有氧稳定性对促进西藏FTMR技术的推广与应用,实现奶牛养殖业的健康持续发展具有重要意义。
糖蜜是一种常用的青贮发酵促进剂,能为乳酸菌提供发酵底物,促进乳酸快速生成,迅速降低pH值,有效地抑制其他有害微生物的活性,使青贮饲料能长期保存[2]。Cao等[3]在FTMR饲料中添加4%的糖蜜改善了其发酵品质。乙酸是青贮过程中的主要产物之一,许多研究[4-6]认为乙酸能抑制酵母菌等有害微生物的活性,减少营养成分的损失,提高青贮饲料的有氧稳定性,延缓青贮饲料从开窖到饲喂过程的有氧腐败。
本试验旨在研究添加糖蜜、乙酸对FTMR发酵品质和有氧稳定性的影响,筛选出适宜的添加剂,以指导优质FTMR的生产,促进西藏奶牛业的健康持续发展。
1 材料与方法
1.1 试验材料
如表1所示,FTMR由青稞(Hordeumvulgare)秸秆、全株燕麦(Arrhenatherumelatius)、紫花苜蓿(Medi-cagosativa)和精料配制而成,水分约50%左右。青稞、燕麦和紫花苜蓿种植于西藏山南地区贡嘎县岗堆镇吉那奶牛试验场,于2012年9月23日刈割,青稞秸秆为青稞去除籽实后的秸秆,全株燕麦处于乳熟期,紫花苜蓿处于第2茬初花期。精料由玉米、全棉籽、菜籽粕、玉米酒糟、维生素和矿物质预混料等组成,由吉纳奶牛场配制。FTMR配方中原料的化学成分如表2所示。
1.2 试验设计
试验采用实验室青贮罐,容积为15L的塑料容器。试验设对照组(无添加),乙酸添加组(A,为无水乙酸,纯度>99.5%,0.3%鲜重),糖蜜添加组(M,3%鲜重),乙酸和糖蜜组合添加组(AM,0.3%+3%鲜重),青贮45d后,打开青贮窖取样分析发酵品质,同时打开剩余的全部青贮罐,有氧暴露6,9和12d后,分别取样分析有氧稳定性,每个处理各个时间点5个重复,共计80个实验室青贮罐。
1.3 试验方法
1.3.1 FTMR的调制 青稞秸秆、全株燕麦和紫花苜蓿用铡刀切成1~2cm后,按照试验设计与精料充分混合均匀后,每个实验室青贮罐均装填9.0kg TMR饲料,压实密封,室温18~25℃条件下保存。
1.3.2 原料营养成分及微生物分析 将原料于65℃烘箱中烘60h以上至恒重,测定干物质(dry matter,DM)含量[7];粗蛋白(crude protein,CP)含量采用凯氏定氮法测定[8];中性洗涤纤维和酸性洗涤纤维含量用范氏纤维分析法(Van Soest)测定[8];粗脂肪含量采用残余法测定[9];粗灰分含量采用灼烧法测定[8];水溶性碳水化合物含量(water-soluble carbohydrates,WSC)采用蒽酮-硫酸比色法测定[8];乳酸菌、好氧性细菌和酵母菌数量分别采用 MRS(de-Man Rogosa Sharpe)琼脂培养基、营养琼脂培养基、马铃薯葡萄糖琼脂培养基计数,乳酸菌37℃厌氧培养3d,好氧性细菌和酵母菌用生化培养箱37℃培养2d。
1.3.3 发酵品质分析 青贮45d后打开实验室青贮罐,取出全部FTMR充分混匀,采用四分法称取140g加入280g的去离子水,4℃浸提24h,然后通过2层纱布和定性滤纸过滤,pH值用HANNA pH211型pH计测定;乳酸含量(lactic acid,LA)用对-羟基联苯比色法测定[10];挥发性脂肪酸(volatile fatty acids,VFAs),包括乙酸(acetic acid,AA)、丙酸(propionic acid,PA)、丁酸(butyric acid,BA),采用高效气相色谱仪(日本岛津 GC-14B)[8]测定;氨态氮含量(ammonia nitrogen,NH3-N)采用苯酚-次氯酸钠比色法测定[11]。

表1 FTMR的原料构成及化学、微生物成分Table 1 Ingredient and chemical and microorganism composition of fermented total mixed ration(FTMR)silages
1.3.4 有氧稳定性分析 实验室青贮罐打开后,取出全部饲料,使空气充分浸入,有氧放置6,9和12d后,采用四分法称取140g样品,分析各项指标及好氧性微生物和酵母菌数量。
1.4 数据处理与统计
对发酵品质试验数据进行单因子方差分析(One way-ANOVA),并用邓肯法(Duncan)对各处理进行多重比较;有氧稳定性数据采用SAS软件中的一般线性模型(GLM)进行两因素(添加剂,时间,添加剂×时间)方差分析,并对各添加剂处理及有氧暴露天数间数据分别进行多重比较(P<0.05)。
2 结果与分析
2.1 FTMR材料的化学及微生物成分
如表2所示,青稞秸秆有较高的NDF和ADF及较低的粗蛋白含量,全株燕麦显示较高的水溶性碳水化合物含量。FTMR干物质含量接近500g/kg FW,粗蛋白和水溶性碳水化合物含量分别为173.00和60.08g/kg。乳酸菌和好氧性微生物数量均大于5lg cfu/g,而酵母菌数量小于5lg cfu/g(表1)。

表2 FTMR配方中青稞秸秆、燕麦、紫花苜蓿、精料的化学成分Table 2 Chemical composition of hulless barley straw,oat,alfalfa and concentrate used in fermented total mixed ration silages

表3 FTMR饲料的发酵品质Table 3 Fermentation quality of fermented total mixed ration silages
2.2 FTMR的发酵品质
由表3可见,发酵45d后各组发酵品质均良好,干物质含量无显著差异(P>0.05),pH值均降至4.30左右。虽各组间乳酸含量无显著差异(P>0.05),但A和AM组均不同程度降低了乳酸含量。添加剂处理组均具有较高的乙酸含量,其中A和AM组乙酸含量显著(P<0.05)高于对照组。相应地,各处理组乳酸/乙酸均低于对照组,其中A和AM组显著低于(P<0.05)对照组。各组均仅检测到微量丙酸含量。各添加组丁酸含量均低于对照组,其中A和AM组略低于M组,但各组间差异均不显著(P>0.05)。无论糖蜜单独添加还是与乙酸组合添加均降低了氨态氮/总氮,其中单独添加组氨态氮/总氮显著低于对照组(P<0.05)。
2.3 FTMR的有氧稳定性
如表4所示,随着有氧暴露时间的延长,对照组和M组乳酸含量缓慢下降,而A和AM组乳酸含量呈先上升后下降的变化趋势。相应地,各组pH值均呈上升趋势,其中对照组和M组上升幅度较大,有氧暴露12d后上升至5.70和6.50,显著高于(P<0.05)A和AM组。各组乙酸含量在整个有氧暴露阶段呈下降趋势。A和AM组氨态氮/总氮随着有氧暴露时间的延长缓慢上升(P>0.05),而对照组和M组氨态氮/总氮均在有氧暴露后第6天已显著(P<0.05)高于初始值,之后继续上升,到有氧暴露12d后,对照组和M组氨态氮/总氮显著(P<0.05)高于A和AM组。A和AM组水溶性碳水化合物呈下降趋势(P>0.05)变化,而对照组和M组水溶性碳水化合物在有氧暴露前9d显著(P<0.05)下降,之后基本趋于稳定(P>0.05),在有氧暴露第12天,A组和对照组分别显示最高和最低的水溶性碳水化合物含量。在有氧暴露之初(0d),各组乳酸菌数量始终处于较高水平(>8lg cfu/g),之后各组均不同程度下降,其中M和AM组在第6天已显著降低(P<0.05)。而对照组和A组乳酸菌数量显著下降(P<0.05)出现在有氧暴露第9天。各组好氧性微生物数量均随着有氧暴露时间的延长呈上升(P>0.05)趋势,其中A和AM组好氧性微生物始终显示较低数量,M组在有氧暴露12d后显示最高的好氧性微生物数量(P<0.05)。对照组和M组酵母菌数量分别在第12和6天显著(P<0.05)升高,而A和AM组酵母数量缓慢增加(P>0.05),其中A和AM组酵母菌数量始终处于较低水平。
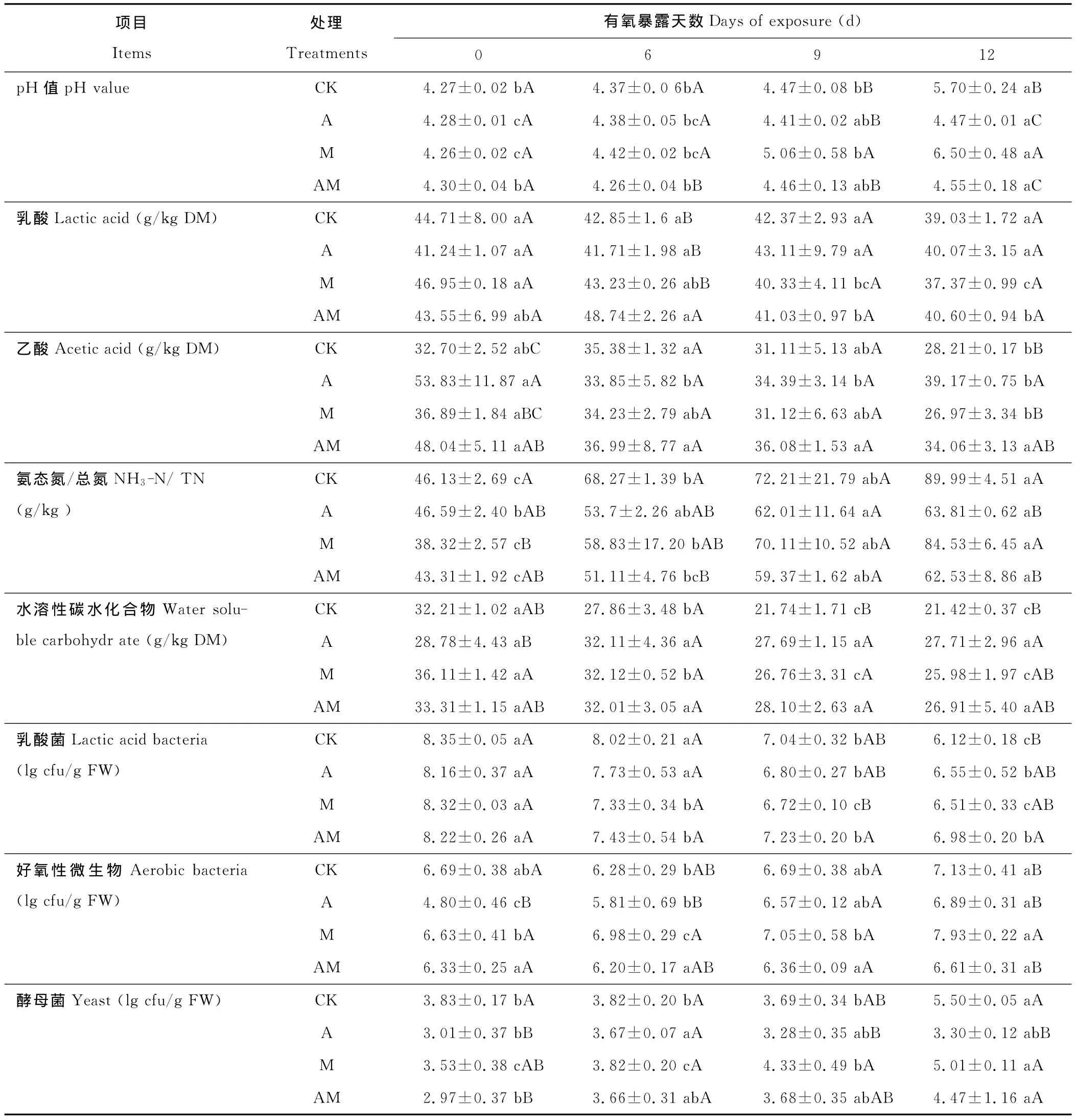
表4 FTMR开窖后的pH值、乳酸、乙酸、水溶性碳水化合物含量、氨态氮/总氮及微生物数量的变化Table 4 Changes in pH value,lactic acid,acetic acid and water soluble carbohydrates contents of fermented total mixed ration silages during exposed to the air
3 讨论
3.1 添加剂对全混合日粮发酵品质的影响
青贮45d后对照组pH值为4.27,未能降至常规成功青贮要求的临界值以下(4.2),各添加剂处理组pH值也均高于4.2,这是由于乳酸菌活性与青贮材料的干物质含量有关[2],Morgan等[12]将青贮玉米的干物质含量由175g/kg提高至360g/kg,抑制了乳酸菌的活性,结果乳酸含量由165g/kg降至34g/kg,pH值由4.00上升至5.09,但仍然能很好地保存。许多研究也证实,当干物质含量较高时,即使青贮饲料pH值在4.5左右,亦能使其得到好的保存[13-14]。较高的干物质含量也可抑制丁酸菌和大肠杆菌等有害微生物的生长[2],进而降低其对发酵底物、蛋白质和氨基酸等营养成分的降解。本试验中,所有FTMR干物质含量均高于450g/kg,发酵45d后各组pH 值均低于4.30,且显示较低的丁酸(≤2g/kg DM)和氨态氮(≤100g/kg TN)含量[15],说明青贮环境处于稳定状态,可以达到长期保存的目的[16]。
添加糖蜜并未显著提高乳酸含量,这可能是由于FTMR水溶性碳水化合物(60.08g/kg DM)足以满足乳酸菌发酵,这一点可以从对照组及乙酸添加组青贮结束时仍有部分水溶性碳水化合物残留得到证实。荣辉等[17]在对生长65d的象草(Pennisetumpurpureum)青贮时,发现可溶性碳水化合物含量为57.8g/kg DM,能保证象草青贮饲料良好的发酵品质。
添加乙酸(包括单独添加和组合添加)降低了乳酸含量,这可能是由于同型乳酸菌对乙酸耐受性比较低,抑制了青贮过程中乳酸的生成[18]。McDonald和Henderson[19]研究发现,挥发性脂肪酸可抑制青贮过程中乳酸菌活性,降低乳酸含量。Randby[20]研究了甲酸和乙酸对猫尾草(Setariaviridis)、牛尾草(Festucaelatior)和红三叶(Trifoliumpratense)不同比例混合青贮发酵品质的影响,也发现甲酸和乙酸均能抑制乳酸发酵,而乙酸效果不及甲酸。本试验中乙酸添加组丁酸含量略低于对照,这可能归因于乙酸对丁酸菌的抑制作用。Danner等[4]在关于青贮饲料有氧稳定性研究中,指出丁酸菌能够降解水溶性碳水化合物和蛋白质生成丁酸和氨态氮,而高浓度的乙酸可以抑制丁酸菌的活性,从而降低丁酸的浓度。
3.2 添加剂对全混合日粮有氧稳定性的影响
有氧暴露阶段pH值的变化能直观反映出青贮饲料的腐败速度和程度,较低的pH值能够有效抑制蛋白质的降解[21]。对照组和M组pH值有氧暴露9d后显著升高至5.70和6.50,A和AM组pH值在有氧暴露阶段缓慢上升,12d后pH值仅达到4.5左右,显著低于对照组和M组,这表明对照组和M组有氧暴露9d后开始腐败,而A和AM组有氧暴露12d后FTMR品质仍属良好。本试验中有氧暴露过程中对照组和M组乳酸含量逐渐下降,这是由于实验室青贮窖开封后,FTMR厌氧环境被打破,好氧性微生物开始大量繁殖,它们以乳酸、水溶性碳水化合物为底物,产生有机酸,并释放二氧化碳和热量,导致青贮饲料温度上升,进而加剧了青贮饲料腐败变质的进程[22]。Britt等[23]在玉米青贮时添加不同比例甲酸和丙酸,发现青贮期间抑制了乳酸菌活动,降低了乳酸含量,而开封后由于甲酸与丙酸的挥发和代谢,导致乳酸菌可以继续利用青贮过程中节省的发酵底物,从而在有氧暴露14d后出现一个乳酸含量高峰,本研究由于有氧暴露阶段好氧微生物活跃,乙酸对乳酸菌的抑制作用相对减弱,部分乳酸菌利用FTMR中剩余的WSC继续产生乳酸,因而A和AM组在有氧暴露期间乳酸含量先上升后下降。Wilkinson和Davies[24]指出未解离短链脂肪酸以被动运输的形式进入微生物细胞内部,之后释放H+降低内部pH,从而杀死细胞,抑制真菌等微生物的生长繁殖,而乙酸的解离程度低于乳酸,可以有效抑制青贮饲料有氧暴露阶段酵母、霉菌和真菌的生长繁殖,因此,乙酸含量已成为预测青贮有氧稳定性优劣的主要指标之一。本试验乙酸添加组始终显示较低的氨态氮/总氮、好氧性微生物和酵母菌数量,且乙酸添加组有较高的水溶性碳水化合物含量,这均归因于乙酸对有氧阶段有害微生物的抑制作用。Driehuis等[25]指出乙酸对酵母菌有双重作用,即厌氧阶段乙酸抑制酵母菌的存活,有氧阶段乙酸抑制酵母菌的活性,乙酸浓度在36.0~50.0g/kg DM能够有效地抑制有氧腐败。Schmidt和Kung[26]在玉米青贮时添加布氏乳杆菌,发现青贮物中含有较高浓度的乙酸是青贮有氧稳定性提高的基本原因,且乙酸浓度越高,有氧腐败的时间相应地延长。
4 结论
综上所述,青贮45d后,各组FTMR饲料均具有良好的发酵品质,虽然添加乙酸降低了乳酸含量,但与对照相比无显著性差异,发酵品质良好。有氧暴露9d后,对照组和糖蜜添加组开始发生有氧腐败,而添加乙酸提高了有氧稳定性,pH值、好氧性微生物和酵母菌数量在整个有氧暴露的过程始终维持在较低水平,可使FTMR饲料良好地保存12d以上。因此,为了获得品质优良的FTMR饲料,可在生产FTMR时添加0.3%的乙酸既不影响发酵品质,也可提高其有氧稳定性。
[1]Tran T M K,Vasupen K,Bureenok S,etal.Effect of fibrolytic enzymes supplementation on rumen fermentation and digestibility in dair cow fed straw-based diet[J].Journal of Agriculture Science,2012,2(4):141-144.
[2]McDonald P,Henderson A R,Heron S J E.The Biochemistry of Silage(2th ed)[M].Aberystwyth:Cambrian Printers Ltd,1991.
[3]Cao Y,Toshiyoshi T,Ken H,etal.Effect of adding lactic acid bacteria and molasses on fermentation quality and in vitro ruminal digestion of total mixed ration silage prepared with whole crop rice[J].Japanese Society of Grassland Science,2010,56(10):19-25.
[4]Danner H,Holzer M,Mayrhuber E,etal.Acetic acid increases stability of silage under aerobic conditions[J].Applied and Environmental Microbiology,2003,69(1):562-567.
[5]Kung L J,Yanjit N K.The effect ofLactobacillusbuchneriand other additives on the fermentation and aerobic stability of barley silage[J].Journal of Dairy Science,2001,84(5):1149-1155.
[6]Driehuis F,Oude Elferink S J W H,Spoelstra S F.Anaerobic lactic acid degradation during ensilage of whole crop maize inoculated withLactobacillusbuchneriinhibits yeast growth and improves aerobic stability[J].Journal of Applied Microbiology,1999,87(4):585-594.
[7]原现军,王奇,李志华,等.添加糖蜜对青稞秸秆和多年生黑麦草混合青贮发酵品质及营养价值的影响[J].草业学报,2013,22(3):116-123.
[8]Madrid J,Martinez A,Hernandez F,etal.A comparative study on the determination of lactic acid in silage juice by colorimetric,high-performanee liquid chromatography and enzymatic methods[J].Journal of the Science of Food and Agriculture,1999,79(2):1722-1726.
[9]原现军,余成群,李志华,等.添加青稞酒糟对西藏地区青稞秸秆和高羊茅混合青贮发酵品质的影响[J].草业学报,2012,21(2):92-98.
[10]王奇,余成群,辛鹏程,等.苇状羊茅和箭筈豌豆混合青贮发酵品质的研究[J].草业学报,2012,20(5):952-956.
[11]Shao T,Zhang Z X,Shimojo M,etal.Comparison of fermentation characteristics of italian ryegrass(LoliummultiflorumLam.)and guineagrass(PanicummaximumJacq.)during the early stage of ensiling[J].Asian-Australasian Journal of Ani-mal Sciences,2005,18(12):1727-1734.
[12]Morgan C A,Edwards R A,McDonald P.Intake and metabolism studies with fresh and wilted silages[J].Journal of Agricultural Science,1980,94(2):287-298.
[13]Meeske R,van der Merwe G D,Greyling J F,etal.The effect of adding an enzyme containing lactic acid bacteria inoculant to big round bale oat silage on intake,milk production and milk composition of Jersey cows[J].Animal Feed Science and Technology,2002,97(3-4):159-167.
[14]原现军,余成群,李志华,等.西藏青稞秸秆与多年生黑麦草混合青贮发酵品质的研究[J].草业学报,2012,21(4):325-330.
[15]王奇,余成群,李志华,等.添加酶和乳酸菌制剂对西藏苇状羊茅和箭筈豌豆混合青贮发酵品质的影响[J].草业学报,2012,21(4):186-191.
[16]荣辉,余成群,陈杰,等.添加绿汁发酵液、乳酸菌制剂和葡萄糖对象草青贮发酵品质的影响[J].草业学报,2013,22(3):108-115.
[17]荣辉,徐安凯,下条雅敬,等.初次刈割象草青贮发酵品质动态[J].草地学报,2009,17(4):537-539.
[18]Yuan X J,Yu C Q,Shimojo M,etal.Improvement of fermentation and nutritive quality of straw-grass silage by inclusion of wet hulless-barely distillers’grain in Tibet[J].Asian-Australia journal Animal Science,2012,25(4):479-485.
[19]McDonald P,Henderson A R.The use of fatty acids as grass silage additives[J].Journal of the Science of Food and Agriculture,1974,25(7):791-795.
[20]Randby A T.The effect of some acid-based additives applied to wet grass crops under various ensiling conditions[J].Grass and Forage Science,2000,55(4):289-299.
[21]王力生,齐永玲,陈芳,等.不同添加剂对笋壳青贮发酵品质和营养价值的影响[J].草业学报,2013,22(5):326-332.
[22]Filya,Sucu E.The effects of lactic acid bacteria on the fermentation,aerobic stability and nutritive value of maize silage[J].Grass Forage Science,2010,65(4):446-455.
[23]Britt D G,Huber J T,Rogers A L.Fungal growth and acid production during fermentation and refermentation of organic acid treated corn silages[J].Journal of Dairy Science,1975,58(4):532-539.
[24]Wilkinson J M,Davies D R.The aerobic stability of silage:key findings and recent developments[J].Grass and Forage Science,2012,68(1):1-19.
[25]Driehuis F,Oude Elferink S J W H,Van Wikselaar P G.Fermentation characteristics and aerobic stability of grass silage inoculated withLactobacillusbuchneri,with or without homofermentative lactic acid bacteria[J].Grass and Forage Science,2001,56(4):330-343.
[26]Schmidt R J,Kung L.The effects ofLactobacillusbuchneriwith or without a homolactic bacterium on the fermentation and aerobic stability of corn silages made at different locations[J].Journal of Dairy Science,2010,93(4):1616-1624.
