足月新生儿低血糖22例磁共振表现与临床特征
2013-12-26顾秋芳胡黎园邵肖梅程国强王来栓周文浩
顾秋芳 胡黎园 陈 超 曹 云 邵肖梅 程国强 王来栓 朱 珍 周文浩
·论著·
足月新生儿低血糖22例磁共振表现与临床特征
顾秋芳1,2胡黎园1,2陈 超1曹 云1邵肖梅1程国强1王来栓1朱 珍1周文浩1
目的 探讨足月新生儿低血糖病例的MRI表现及临床特征的相关性。方法 回顾性分析2008年6月1日至2011年6月30日复旦大学附属儿科医院新生儿科收治的22例足月低血糖新生儿的病例资料,根据MRI检查结果分为低血糖MRI-组(n=9)和低血糖MRI+组(n=13),分析两组低血糖新生儿的临床特征并描述低血糖MRI+组的MRI表现。结果 MRI-组和MRI+组在有无围生期高危因素中的差异无统计学意义(P=0.054);MRI-组和MRI+组低血糖首次发现时间分别为1(0.5~17)h和46.6(12.7~78.3)h,两组差异有统计学意义P=0.000;MRI-组和MRI+组血糖正常并稳定的时间分别为(54.1±18.2)h和(71.6±15.1)h,两组差异有统计学意义P=0.023。出现症状的比例MRI+组高于MRI-组(P=0.000)。MRI+组中10例低血糖新生儿的MRI表现以累及双侧枕顶叶为主,3例不伴双侧枕顶叶损伤(1例累及单侧顶枕叶,2例为侧脑室旁和半卵圆中心斑点状白质损伤)。 结论 对于存在高危因素的低血糖新生儿,应早期筛查,定期监测;生后12 h内发现的低血糖新生儿可无症状,MRI可无脑损伤性改变;血糖正常并稳定的时间指标提示对低血糖脑损伤更要注意远期随访。双侧顶枕叶是新生儿低血糖脑损伤的主要受累部位。
低血糖; 新生儿; 脑损伤; 磁共振成像

1 方法
1.1 低血糖的诊断标准 不同检测方法下血标本血糖值<2.6 mmol·L-1。
1.2 纳入标准 ①以低血糖住院的、或住院期间诊断低血糖的、出生胎龄≥37周的新生儿;②至少记录到2次以上以纸片法末梢血检测的新生儿低血糖值;③生后1个月内在我院行MRI检查。
1.3 排除标准 存在以下任意1项被排除:①出生时AGAR评分≤7分;②明确的宫内窘迫史;③缺氧缺血性脑病(HIE);④败血症;⑤化脓性脑膜炎;⑥先天脑发育畸形;⑦染色体异常;⑧先天性代谢性疾病;⑨内分泌疾病。
1.4 病例收集 从我院电子病例系统检索出院诊断为新生儿低血糖病例,依据本文纳入和排除标准,复习病例进行筛选。
1.5 采集指标和定义 ①低血糖新生儿的围生期资料:性别;胎龄;出生体重;分娩方式(剖宫产,顺产);是否大于胎龄儿(LGA)或小于胎龄儿(SGA);母亲妊娠期糖尿病或妊高症:根据病史记载分为有或无、病史中未记载为不详。②低血糖新生儿的血糖资料:低血糖首次发现时间(首次血糖值);血糖正常并稳定的时间:当血糖检测持续正常后,以第1次正常的时间点至胎儿娩出的时间差值。③低血糖新生儿临床表现:惊厥、反应差、震颤、激惹、抽搐、嗜睡、喂养困难、肌张力低下、多汗、阵发性发绀、低体温和呼吸暂停等。④足月新生儿低血糖高危因素:LGA、SGA、红细胞增多症、母亲妊娠期糖尿病和母亲妊高症。
根据统一设计和定义的低血糖新生儿的围生期资料、血糖资料和临床表现的采集指标表格,双人双份录入,遇有分歧核对原病历。
统一调取筛选病例MRI资料,由我院1名影像科医生单独读片,阅片医生仅知晓病例为足月新生儿低血糖病例,但不清楚具体血糖水平和临床表现。
1.6 头部MRI扫描 西门子AVANT 1.5T超导型MR扫描系统。常规MR序列包括矢状位T1WI,轴位T1WI、T2WI、Dark-fluid像扫描,层厚4 mm,层间隔0.32 mm。矢状位T1WI,TR:550 ms,TE:12 ms;轴位T1WI采用SE序列,TR:550 ms,TE:12 ms;轴位T2WI采用TSE序列,TR:5 200 ms,TE:92 ms;轴位Dark-fluid像:TR:7 000 ms,TE:120 ms,TI:2 200 ms。DWI采用单次激发SE-EPI序列,TR:2 900 ms,TE:90 ms;NEX=1,b值0 s·mm-1和1 000 s·mm-1,扫描时间57 s。检查前15~30 min均给予苯巴比妥(5或10 mg·kg-1)镇静,待患儿完全熟睡后放置于扫描床上,用棉花团堵塞外耳道,头部用棉垫适当固定。在进行MRI扫描前均告知父母并签字同意。
1.7 分组考虑 鉴于头颅MRI和弥散成像技术(DWI)相结合,是目前诊断新生儿低血糖颅脑损伤较敏感和特异的检查方法[8],本文以头颅MRI表现,分为脑损伤(MRI+)组和无脑损伤(MRI-)组。
1.8 低血糖治疗方法及治疗反应性 依照我院制定的新生儿低血糖诊疗常规处理。出现症状性低血糖时或严重的低血糖时,首先予以10%葡萄糖2 mL·kg-1静脉注射,后提高至6~10 mg·kg-1·min-1。如血糖仍低于正常值,重复以上静脉注射。若提高至12 mg·kg-1·min-1仍不能达到目标血糖值,予以氢化可的松5 mg·kg-1·d-1,每12 h静脉滴注,同时检查血浆皮质醇、胰岛素、生长激素和甲状腺素等水平。本文采用纠正低血糖治疗的前5次血糖值变化来评价MRI+组病例低血糖的治疗反应性。
2 结果
2.1 一般情况 2008年6月1日至2011年6月30日符合本文纳入标准,并经严格排除标准筛选出23例足月新生儿低血糖病例,在MRI阅片过程中有1例头颅MRI提示脑梗塞,也予以排除。病例筛选流程见图1。

图1 病例纳入流程
Fig 1 Flow chart of patient selection
22例足月新生儿低血糖患儿中男16例,女6例,胎龄(38.3±1.2)周,出生体重(2 946.8±900.5)g,均于生后4 d内入本院。表1显示足月新生儿低血糖MRI-组和MRI+组围生期的7个指标,差异均无统计学意义。外院首诊低血糖14例,MRI-组和MRI+分别9和5例;我院首诊低血糖8例,均为MRI+。MRI-和MRI+组分别有2和9例患儿在纠正低血糖过程中应用了糖皮质激素。MRI扫描时间在MRI-组和MRI+组分别为出生后2~25(11.3±8.0) d和3~24(8.2±5.7) d。
2.2 MRI-组和MRI+组血糖水平、临床特征 MRI-组和MRI+组低血糖首次发现时间分别为1(0.5~17) h和46.6(12.7~78.3) h,差异有统计学意义(P=0.000),MRI-组中1例生后14 h外院发现皮肤青紫,至生后17 h发现低血糖,最终诊断为红细胞增多症;MRI-组和MRI+组血糖正常并稳定的时间分别为(54.1±18.2)h和(71.6±15.1)h,两组差异有统计学意义(P=0.023);需要说明的是,在统计两组低血糖首次发现时间中,分别有4例难以准确确定具体的首次发现时间,仅能根据病史推算,本文推算的方法是,如病史记录为生后第1天血糖低于正常值,即推算为24 h与出生时间差值,如病史记录为生后第2天血糖低于正常值,即推算为36 h与出生时间差值。MRI-组和MRI+组存在围生期高危因素分别为9(100%)和8例(61.5%),差异无统计学意义(P=0.054);MRI-组仅1例有低血糖临床表现(面色青紫、呼吸暂停),MRI+组病例均有低血糖临床表现,差异有统计学意义(P=0.000)。
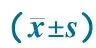

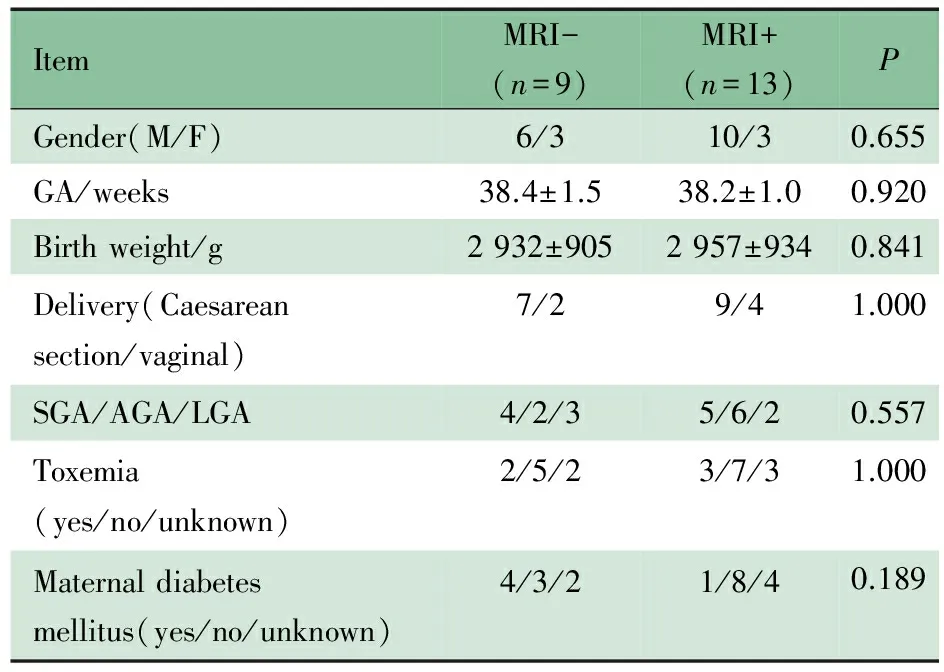
ItemMRI-(n=9)MRI+(n=13)PGender(M/F)6/310/30.655GA/weeks38.4±1.538.2±1.00.920Birthweight/g2932±9052957±9340.841Delivery(Caesareansection/vaginal)7/29/41.000SGA/AGA/LGA4/2/35/6/20.557Toxemia(yes/no/unknown)2/5/23/7/31.000Maternaldiabetesmellitus(yes/no/unknown)4/3/21/8/40.189
Notes GA: gestational age
2.3 MRI-组和MRI+组MRI表现 MRI-组病例均无脑损伤影像学表现,2例脑外间隙略宽。MRI+组病例存在不同程度的脑损伤影像学表现,但未见弥漫性病变,均表现为局限性病变。伴双侧枕叶和(或)顶叶病变10例,其中1例仅累及枕叶,累及胼胝体压部7例,4例伴白质区斑点状脑损伤改变, 1例累及左侧内囊后肢和外囊(图2A~D)。不伴双侧枕叶和(或)顶叶病变3例,1例为双侧半卵圆中心斑点状白质损伤,侧脑室三角区多发小的白质软化;1例为左侧顶枕叶皮质和皮质下白质病变;1例为双侧脑室旁白质斑点状损伤(图2E~H)。
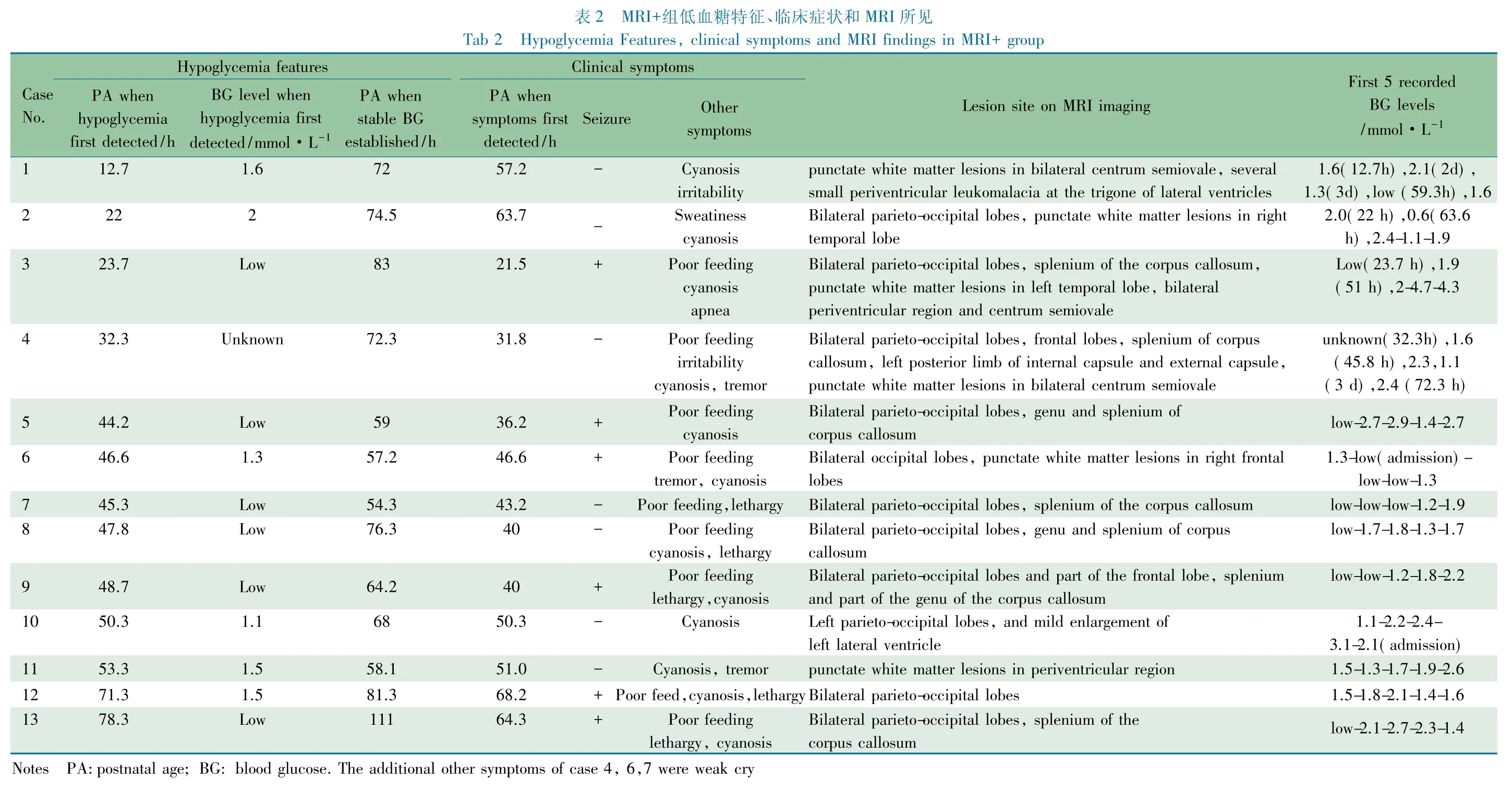
2.4 MRI+组病例血糖形式、临床表现与MRI所见 表2显示,例5~9、12和13除首次检测到低血糖时的血糖值≤1.5 mmol·L-1外,对治疗的反应也不满意,血糖水平持续或反复偏低,难以纠正,MRI表现以累及双侧顶枕叶为主。例10和11的临床症状表现较轻,低血糖对治疗的反应较快,例10 MRI表现累及单侧顶枕叶皮质和皮质下白质,例11表现为双侧脑室旁白质斑点状损伤。例1~4在外院首次发现低血糖,纠正低血糖治疗的前5次血糖值为非连续值。
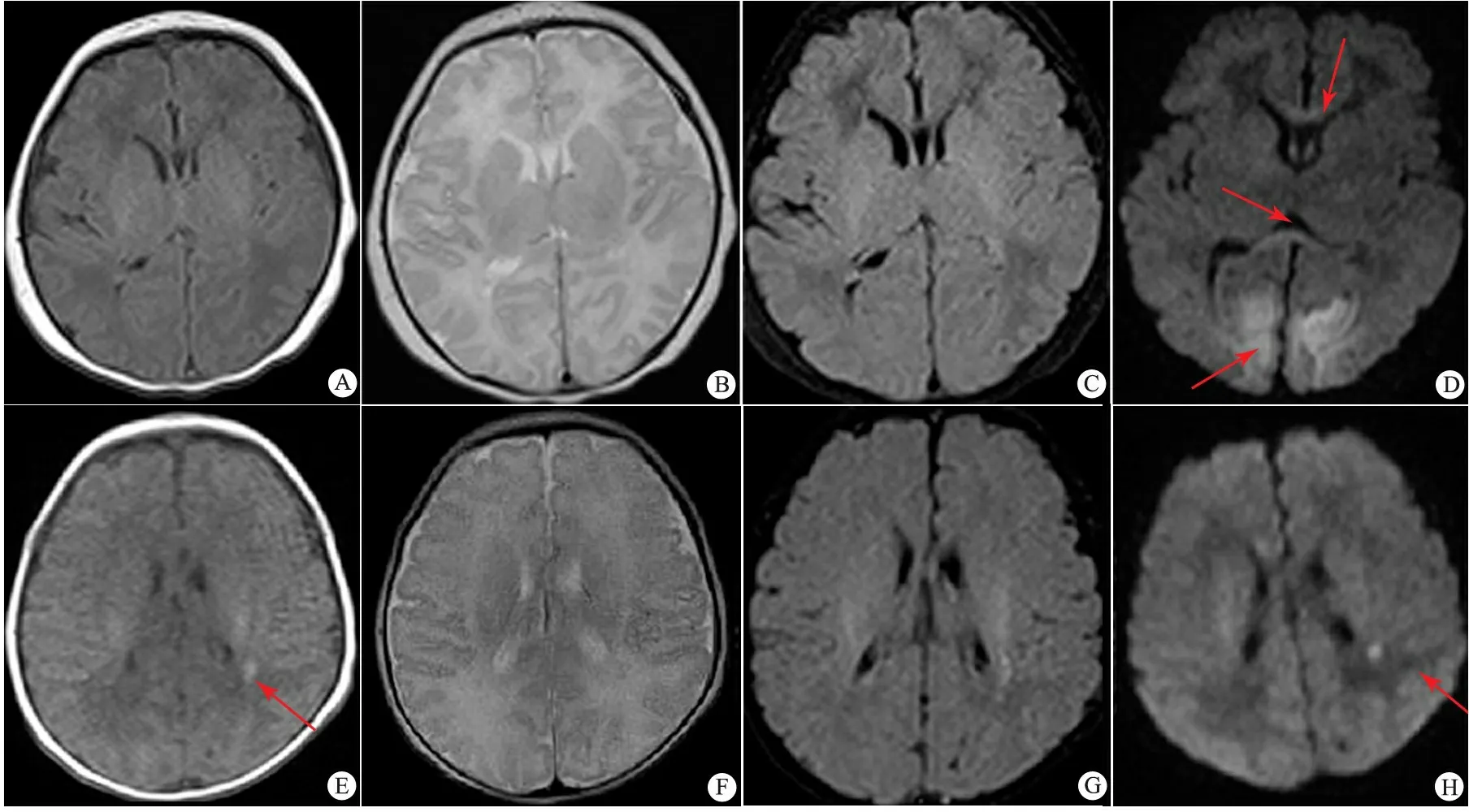
图2 本文例8和11患儿头颅MRI所见
Fig 2 Head MRI findings of case 8 and case 11
Notes A-D were seen at the age of 5 d of case 8, with poor feeding, lethargy and cyanosis at postnatal age of 40 h, then admitted to our hospital at the age of 47.8 h, serial blood glucose levels were low, 1.7, 1.8, 1.3 and 1.7 mmol·L-1. A(T1WI), B(T2WI), C(Tirm) showed loss of grey-white matter differentiation in the occipital lobes. D(DWI) showed high signal in occipital regions, splenium and genu of corpus callosum. E-H were seen at the age of 8 d of case 11, with tremor and cyano, it was not distinct on F(T2WI) and G(Tirm). H(DWI) showed high singal in the same region
3 讨论
本研究为回顾性的病例分析,将可能发生脑损伤的疾病予以排除后,进入分析的为足月新生儿低血糖病例。本文以低血糖新生儿的围生期因素、低血糖形式、临床表现和治疗反应性作为观察指标,以低血糖干预后头颅MRI是否存在脑损伤作为结局指标。需要指出的是,影像学上的阴性结果并不意味着患儿的远期预后不受影响,已有研究发现无症状的低血糖也能引起不良神经系统后遗症的发生[9]或者神经机能上的失调[10]。有关新生儿低血糖的研究,缺憾和难点也正在于缺乏长期的有价值的随访结局。
本文足月新生儿低血糖MRI- 组 和MRI +组LGA、SGA、母妊娠期糖尿病、妊高症的围生期因素差异均无统计学意义,说明当存在上述危险因素时,新生儿低血糖的筛查是必要的。本文MRI-组9例均存在至少1项围生期危险因素,没有造成影像学意义的脑损伤,与存在低血糖危险因素而进行血糖筛查(平均筛查时间为1 h),首次发现低血糖时间早并及时干预有关。本文MRI+组中8例也存在围生期危险因素(均为外院首诊病例),与未行血糖筛查或筛查不规范有关,首次低血糖发现时间达12.7~78.3 h,头颅MRI表现为脑损伤,说明围生期有危险因素的新生儿应当常规进行血糖监测,并进行积极干预,降低脑损伤发生率;对有围生期危险因素的新生儿除应常规筛查低血糖外,还应持续检测血糖,Holtrop等[11]报道非糖尿病母亲婴儿中LGA和SGA发生低血糖的平均时间分别为生后2.9(0.8~8.5)和6.1(0.8~34.2) h,因此建议可在生后12 h 停止对LGA的监测,而SGA的低血糖筛查应延长至生后48 h。本文MRI+组有5例未体现围生期危险因素,均为出现低血糖临床症状时(生后31.8~68.2 h)才检测血糖,首次低血糖发现时间32.3~71.3 h,头颅MRI均存在伴双侧枕叶和(或)顶叶病变脑损伤的结局,可能与识别危险因素的意识和能力不足有关,也可能与喂哺不足有关[12],也可能是不明原因的低血糖[13, 14]病例,如何早期筛查这部分人群是临床研究的难点所在。
Alkalay等[15]报道了89例有持续影像学改变、组织病理学结果异常或有神系统经后遗症的低血糖新生儿,其中95%的患儿低血糖发现时间在生后10 h 或更长。另外,Singh等[16]对43 例症状性低血糖新生儿和64例无症状性低血糖新生儿的研究发现,无症状性低血糖发生时间早于症状性低血糖,生后(4.5±2.2)vs(18.5±5.4)h,P<0.001,15个月神经发育随访时的智力发育指数和运动发育指数,伴发惊厥的症状性低血糖患儿低于有其他症状及无症状的低血糖患儿(P<0.001),有其他症状的低血糖患儿低于无症状性低血糖患儿(P<0.001)。这些研究提示低血糖发现时间晚、伴有临床症状或症状重的低血糖患儿易发生神经系统不良后遗症。本研究中,MRI+组中低血糖患儿的临床特征与上述研究中的发现相似。本文MRI+组与MRI-组病例比较,生后12 h内发现的低血糖新生儿可保持无症状,MRI可无脑损伤性改变。既往文献除重视低血糖的首次发现时间外,也很重视低血糖持续时间,本文MRI+组5例未体现围生期危险因素的低血糖新生儿,发现低血糖症状后才检测血糖,其低血糖发生时间可能远早于检测出低血糖时间,本研究首次提出了血糖正常并稳定的时间这个指标,这个指标的定义为:当血糖检测持续正常后,以第一次正常的时间点至胎儿娩出的时间点,将低血糖可能存在的时间做了最差的估计,这一指标至少指引了以下几个方面的意义,低血糖发现时间、发现至纠正低血糖时间、纠正低血糖的难易程度、出生至低血糖发现时间和出生至低血糖纠正时间,这对那些存在围生期危险因素而没有进行血糖筛查或筛查不正规的低血糖新生儿,对那些出现低血糖症状而发现低血糖新生儿的远期随访意义更大,提示这部分新生儿不仅要重视低血糖干预后头颅MRI提示的脑实质损伤,更要重视其远期的神经系统预后。
目前,新生儿低血糖时的影像学表现除典型的双侧顶枕叶皮质及皮质下白质脑损伤外,其他部位损伤的报道甚少。在Kinnala等[17]研究中22%(4/18)的症状性低血糖患儿MRI表现为枕叶脑室周围白质斑点状异常信号或丘脑损伤,MRI表现不同于较严重的双侧顶枕叶脑损伤模式。低血糖出现时间早(15±1)h,持续时间短(10±10)h,低血糖程度轻,最低值(1.4±0.7) mmol·L-1,临床表现主要为抖动和激惹等较轻的症状,这些MRI改变有较好的恢复趋势,而对照组(血糖正常的健康新生儿)的头颅B超和MRI在枕叶脑室周围未发现异常[17]。本研究中3例症状性低血糖患儿MRI改变不伴双侧顶枕叶损伤,例1和12为侧脑室旁和半卵圆中心斑点状白质损伤,例11累及单侧顶枕叶,由于本研究已排除了围生期窒息及HIE的患儿,推测这可能是低血糖所致的不典型MRI表现,其MRI改变的原因可能与这些低血糖患儿被及时发现并治疗有关,这部分患儿临床表现相对较轻,低血糖对治疗的反应较快。也许这些影像学改变与低血糖无关,与某些未被明确的致脑损伤因素的作用或与个体的易感性有关,在以后的临床研究中也需关注这类“较轻”的症状性低血糖患儿,并对其影像学和神经系统发育情况进行随访结局。
本研究存在以下不足:①由于本研究中大部分采用试纸法监测末梢血糖,而不是采用标准的己糖激酶法检测血浆血糖,致所测血糖值与实际血糖值可能存在一定的误差;②本文为回顾性研究,部分临床资料(低血糖的发现时间、母亲的围生期疾病)可能不够完整和准确。③虽然本研究排除了常见的致脑损伤的疾病,但可能导致缺氧的因素(如妊高症等)对MRI表现的影响尚不清楚,鉴于低血糖与窒息对脑损伤的协同作用[18, 19],不排除这些因素是低血糖时发生或加重脑损伤的危险因素。④本研究中影像学上的阴性结果并不提示患儿的远期预后不受影响,同样纠正低血糖后的影像学上的阳性结果也并不意味远期神经系统发育的情况,本文缺乏远期的跟踪随访。
总之,本研究中,出生后早期(12h内)发现并干预的低血糖可无症状,而延迟发现及血糖控制不理想常为症状性低血糖。低血糖的发现时间晚、血糖正常并稳定的时间以及出现低血糖症状对提示MRI的脑损伤改变具有重要价值。本研究中低血糖脑损伤的MRI表现以累及双侧顶枕叶为主。对于临床表现和低血糖程度相对较轻的低血糖新生儿,其临床特征与MRI表现的关系尚需进一步研究。通过识别母亲妊娠、分娩及新生儿出生时的高危因素,早期筛查血糖十分必要,及时识别低血糖的临床症状并正确治疗低血糖,维持血糖于稳定的浓度,以预防神经系统后遗症的发生。
[1]Duvanel CB, Fawer CL, Cotting J, et al. Long-term effects of neonatal hypoglycemia on brain growth and psychomotor development in small-for-gestational-age preterm infants. J Pediatr,1999,134(4):492-498
[2]Per H, Kumandas S, Coskun A, et al. Neurologic sequelae of neonatal hypoglycemia in Kayseri, Turkey. J Child Neurol,2008,23(12):1406-1412
[3]Caraballo RH, Sakr D, Mozzi M, et al. Symptomatic occipital lobe epilepsy following neonatal hypoglycemia. Pediatr Neurol,2004,31(1):24-29
[4]Barkovich AJ, Ali FA, Rowley HA, et al. Imaging patterns of neonatal hypoglycemia. AJNR Am J Neuroradiol,1998,19(3):523-528
[5]Spar JA, Lewine JD, Orrison WJ. Neonatal hypoglycemia: CT and MR findings. AJNR Am J Neuroradiol,1994,15(8):1477-1478
[6]Filan PM, Inder TE, Cameron FJ, et al. Neonatal hypoglycemia and occipital cerebral injury. J Pediatr,2006,148(4):552-555
[7]Mao J(毛健), Chen LY, Fu JH, et al.Clinical evaluation of neonatal hypoglycemic brain injury demonstrated by serial MRIs.Chin J Contemp Pediatr(中国当代儿科杂志),2008,10(2):115-120
[8]Mao J(毛健),Chen LY,Fu JH, et al. Clinical evaluation by MRI on the newborn infants with hypoglycemic brain damage. Chin J Pediatr(中华儿科杂志),2007,45(7):518-522
[9]Lucas A, Morley R, Cole T J. Adverse neurodevelopmental outcome of moderate neonatal hypoglycaemia. BMJ,1988,297(6659):1304-1308
[10]Stenninger E, Flink R, Eriksson B, et al. Long-term neurological dysfunction and neonatal hypoglycaemia after diabetic pregnancy. Arch Dis Child Fetal Neonatal Ed,1998,79(3):F174-F179
[11]Holtrop PC. The frequency of hypoglycemia in full-term large and small for gestational age newborns. Am J Perinatol,1993,10(2):150-154
[12]Moore AM, Perlman M. Symptomatic hypoglycemia in otherwise healthy, breastfed term newborns. Pediatrics,1999,103(4 Pt 1):837-839
[13]Burns CM, Rutherford MA, Boardman JP, et al. Patterns of cerebral injury and neurodevelopmental outcomes after symptomatic neonatal hypoglycemia. Pediatrics,2008,122(1):65-74
[14]Dalgic N, Ergenekon E, Soysal S, et al. Transient neonatal hypoglycemia--long-term effects on neurodevelopmental outcome. J Pediatr Endocrinol Metab,2002,15(3):319-324
[15]Alkalay AL, Flores-Sarnat L, Sarnat HB, et al. Plasma glucose concentrations in profound neonatal hypoglycemia. Clin Pediatr (Phila),2006,45(6):550-558
[16]Singh M, Singhal PK, Paul VK, et al. Neurodevelopmental outcome of asymptomatic & symptomatic babies with neonatal hypoglycaemia. Indian J Med Res,1991,94:6-10
[17]Kinnala A, Rikalainen H, Lapinleimu H, et al. Cerebral magnetic resonance imaging and ultrasonography findings after neonatal hypoglycemia. Pediatrics,1999,103(4 Pt 1):724-729
[18]Vannucci RC, Nardis EE, Vannucci SJ. Cerebral metabolism during hypoglycemia dn asphyxia in newborn dogs. Biol Neonate,1980,38(5-6):276-286
[19]Tam EW, Haeusslein LA, Bonifacio SL, et al. Hypoglycemia is associated with increased risk for brain injury and adverse neurodevelopmental outcome in neonates at risk for encephalopathy. J Pediatr,2012,161(1):88-93
The relationship between the MRI findings and clinical features in 22 full-term infants with neonatal hypoglycemia
GUQiu-fang1,2,HULi-yuan1,2,CHENChao1,CAOYun1,SHAOXiao-mei1,CHENGGuo-qiang1,WANGLai-shuan1,ZHUZhen1,ZHOUWen-hao1
(1Children′sHospitalofFudanUniversity,Shanghai201102,China; 2hasequalcontribution)
ZHU Zhen, E-mail: zhuzhen928@163.com; ZHOU Wen-hao, E-mail: zhou_wenhao@yahoo.com.cn
ObjectiveTo evaluate the relationship between the MRI findings and clinical characteristics in full-term infants with neonatal hypoglycemia. MethodsThe clinical records of 22 neonates with isolated hypoglycemia who were referred to Children′ Hospital of Fudan University from June 1, 2008 to June 30, 2011 were reviewed retrospectively. The patients were divided into two groups according to the early magnetic resonance imaging (MRI) findings: MRI -group (n=9) were patients who showed normal brain imaging while MRI + group (n=13) were patients who showed abnormal brain imaging finding. The clinical characteristics of neonatal hypoglycemia were compared between two groups. The brain injury patterns identified from early MRI scans were presented. ResultsThe frequencies of risk factors for hypoglycemia were similar in two groups (P=0.054). The duration when hypoglycemia was first detected was 1(0.5-17) h in MRI- group and 46.6(12.7-78.3) h in MRI+ group, respectively,P=0.000. MRI- group established stable blood glucose levels faster than the MRI+ group, (54.1±18.2) hvs(71.6±15.1) h,P=0.023. The occurrences of symptoms were more frequent in MRI + group than MRI - group (P=0.000). Among MRI +group, 10 had predominant bilateral parieto-occipital cortex and subcortical white matter abnormalities, 1 had unilateral occipital and parietal area lesions, 2 had punctate white matter lesions in periventricular region or centrum semiovale.ConclusionsScreening and management of babies at risk for neonatal hypoglycemia are recommended. Infants who were identified less than 12 hours of postnatal age remained asymptomatic, and there were no changes in the MRI imaging. The duration from birth till establishment of the stable blood glucose levels might be suggestive of association with neuroimaging changes and long-term neurological changes. The most common area of hypoglycemia-associated brain injury was in the parietal and occipital lobes.
Hypoglycemia; Newborn; Brain injury; Magnetic resonance imaging
上海市卫生局课题:新生儿低血糖脑损伤的MRI研究(2008192)
1 复旦大学附属儿科医院 上海,201102;2 共同第一作者
朱珍,E-mail:zhuzhen928@163.com;周文浩,E-mail:zhou_wenhao@yahoo.com.cn
10.3969/j.issn.1673-5501.2013.02.007
2012-10-17
2013-03-29)
张崇凡)
