功能化葡聚糖用于三维细胞培养及发展前景
2013-12-25朱长皓张天柱胡克张启英郭兆彬顾宁
朱长皓,张天柱,胡克,张启英,郭兆彬,顾宁
(东南大学生物科学与医学工程学院,江苏省生物材料与器件重点实验室,江苏南京 210009)
大部分的细胞培养研究都在二维表面进行,如微孔板、组织培养瓶、培养皿[1-3],该方法简单、快捷、细胞存活率较高。这种传统的二维细胞培养系统明显地促进了对细胞生物学的理解,但同时也存在缺点。在体内,几乎所有的组织细胞都生活在细胞外基质(ECM)中,这些ECM包含了复杂的三维纤维网络,提供复杂的生物和物理信号[4]。二维基板在模拟三维微环境这方面有所限制,因为缺乏一定的结构和材料的局限性。此外,生长在二维刚性基板上的细胞需要有相当大的适应性,因为其缺乏特定的ECM。这些缺点可能会改变细胞的新陈代谢,降低其相应的功能。出于这个原因,二维细胞培养不仅影响细胞复杂的动态的生长环境,而且有可能歪曲实验结果,因为这是强制细胞适应这种环境而获得的检测结果[5-7]。三维细胞培养基质或者称为支架,克服了二维的限制,这些基质或者支架都是多孔结构,可以支持细胞生长、繁殖和分化。材料的多样性和可塑性在三维基质中更加突出,需要考虑一定的孔隙率、透气性能、纳米尺度的表面形貌。
1 材料标准
人工三维细胞培养基质设计的最终目标是充分模拟体内的ECM结构,使得体外细胞生活的环境和其在体内相似。ECM是由细胞产生并分泌到细胞外周质中的物质,主要包括纤维成分(如胶原和弹性蛋白)、连接蛋白(如纤连蛋白等)和填充分子(通常是糖胺聚糖)等。这些独特的成分和结构提供相应的生物物理和生化功能,如促进可溶性信号分子,营养和代谢废物的运输,并提供机械性能[8]。ECM和细胞之间的作用是动态的、相互的,ECM可以引导细胞向特定的方向分化,细胞也会回馈它们的生存环境,通过降解和合成新的ECM来重塑生存环境[9-10]。
三维基质结构必须有一定的尺度,这点对于模仿生物系统非常重要,因为大自然衍生出的性质往往源于多尺度、多层次结构[11]。在这里,我们定义三维细胞基质有3种尺度:宏观尺度(10-1~10-3m)、微观尺度(10-3~10-6m)、纳米尺度(10-6~10-9m)。宏观尺度结构决定了基质的特性包括大小和形状,对于体外三维细胞培养应用,大小和形状决定了其方便性和功能性[12]。在微观尺度上的可控性对于模拟微组织结构是相当有价值的,如ECM中的多细胞空间结构。虽然微型结构应该针对于不同的部位,但是基本的设计参数如孔隙度、孔隙的连通性、几何形状、孔隙分布以及表面形貌是共通的[13]。微观结构影响三维细胞中物质的运输便利。此外,微观尺度的表面特性可以激活某些基因或者调解细胞的增殖和分化,因为细胞和ECM之间通过纳米尺度的蛋白质进行作用,调解各种细胞活动来维持ECM环境[14]。因此,特别注意纳米尺度的设计是无可厚非的,大部分ECM成分都是纳米级的。例如胶原纤维的直径在50~200 nm,纤维连接蛋白长60~70 nm,厚3 nm[15]。除了微量营养的供给,纳米尺度的结构特点提供了对大部分细胞功能有影响的表面形貌。这并不奇怪,因为许多细胞信号机制涉及到纳米尺度的分子,纳米尺度的表面已经被证实可以调解细胞黏附、组织形态和分化[16]。
目前用于三维细胞培养的材料分为天然材料和合成材料两种(表1)[17],这些材料的先天属性已经通过检验,但是想要模拟ECM结构,我们需要了解以下一些参数:(1)生物相容性,这是一个关键的参数,因为它决定了细胞对于材料的适应性,即细胞不会引起明显的排异反应。天然材料往往表现出比合成材料更好的生物相容性,但是由于动物源提高了疾病传染的可能。合成材料制造过程更加严格,尽可能少使用带毒性化学药品来保证其生物相容性[18]。(2)润湿性。由于自然的ECM是完全的水合凝胶,润湿是一个重要的因素。更多的亲水性材料对于模拟体内环境比较好,出于这个原因,水凝胶已经被广泛用于三维细胞培养,但是水凝胶的亲水性阻碍了细胞在其表面的黏附,为了克服这一缺点,有人采用在这些材料表面嵌入RGD短肽,以促进细胞在其表面黏附[19]。(3)透明度。细胞体外三维培养需要显微镜的观察,因此必须考虑到材料的透明度。许多传感和定量分析技术,如染色和酶联免疫吸附试验同样也要使用光学仪器,还包括共聚焦显微镜。因此,透明材料有利于光信号通过而没有光束消散[20]。(4)可控的生物降解性。不管是植入人体还是体外培养细胞,最后都必须消除这些支架。一般来说,合成材料通过水解而天然材料通过酶降解,水降解比酶降解更有可预见性和可调节性,天然材料的酶降解更依赖于该酶的浓度[21]。(5)机械性能。细胞培养基质的机械性能几乎全部体现在材料上,这一点在组织工程中体现比较强烈。例如,骨再生支架如果不能承担足够的负荷,就有可能在骨愈合之前断裂。然而,过度强大的机械性能破坏相邻的骨组织结构[22]。因此,三维细胞培养基质的选择需综合以上各个因素,才能更完美地模拟出细胞生长的环境。

表1 三维细胞培养常用材料
2 功能化葡聚糖三维支架
在众多材料中,葡聚糖是天然的、非动物源的多糖分子,它不是单糖而是低聚糖,葡聚糖按照组成它的单糖——葡萄糖的单元数目分为葡聚糖100 K、葡聚糖40 K和葡聚糖20 K等系列聚合物。葡聚糖分子式为[C6H10O5]n,结构式见图1。
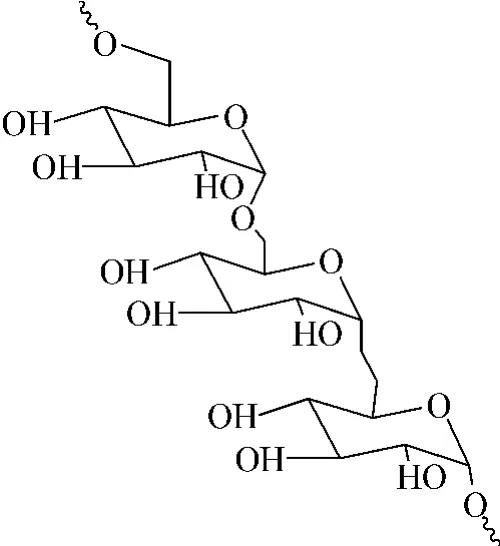
图1 葡聚糖结构式
它难溶于水,不溶于乙醇、乙醚等有机溶剂,本身虽然抗蛋白质吸附和细胞黏附,但其结构中含有丰富的羟基官能团,使得它易于化学修饰,已经被广泛用于二维或者多孔软组织支架、药物释放等领域。它来源广泛、价格便宜,可以通过酶来降解,完全可以用来作为三维细胞培养的材料[23-26]。
2.1 葡聚糖凝胶
新加坡南洋理工大学刘云萧利用葡聚糖进行改性合成DEX-MA-AD,使用红外和核磁对此进行了表征,并于平滑肌细胞进行三维封装培养。证明了葡聚糖明胶交联的凝胶具有较高的弹性模量,也适合平滑肌细胞的三维培养和内皮细胞的二维培养。使用葡聚糖的双官能管与甲基丙烯酸甲酯改性,醛基与明胶上的氨基结合,紫外光交联形成凝胶与血管平滑肌细胞封装培养。以Dex-MA-AD为主要成分的水凝胶的弹性性能明显优于以PEG为主材料的水凝胶(图2)。而明胶纳入水凝胶中增加了细胞黏附性和酶降解性,并且增加了抗压强度,通过希夫碱来改变凝胶的交联密度。实验发现,水凝胶促进血管内皮细胞在二维培养条件下的黏附性以及三维培养条件下平滑肌细胞的传播,血管增生长达14 d。这种水凝胶的力学性能对于2D和3D培养都具有吸引力,是一种很有前途的细胞培养基质[27]。

图2 合成Dex-MA-Ly示意图
中国科学院的蔡琴等利用葡聚糖和聚乳酸进行混合,他采用的是溶剂铸造法,将葡聚糖和PLA溶于二氯甲烷和笨的混合物中,但首先葡聚糖先进行TMS的保护,葡聚糖的羟基可以通过甲醇很容易去除TMS的保护而恢复。通过此方法形成具有微孔结构的薄膜,它是由于相分离而形成的,因为PLA和TMSD在二氯甲烷和苯的混合液中的溶解度不同。通过这种技术,PLA和聚乳酸-葡聚糖混合支架就制作出来了,采用粒子浸出法出现了5~10 mm的微孔,这导致支架具有较高的孔隙率和开放多空结构。通过比较纯PLA和聚乳酸-葡聚糖,后者表面亲水性明显改善,它具有良好的细胞亲和性和生物相容性,增强细胞的黏附效率,促进细胞增殖渗透到支架内部并进行增殖,这种材料也是非常具有潜在前途的细胞支架[28]。
另外,加拿大的Ryan M.Lima小组利用葡聚糖和PEG不混溶性,期间葡聚糖与甲基丙烯酸酯进行交联。通过控制葡聚糖的甲基丙烯酸甲酯的取代程度,葡聚糖的摩尔质量和PEG的浓度创造了大孔水凝胶,溶液中PEG的存在对于葡聚糖凝胶的最后形态具有非常重要的影响,导致形成了不同类型的结构形态,从微孔凝胶到大孔凝胶到相互连接的串珠状结构,一系列的配方图表编制使得他们确定哪种条件才能得到相互关联的串珠状结构。葡聚糖大孔串珠状结构含有很高的水分,在89%到94%之间,通过电镜表征形态均匀。这种支架将在小鼠3T3成纤维细胞培养中具有重要的作用,可以调查细胞渗透、细胞间相互作用[29]。
2.2 葡聚糖微载体
微载体培养(microcarrier culture)是一种用于高产量培养贴壁细胞的实用技术。CytodexTM专用于培养各类动物细胞,其培养体积可以从数毫升到6 000 L以上。应用Cytodex微载体技术,可以实现简单的贴壁细胞(CHO、Cl27、Vero、COS、CV-1 等)悬浮化培养,每毫升培养液可得到数百万细胞。微载体适于摇瓶、转瓶、搅拌罐以及WAVE生物反应器等各种培养系统。Cytodex的设计能够满足微载体技术的特殊需要。它的特点有:(1)Cytodex的大小和密度经优化处理,以保证培养各类细胞时使其生长良好,产量提高。(2)培养基架为生物学惰性,可为悬浮微载体培养提供坚实而非刚性的培养面。(3)微载体透明,可直接使用显微镜观察或染色后观察。
Cytodex 1以交联葡聚糖基架(cross-linked dextran matrix)为基础,该基架被带正电荷的N,N二乙胺基乙基基团(N,N-diethylaminoethyl groups)取代,该带电基团遍布于整个微载体基架中。
Cytodex 3含有一层较薄的变性胶原,与交联葡聚糖基架化学偶联。Cytodex3上的变性胶原层易被胰蛋白酶和胶原酶等多种蛋白酶消化,因此,能在维持细胞最大活性、功能和完整性的同时将细胞从微载体上分离出来。Cytodex技术为进行动物细胞的培养提供了新的选择,该微载体为动物细胞的生长提供了适宜的表面,并可用于悬浮培养系统,还可用于增加单层细胞培养容器(例如培养板、培养皿及培养瓶)及灌注室(perfusion chambers)中的细胞产量。其应用范围为大量生产各类细胞、病毒及重组细胞产物(例如干扰素、酶、核酸、激素);研究细胞贴壁、分化及细胞功能;灌注柱式培养系统(perfusion column culture systems);显微镜检查研究;获取有丝分裂细胞;分离细胞;膜研究;细胞的保存和运输,细胞迁移的检测及标记化合物的摄取研究[30]。
2.3 环境响应型葡聚糖
很久以来人们一直在试图通过控制凝胶体积对环境刺激的响应性来提高多糖凝胶的生物性能,因为温度敏感的葡聚糖凝胶能够对环境温度的变化产生响应,因而可以用来提高药物释放的效率,特别是对生物体内葡聚糖酶含量的地方进行靶向释放时的效率。
天津工业大学的肖飞等在N-异丙基丙烯酰胺凝胶中引入葡聚糖,期望在保留PNIPA的温度敏感性的基础上改善凝胶的生物相容性和力学性能,使其具有更加广泛的应用。聚N-异丙基丙烯酰胺凝胶在>32℃时呈收缩构象,分子表面呈疏水性,在温度<32℃时呈伸展构象,分子表面呈亲水性。据此,通过调节温度可以改变固体表面的亲水性。他成功合成了N-异丙基丙烯酰胺(NIPAAm)与葡聚糖的共聚水凝胶,研究了凝胶的溶胀行为,并对其细胞相容性进行研究。通过控制温度的变化,实现凝胶材料对细胞层的自然脱附,避免酶解法对细胞功能的损伤[31]。
此外还有一些通过接枝光敏感性分子、pH敏感分子等来改性葡聚糖,以获得环境敏感型基质。
3 未来的发展
三维细胞培养基质从根本上代表了生物医学工程的发展,已经取得了相当大的成功,但是也提出了新的挑战。三维细胞培养的趋势是由经验之谈上升到系统的认证方法,这就需要发展更加先进的三维细胞培养基质结合生物医学工程技术。同时,必须努力地制定三维细胞基质的标准,尽管三维培养的独特优势已经有所体现,但是仍然没有像二维培养那样在研究领域被广泛接受,因为三维细胞培养基质的结构和组成的偏差,每次使用的基质可能在成分上有微小的区别,很难重复得到完全一样的ECM,这就很难重现实验数据,难以进行系统的数据分析[32-35]。另外一个抑制其广泛应用的实际原因是制备成本巨大,很难大范围推广使用。为了弥补这些,必须建立一定的标准,来促使研究人员充分利用三维细胞培养的优势。建立体外三维标准化细胞培养,对筛选新药物,研究癌细胞的发病机理具有相当大的帮助,而且可以尽可能地减少动物和人体临床试验[34-36]。以下是作者对此技术的一点看法和建议:(1)细胞播种方法需要加以改进,必须知道均匀分布在三维基质中的细胞的精确数量,因为细胞的数目影响支架与支架之间的实验结果比较。(2)目前的细胞培养液应该加以重新考虑,因为培养基成分的突然变化会扰乱预先存在的可溶性的信号分子的浓度和分布梯度。(3)目前所有的培养模式都比较温和,没有考虑到外界的机械刺激和电刺激,而体内环境则有一定的机械压力及电荷分布,可以通过一定的外界刺激来探讨细胞的生长状况。(4)目前三维细胞分析方法必须加以改进,包括共聚焦和micro-CT图像分析。这些改良必将影响三维细胞培养的效果,并加速渗透到其他领域的应用。(5)除了上述部分,一套独特的实时监测细胞生活状态的技术是未来发展的方向[37-38]。
4 总 结
以模拟天然细胞的生活环境为目的的三维细胞培养技术,推动了材料和制造技术的发展。在三维细胞培养过程中,材料的形态和制作都在不断研制,对于任何细胞都适用的理想的三维细胞培养标准仍待建立。因此,三维细胞培养的重要性和必要性在组织和细胞生物学领域被广泛报道,使用三维细胞培养基技术获得有意义的数据是多学科集合的结果。解决这些挑战的过程中会带来细胞生物学的革命,从二维平面生物学转向三维立体生物学,换句话说就是三维细胞培养将是生物医学工程发展的关键。另外,葡聚糖以其独特的优势,未来将在三维细胞培养基质的应用中占有一席之地。
[1]沈文静,刘石磊,邱广蓉.zebularine对卵巢癌细胞的生长抑制作用[J].东南大学学报:医学版,2011,30(4):545-549.
[2]王可可,吴宜林.MG132联合顺铂对人宫颈癌HeLa细胞裸鼠移植瘤的影响[J].现代医学,2012,40(2):137-141.
[3]董伟民,曹祥山,凌云,等.氨磷汀在异基因造血干细胞移植预处理中的保护作用[J].现代医学,2011,39(1):71-73.
[4]LODISH H,BERK A,ZIPURSKY L S,et al.Molecular cell biology[M].NewYork:W H Freeman and Company,2002.
[5]ZHANG S.Beyond the Petri dish [J].Nat Biotech,2004,22:151-152.
[6]ABBOTT A.Cell culture:biology's new dimension[J].Nature,2003,424:870-872.
[7]CUKIERMAN E,PANKOV R,STEVENS D R,et al.Taking cell-matrix adhesions to the third dimension[J].Science,2001,294:1708-1710.
[8]BISSELL M J,RIZKI A,MIAN I S.Tissue architecture:the ultimate regulator of breast epithelial function[J].CurrOpin Cell Biol,2003,(15):753-755.
[9]EVEN-RAM S,YAMADA K M.Cell migration in 3Dmatrix[J].CurrOpin Cell Biol,2005,(7):524-525.
[10]MUSCHLER GF,NAKAMOTOC,GRIFFITH L G.Engineering principles of clinical cell-based tissue engineering[J].Bone Joint Surg Am,2004,86:1541-1542.
[11]GARTNER L P,HIATT JL.Color textbook of histology[M].Philadelphia:Saunders,2001.
[12]HOLLISTER S J,LEVY R A,CHU T M,et al.An imagebased approach for designing and manufacturing craniofacial scaffolds[J].Int J Oral Max Surg,2000,29:67-68.
[13]TALA A,BAUER S B,SOKER S,et al.Tissue-engineered autologous bladders for patients needing cystoplasty[J].Lancet,2006,367:1241-1243.
[14]PALSSON B,HUBBELL JA,PLONSEY R,et al.Tissue engineering[M].Boca Raton,FL:CRC Press,2003:101-110.
[15]GOMEZ N,LU Y,CHEN S,et al.Immobilized nerve growth factor and microtopography have distinct effects on polarization versus axon elongation inhippocampal cells in culture[J].Biomaterials,2007,28:271-275.
[16]ZHU X,MILLS K L,PETERS P R,et al.Fabrication of reconfigurable protein matrices bycracking[J].Nat Mater,2005,4:403-405.
[17]BIOSCIENCE B D.Lactate dehydrogenase elevating virus[M/OL].[2002-08-17].http://www.bdbiosciences.com.
[18]ZHANG S.Hydrogels:wet or let die[J].Nat Mater,2004,3:7-9.
[19]DRURY J L,MOONEY D J.Hydrogels for tissue engineering:scaffold design variables and applications[J].Biomaterials,2003,24:4337-4340.
[20]RABIN O,MANUEL PEREZ J,GRIMM J,et al.An X-ray computed tomography imagingagent based on long-circulating bismuth sulphide nanoparticles[J].Nat Mater,2006,5:118-122.
[21]SUMING L.Hydrolytic degradation characteristics of aliphaticpolyesters derived from lactic and glycolic acids[J].Biomed Mater Res,1999,48:342-346.
[22]ADACHI T,OSAKOY,TANAKA M,et al.Framework for optimal design of porous scaffold microstructureby computational simulation of bone regeneration [J].Biomaterials,2006,27:3964-3969.
[23]CADEE J A,van LUYN M J,BROUWER L A,et al.In vivo biocompatibility of dextran-based hydrogels[J].Biomed Mater Res,2000,50(3):397-404.
[24]CHEN F M,ZHAO Y M,SUN H H,et al.Novel glycidylmethacrylated dextran(Dex-GMA)/gelatin hydrogel scaffolds containing microspheres loaded with bone morphogenetic proteins:formulation and characteristics[J].Controlled Release,2007,118(1):65-77.
[25]De SMEDT SC,LAUWERSA,DEMEESTER J.Characterization of the network structure of dextran glycidyl methacrylate hydrogels by studying the rheological and swelling behavior[J].Macromolecules,1995,28(14):5082-5088.
[26]ITO T,YEO Y,HIGHLEY C B,et al.Dextran-based in situ cross-linkedinjectable hydrogels to prevent peritoneal adhesions[J].Biomaterials,2007,28(23):3418-3426.
[27]LIU Y X,CHANPARK M B.A biomimetic hydrogel based on methacrylated dextran-graft-lysine and gelatin for 3D smooth muscle cell culture[J].Biomaterials,2010,31:1158-1170.
[28]CAI Q,YANG J,BEI J Z,et al.Center for Molecular Sciences,Institute of Chemistry.Chinese Academy of Sciences,Beijing 100080,2002 ,23:4483-4492.
[29]STEPHANE G.Levesque,synthesis of cell-adhesive dextran hydrogels and macroporous scaffolds[J].Biomaterials,2006,27:5277-5285.
[30]MAGNUSSON A C,LUNDSTROM T.Propagation of influenza virus in vero cells using CytodexTMmicrocarriers in WAVE systems.2011,ACSspring meeting.
[31]肖飞,董晶.温度敏感葡聚糖凝胶的合成及其细胞相容性研究[J].功能材料,2007,28:1835-1837.
[32]KAPLAN D L,MOON R T,VUNJAK-NOVAKOVIC G.Ittakes a village to grow a tissue[J].Nat Biotech,2005,23:1237-1240.
[33]LIAOE,YASZEMSKI M,KREBSBACH P,et al.Tissue-engineered cartilage constructs using composite hyaluronicacid/collagen I hydrogels and designed poly(propylenefumarate)scaffolds[J].Tissue Eng,2007,13:537-541.
[34]XU J,MA M,PURCELL W M.Characterisation of somecytotoxic endpoints using rat liver and HepG2 spheroids asin vitro models and their application in hepatotoxicitystudiesⅡSpheroid cell spreading inhibition as a new cytotoxicmarker[J].ToxicolAppl Pharm,2003,189:112-116.
[35]MACNEIL S.Progress and opportunities for tissue-engineeredskin[J].Nature,2007,445:874-875.
[36]The Interagency Coordinating Committee on the Validationof Alternative Methods,2004(on-line).Available at http://iccvam.niehs.nih.gov.Accessed on 02/17/08.
[37]MOUTOSF T,FREED L E,GUILAK F.A biomimetic threedimensional woven composite scaffold for functionaltissue engineering of cartilage[J].Nat Mater,2007,6:162-165.
[38]WILSON A,TRUMPP A.Bone-marrow haematopoieticstemcell niches[J].Nat Rev Immunol,2006,6:93-95.
