肠道病毒71型特异性单克隆抗体的制备及其在病毒鉴定中的应用
2013-12-25吴菲菲董敏葛路遥胡馨云张程张建华江炳福孟继鸿
吴菲菲,董敏,葛路遥,胡馨云,张程,张建华,江炳福,孟继鸿
(东南大学医学院,江苏南京 210009)
肠道病毒71型(enterovirus 71,EV71)是引起婴幼儿手足口病(hand foot and mouth disease,HFMD)的主要病原体之一,主要感染5岁以下婴幼儿,其典型临床症状为发热和手、足、口腔等部位皮疹或疱疹,少数可出现无菌性脑膜炎、脑炎和心肌炎等严重并发症,个别重症患儿病情恶化甚至死亡[1-3]。根据2009~2012年卫生部公布的传染病疫情报告显示,我国HFMD的发病人数一直高居报告传染病的首位,疫情逐年上升。近年来,HFMD流行在东南亚地区也有上升趋势,且EV71和柯萨奇病毒A16(CA16)交替出现[4-7]。嵇红等人报道了2008年至2010年江苏省HFMD流行病学研究结果,认为轻症病例以EV71和CA16共同主导流行,而重症病例和死亡病例则以EV71感染为主[8]。EV71感染引起的HFMD在临床症状和体征方面与CA16等其它肠道病毒所致的手足口病较难区别,因此需要特异的病原学诊断帮助鉴别。此外,EV71 HFMD的预防和控制需要依靠疫苗,因此从临床标本中分离、培养和鉴定EV71病毒株用于疫苗株的筛选十分重要。本课题拟制备EV71的特异性单克隆抗体,在此基础上尝试建立EV71特异性检测的免疫荧光技术,用于病毒分离培养后的EV71鉴定,为EV71 HFMD的诊断和疫苗株的筛选奠定基础。
1 材料与方法
1.1 病毒毒株
本实验室以往分离鉴定的肠道病毒毒株EV71-NJ05-2010(基因序列号 JQ409487)、CA16-MAS04-2010(基因序列号JQ409496)和Echo6-NJ01-2010(基因序列号JQ409486)[9]于-80℃保存备用。
1.2 单抗的制备
采用常规方法,以EV71 VP1为免疫原免疫6~8周龄雌性Balb/c小鼠,末次免疫后3 d无菌操作取其免疫脾细胞,在PEG4000作用下与骨髓瘤细胞SP2/0以10∶1的比例融合,加入已铺有饲养细胞的96孔板,用含20%胎牛血清的HAT培养液,置37℃、5%CO2培养箱中选择培养,用间接ELISA方法筛选。
1.3 单抗的ELISA鉴定
分别用4种代表性肠道病毒VP1蛋白(EV71 HIS-VP1、EV71 GST-VP1、CA16 HIS-VP1 和 Echo6 HIS-VP1)包被酶标板,4℃过夜,PBST洗2遍后加入杂交瘤细胞的培养上清,经37℃孵育40 min、PBST洗5遍后加入1∶10 000 HRP标记的羊抗鼠IgG抗体,再经37℃孵育40 min、PBST洗5遍后加入底物TMB显色,采用酶标仪测定A450值。
1.4 标本采集与病毒分离
HFMD患儿的咽拭子标本104份,由南京市儿童医院、马鞍山市疾病预防与控制中心和长春市儿童医院提供。按照《手足口病预防控制指南(2009版)》中样品采集及检测技术方案的要求进行预处理,接种非洲绿猴肾细胞(Vero),置于36℃、5%CO2培养箱连续培养7 d,盲传3代,若出现人肠道病毒特征性的细胞病变效应(CPE),则将培养物反复冻融3次,于-80℃保存备用。
1.5 分离病毒的免疫荧光鉴定
将已接种病毒的长成单层的Vero细胞倾去维持液,PBS洗3次后用-20℃预冷的甲醇置于-20℃固定5 min,PBS洗3次后每孔加5%FBSPBS100μl,封闭2 h,吸干,每孔滴加单抗50μl,37℃湿盒中作用1 h,PBS洗3次后每孔加入一定稀释度的FITC标记羊抗小鼠IgG,37℃湿盒中避光作用1 h,PBS洗3次后吸干,镜检,拍照。
1.6 病毒RNA提取及RT-PCR鉴定
参照文献[10]进行,具体方法如下:取病毒分离上清100 μl,用 QIAamp Viral RNA Mini Kit(QIAGEN)提取病毒 RNA,操作步骤按照说明书进行。采用OneStep RT-PCR Kit(QIAGEN)进行扩增,肠道病毒通用引物(Fa、Rb)和 EV71特异性引物(F1、R1),见表1。一步法RT-PCR的反应体系为20μl,包括:RNA 5 μl,5 × RT-PCR Buffer 4 μl,dNTP Mix(10 mmol·L-1)0.8 μl,Enzyme Mix 0.8 μl,上下游引物(10 pmol·μl-1)各 0.5 μl,水(RNase-free)8.4 μl。一步法 RTPCR的扩增条件为:42℃逆转录45 min;95℃预变性15 min;95℃变性30 s,56℃退火30 s,72℃延伸90 s,50个循环;72℃末次延伸10 min。PCR产物用1.5%的琼脂糖凝胶进行电泳分析。

表1 RT-PCR扩增用引物及其序列Tab 1 Primers for PT-PCR amplification and their sequence
2 结 果
2.1 单克隆抗体的制备与鉴定
共获得2株稳定分泌McAbs的杂交瘤细胞株,命名为3E12和5C1。用ELISA检测,这2株单抗均可与EV71 HIS-VP1和EV71 GST-VP1蛋白反应,都不与Echo6 HIS-VP1蛋白反应;3E12不与CA16 HIS-VP1蛋白反应,而5C1则与CA16 HIS-VP1蛋白反应(表2)。结果表明3E12为 EV71特异性单抗,5C1为EV71和CA16的共同性单抗。
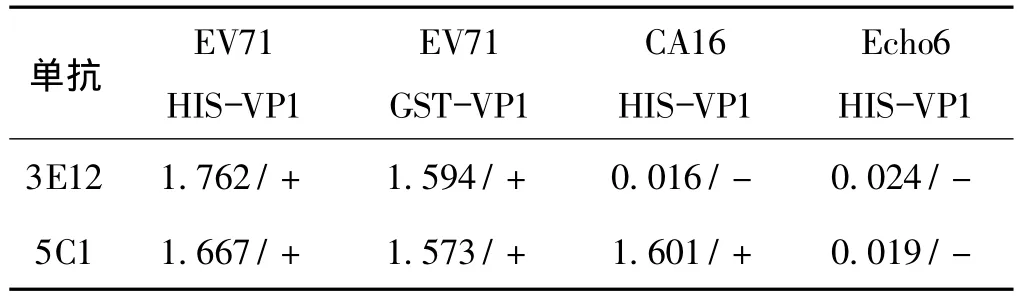
表2 抗EV71 HIS-VP1单抗与4种不同蛋白的免疫反应结果Tab 2 Immune reaction results of 3E12 and 5C1 with four kinds proteins
2.2 EV71特异性单抗免疫荧光检测方法的建立
将制备获得的单抗3E12和5C1与用3种肠道病毒代表株EV71-NJ05-2010、CA16-MAS04-2010和Echo6-NJ01-2010感染的Vero细胞进行免疫荧光检测(图1),结果3E12只与EV71感染的细胞反应,与CA16和Echo6感染的细胞不反应;而5C1与EV71、CA16感染的细胞反应,与Echo6感染的细胞不反应。由此可见,EV71特异性单抗3E12免疫荧光检测肠道病毒具有较好的EV71特异性,可以进一步用于EV71的鉴定。
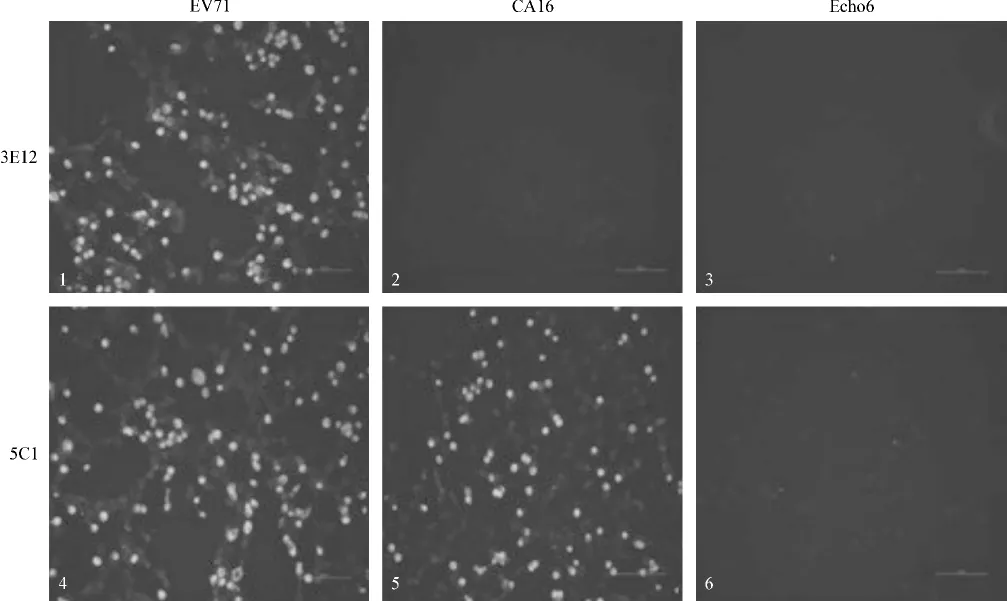
图1 EV71 HIS-VP1单抗与EV71、CA16和Echo6感染细胞的免疫荧光反应性Fig 1 Immune reaction results of EV71 HIS-VP1 with cells carrying EV71,CA16 and Echo6
2.3 HFMD临床标本的病毒分离培养
将104份来自不同地区的临床HFMD患者标本接种Vero细胞,其中有35份分离到病毒,产生肠道病毒典型的CPE,如图2。

图2 HFMD标本接种Vero细胞产生的细胞病变Fig 2 Cytopathic effect of Vero cells inoculated by HFMD samples
2.4 分离病毒的免疫荧光鉴定
用EV71特异性单抗3E12免疫荧光检测从临床标本分离的35份毒株,其中29份免疫荧光检测为阳性(EV71),6份免疫荧光检测为阴性(非 EV71),EV71阳性率为82.9%。图3显示了部分分离株的免疫荧光阳性与阴性的检测结果。其中标本1、2、3、4和6免疫荧光检测鉴定为EV71,标本5免疫荧光检测鉴定为非EV71。
2.5 分离病毒的RT-PCR验证
将从临床标本中分离到的35份毒株抽提病毒RNA,采用EV和EV71单管二重一步法RT-PCR进行病毒验证(图4)。35株病毒分离物均能扩增出大小为306 bp的产物,属于肠道病毒。其中29份均可扩增出大小为889 bp的EV71特异性引物扩增条带,鉴定为EV71;6份无EV71特异性引物扩增条带,为非EV71肠道病毒。RT-PCR检测结果与免疫荧光结果完全一致。
3 讨 论
HFMD是常见的出疹性疾病,主要感染儿童。近年来,HFMD在东南亚地区疫情严重,反复暴发流行。我国自2008年在安徽阜阳市暴发HFMD以来,该病在我国一直呈高流行态势。HFMD可由多种肠道病毒引起,EV71是最主要的病原体。自1969年EV71首次分离确认以来[11],EV71已在全球范围内引起多次暴发和流行。刘凤仁等报道了近4年深圳市HFMD流行病学研究结果,认为EV71是引起HFMD的主要病原体。同时也有报道显示,HFMD重症病例主要由EV71感染引起。汪照国等[12]报道2008~2009年青岛市HFMD流行病学和病原学研究结果,EV71感染引起的HFMD轻症和重症的比率均高于CA16。缪梓萍等[13]报道2010~2011年浙江省HFMD病原学特征分析,研究发现重症病例和死亡病例中EV71核酸阳性的比例分别为85.53%和96.08%。EV71感染引起的HFMD易引发并发症,从临床标本中分离、培养、鉴定EV71以进一步研究其生物学特性,对EV71 HFMD的诊断和预防控制具有重要意义。
本研究中我们以EV71 VP1为免疫原制备单抗,共获得2株稳定分泌的单抗3E12和5C1。2株单抗经ELISA和免疫荧光鉴定,3E12为EV71特异性单抗,5C1为EV71和CA16共同性单抗。以特异性单抗3E12建立的特异性检测EV71的免疫荧光方法鉴定从不同地区HFMD患者标本中分离的35份病毒株,29份鉴定为EV71,阳性率为82.9%,6份为非EV71的其他肠道病毒。鉴定结果与RT-PCR验证结果完全一致,表明以特异性单抗3E12建立的免疫荧光方法敏感性高、特异性强。
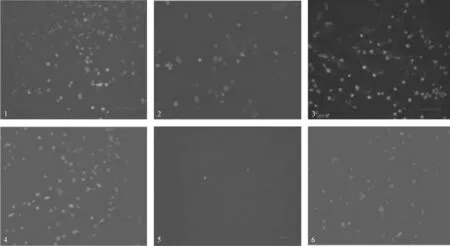
图3 单抗3E12免疫荧光鉴定从临床标本分离的EV71毒株Fig 3 EV71 viruses which were tested by immunofluorescence from clinic samples
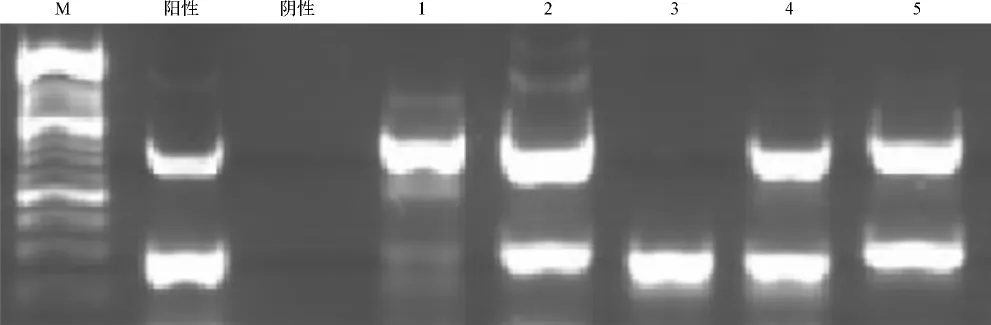
图4 EV和EV71单管二重一步法RT-PCR鉴定临床标本分离毒株Fig 4 Separated clinic viruses(EV and EV71)identified by RT-PCR
本研究中我们先将标本接种细胞进行病毒分离培养,再利用免疫荧光鉴定分离培养出的病毒。病毒分离培养虽然耗时,对于临床标本的诊断应用有一定的局限性,但最终可以获得特定的病毒,对于疾病的诊断来说有最直接的证据,对于确定诊断意义重大,该方法更有利于进一步开展病原学的研究,特别是对疫苗研制提供了众多的候选株。目前RT-PCR常用于对病毒标本的检测和鉴定,虽然高度敏感和特异,PCR产物还可以用于基因测序,进一步开展序列分析,但RTPCR技术要求高、操作复杂,且容易污染。实时荧光RT-PCR采用单管闭合及特异性标记的探针来实时监控扩增产物,扩增后不打开管盖直接通过管内荧光强度进行定量,在检测时间和检测灵敏度上均有了明显的提高,但由于仪器的购置费用较高,较难在基层单位中推广。总之,无论何种PCR技术最终均不能获得活的病毒,无法替代传统的病毒分离培养。本研究通过制备EV71特异性单克隆抗体,建立特异性免疫荧光方法对从HFMD临床标本中分离培养的病毒进行EV71鉴定,获得了大量的EV71病毒株,为下一步开展EV71灭活疫苗和减毒活疫苗的研究奠定了基础。
[1]CHANG L Y,LIN T Y,HUANG Y C,et al.Comparison of enterovirus 71 and coxsackie-virus A16 clinical illnesses during the Taiwan enterovirus epidemic[J].JPediatr Infect Dis,1999,18(12):1092-1096.
[2]HO M,CHEN E R,HSU K H,et al.An epidemic of enterovirus 71 infection in Taiwan[J].J N Engl J Med,1999,341(13):929-935.
[3]DENG J,ZHU R N,QIAN Y,et al.Pathogen analysis of children's hand foot and mouth disease in Beijing during 2007-2008[J].Chinese Journal of Laboratory Medicine,2009,32(10):1124-1127.
[4]ABUBAKAR S,CHEE H Y,Al-KOBAISI M F,et al.Identification of enterovirus 71 isolates from an outbreak of hand,foot and mouth disease(HFMD)with fatal cases of encephalomyelitis in Malaysia[J].Virus Res,1999,61:1-9.
[5]AHMAD K.Hand,foot,and mouth disease outbreak reported in Singapore[J].Lancet,2000,356:1338-1338.
[6]CHAN L G,PARASHAR U D,LYE M S,et al.Deaths of children during an outbreak of hand,foot,and mouth disease in sarawak,malaysia:clinical and pathological characteristics of the disease.For the Outbreak Study Group[J].Clin Infect Dis,2000,31:678-683.
[7]LIU C C,TSENG H W,WANG SM,et al.An outbreak of enterovirus 71 infection in Taiwan,1998:epidemiologic and clinical manifestations[J].J Clin Virol,2000,17:23-30.
[8]嵇红,李亮,吴斌,等.江苏省2008至2010年手足口病流行病学及病原学特征分析[J].中华儿科杂志,2012,50(4):261-266.
[9]张建华,江炳福,程险峰,等.肠道病毒71型和柯萨奇病毒A16型VP1基因特征分析[J].东南大学学报:医学版,2013,32(2):173-179.
[10]JIANGBF,ZHANGJH,YOU X H,et al.Diagnosis of hand,foot,and mouth disease caused by EV71 and other enteroviruses by a one-step,single tube,duplex RT-PCR[J].J Med Virol,2012,84(11):1803-1808.
[11]SCHMIDT N J,LENNETTE E H,HOH H.An apparently new enterovirus isolated from patients with disease of the central nervous system[J].JInfect Dis,1974,129(3):304-309.
[12]汪照国,刘晓琳,杨婷婷,等.2008-2009年青岛地区手足口病病原学的调查分析[J].病毒学报,2011,27(5):438-441.
[13]缪梓萍,吕华坤,秦淑文,等.2010-2011年浙江省手足口病流行特征分析[J].传染病监测,2012,27(7):530-534.
