生姜提取物对阿尔茨海默病大鼠动物模型的氧化应激因子的影响
2013-12-23曾高峰张志勇肖德强宗少晖何建明
曾高峰 ,张志勇,鲁 力,肖德强,宗少晖,何建明
1广西医科大学公共卫生学院;2 广西医科大学第一附属医院脊柱骨病外科;3 广西医科大学研究生学院,南宁530021
据统计,我国约有1.6 亿老年人,人口老龄化是目前较严峻的社会公共问题。同时也使得医疗行业面对诸多老年疾病,其中,怎样攻克老年痴呆是急需解决的问题之一。本研究通过观察生姜提取物对AD 大鼠氧化应激指标SOD、CAT 及MDA 水平的影响,探讨其对AD 的治疗作用及可能的机制。
1 材料与方法
1.1 实验动物
清洁级健康SD 大鼠(雌雄各半)60 只,体重210~280 g,平均240 ± 16.7 g。购于广西医科大学动物实验中心,本实验研究符合广西医科大学动物保护委员会标准要求,实验中尽可能减少动物使用数量和减轻动物痛苦。动物予适应性喂养1 周。
1.2 试剂
生姜提取物:含量为5%姜辣素[6-姜辣醇(6-Gingerol)、6-生姜酚(6-Shogaol)、8-姜辣醇(8-Gingerol)、10-姜辣醇(10-Gingerol)],其中6-姜辣醇(6-Gingerol)为主要成分。由上海灵菱食用菌科技有限公司提供。
β 淀粉样蛋白:Aβ25-35(批号:050M4764)250 μg(美国Sigma 公司)加入无菌生理盐水,制成1 g/L 的溶液,保持在37 ℃恒温箱孵育3 d,使其老化并成为聚集态的Aβ25-35。
超氧化物歧化酶(SOD)一抗、过氧化氢酶(CAT)一抗、大鼠丙二醛(MDA)elisa 检测试剂盒:均由北京博奥森生物技术有限公式提供。
1.3 主要仪器
SR-5R 型脑立体定位仪(日本成茂公司);微量注射器(上海医用激光仪器厂);MK3 型酶标仪(美国Thermo 公司);光学显微镜(XSP-12C,上海永亨光学制造有限公司);病理图像分析仪(DMR +Q550,德国LEICA 公司)。
1.4 实验方法
将大鼠用10%水合氯醛(0.5 μL/g)麻醉,固定于脑立体定位仪上,对耳线跟上颌骨三角固定,保持头盖骨水平。剪去头顶部毛发,碘酊消毒并75%酒精脱碘后切开皮肤,参考Paxinos&Watson 的方法选取大鼠侧脑室[1],于前囟向后0. 8 mm,中线旁开1.4 mm 处,三棱针钻开颅骨,暴露硬脑膜,再用微量注射器缓慢自脑表面垂直进针3.6 mm,将Aβ25-35缓慢注入5 μL(约10 min),假手术组侧脑室注射等量无菌生理盐水,留针10 min 后缓慢撤针,撒些许青霉素粉后,缝合切口,并用碘伏消毒切口。单笼单只饲养待全部大鼠完全清醒并恢复活动。
术后应用抗菌素,连续三天肌注青霉素10 万单位/次,2 次/日和庆大霉素1000 单位/次,2 次/日(广西医科大学第一附属医院药剂科提供)。
1.5 氯化铝灌胃
待全部大鼠完全清醒并恢复活动并术后愈合后,每日予3%氯化铝100 mg/kg 灌胃。持续30 d。
1.6 用药阶段
生姜低剂量、中剂量、高剂量组分别予剂量为1、2、4 g/kg 生姜醇提取物,每只大鼠每日剂量以生理盐水兑至5 mL,分两次灌胃;石杉碱甲组予石杉碱甲片200 μg/kg,磨碎后兑生理盐水至每只大鼠5 mL,分两次灌胃;空白对照组每只大鼠予生理盐水5 mL,分两次灌胃;假手术组不予处理。灌胃用药持续28 d。
1.7 组织取材及免疫组织化学染色及检测IOD
将大鼠用10%水合氯醛(3 mL/kg)麻醉,取血后快速开胸,将针尖磨平的20 mL 注射器针经左心室心尖穿刺达到主动脉插管,并血管钳夹固定针,以500 mL 冷生理盐水快速冲洗直至流出澄清液,以4%多聚甲醛400 mL 灌注固定,维持约60 min。待双上肢硬化后除去颅盖骨,取出完整的大脑组织,用上述固定液固定24 h 后,取大脑后1/3 海马区丰富为标本,常规脱水,石蜡包埋,作连续冠状切片,片厚4~5 μm。常规脱蜡。
采用SP 法免疫组织化学法检测大鼠大脑中SOD 及CAT 的表达水平。SOD 一抗工作浓度为1∶400,CAT 一抗工作浓度1∶400。光学显微镜下观察染色结果,阳性细胞呈棕褐色或棕黄色。每张切片于400 倍镜下取10 个不同视野,采用病理图像分析仪及Leica QWIN 图像分析软件相结合分析同期制作的免疫组化切片,并根据图像的染色情况定下一个统一的标准,据此测定出大鼠大脑中SOD 及CAT 的积分光密度(IOD)值,IOD 值与SOD 及CAT的活性呈正相关,即IOD 值越大,相应的SOD 及CAT 的活性越高,IOD 值越小,相应的指标活性也越低。
1.8 丙二醛(MDA)检测
大鼠常规心脏取血1.0~2.0 mL,加入到抗凝EB 管中室温静置4 h 后以5000 rpm 离心20 min 后取血清,置于-80 ℃冰箱中保存待用。MDA 采用elisa 分析方法,按照说明书步骤操作,数据在取450 nm 酶标仪上于15 min 内读取,后通过标准品制成的浓度曲线公式计算出MDA 浓度。
1.9 统计学处理
采用SPSS17.0 统计软件包进行统计分析,各组数据均采用x ± s 表示,采用方差分析(one-way ANOVA 法),以P <0.05 为差异有统计学意义。
2 实验结果
2.1 大鼠大脑海马区SOD 及CAT 的表达
400 倍镜下,生姜高剂量组、石杉碱甲组、较生姜中剂量和低剂量、空白对照组阳性细胞、神经元细胞数目及层数多,神经元细胞排列较整齐,神经元细胞较大,胞质多;细胞核固缩,胶质细胞及神经元纤维缠结少。生姜高剂量组与石杉碱甲组无明显差别;生姜中剂量、低剂量及空白对照组间无明显差别。SOD、CAT 积分光密度统计学分析:OP + HG组、OP + HupA 组较OP + LG 组和OP + MG 组、OP 组大脑组织中SOD、CAT 积分光密度明显增高(P <0.05),生姜高剂量组与石杉碱甲组无明显差别(P >0.05),生姜中剂量组、低剂量组及空白对照组间无明显差别(P >0.05)。见表2。
2.2 大鼠大脑海马区MDA 的表达
丙二醛(MDA)elisa 分析表明,生姜高剂量组、石杉碱甲组较生姜中剂量和低剂量、空白对照组血清中MDA 水平明显升高(P <0.05)。见表1。生姜高剂量组与石杉碱甲组无明显差别(P >0.05),生姜中剂量组、低剂量组及空白对照组间无明显差别(P >0.05)。
表1 MDA 血清浓度(Elisa 分析法)(±s)Table 1 Serum concentrations of MDA (Elisa analysis)(±s)

表1 MDA 血清浓度(Elisa 分析法)(±s)Table 1 Serum concentrations of MDA (Elisa analysis)(±s)
注:a.与OP + LG 组比较,P <0.05;b.与OP + MG 组比较,P <0.05;c.与OP + HG 组比较,P <0.05;d.与SHAM 组比较,P <0.05;e.与OP + HupA 组比较,P <0.05;f.与OP 组比较,P <0.05。Note:a.Compare with OP + LG,P <0.05;b.Compare with OP + MG,P <0.05;c.Compare with OP + HG,P <0.05;d.Compare with SHAM,P<0.05;e.Compare with OP + HupA,P <0.05;f.Compare with OP,P <0.05.
组别GroupnMDA(nmol/mL)生姜提取物低剂量组OP + LG104.27 ±2.19cde生姜提取物中剂量组OP + MG104.91 ±2.45cde生姜提取物高剂量组OP + HG103.34 ±1.20abf假手术组SHAM82.25 ±1.12abf石杉碱甲组OP + HupA102.65 ±1.09abf空白对照组OP75.80 ±2.52cde
表2 大鼠大脑中SOD 及CAT 积分光密度(IOD)结果(±s)Table 2 Integral optical density (IOD)of SOD and CAT in rat brain (±s)
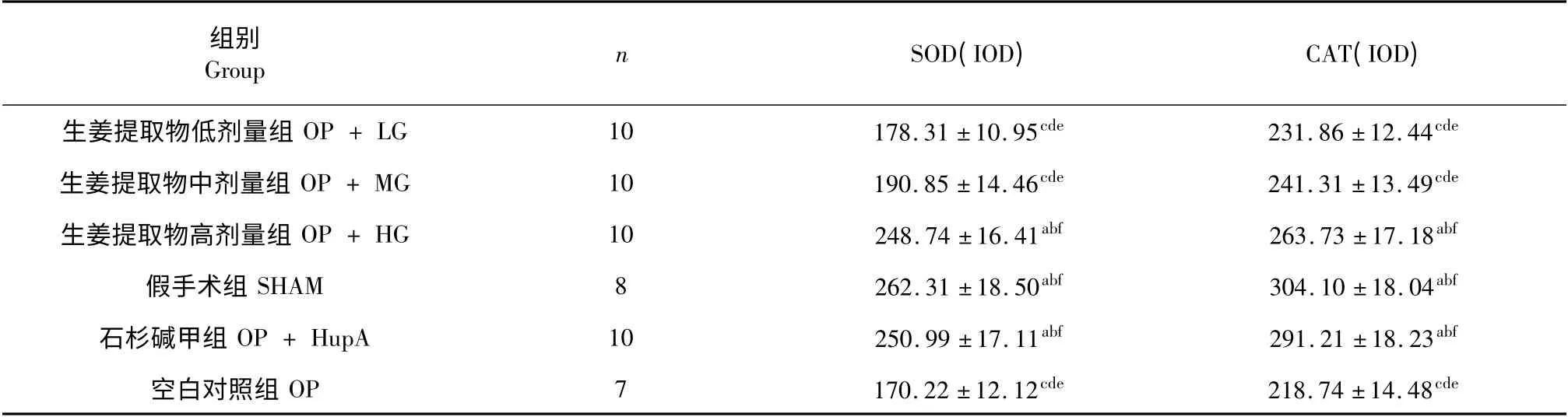
表2 大鼠大脑中SOD 及CAT 积分光密度(IOD)结果(±s)Table 2 Integral optical density (IOD)of SOD and CAT in rat brain (±s)
注:a 与OP + LG 组比较,P <0.05;b 与OP + MG 组比较,P <0.05;c 与OP + HG 组比较,P <0.05;d 与SHAM 组比较,P <0.05;e 与OP + HupA 组比较,P <0.05;f 与OP 组比较,P <0.05Note:a.Compare with OP + LG,P <0.05;b.Compare with OP + MG,P <0.05;c.Compare with OP + HG, P <0.05;d.Compare with SHAM,P <0.05;e.Compare with OP + HupA,P <0.05;f.Compare with OP, P <0.05
组别GroupnSOD(IOD)CAT(IOD)生姜提取物低剂量组OP + LG10178.31 ±10.95cde231.86 ±12.44cde生姜提取物中剂量组OP + MG10190.85 ±14.46cde241.31 ±13.49cde生姜提取物高剂量组OP + HG10248.74 ±16.41abf263.73 ±17.18abf假手术组SHAM8262.31 ±18.50abf304.10 ±18.04abf石杉碱甲组OP + HupA10250.99 ±17.11abf291.21 ±18.23abf空白对照组OP7170.22 ±12.12cde218.74 ±14.48cde
3 讨论
AD 即老年痴呆症,是种进行性发展的致死性的神经退行性的疾病。目前临床上对AD 缺乏有效的治疗手段,这是由于AD 不清晰的病因及复杂的发病机制所致[2]。有研究表明,大脑组织的氧化应激反应参与了AD 的发生和发展[3]。因此,对AD治疗的研究是摆在医疗工作者面前的一个难题。生姜属于多年生宿根草本植物。其块茎中含有多种成分,其中有姜辣素、姜精油、姜酚及黄酮等,还含有多种微量元素[4]。生姜味辛性温,具有温中止呕、解表散寒及抗氧化抗癌等功效[5]。除此之外,生姜还具有很多功能有待我们发现。本研究采用侧脑室注射Aβ25-35 及氯化铝溶液灌胃,观察其对β-淀粉样蛋白致AD 大鼠脑组织氧化应激的影响,并进一步探讨生姜提取物对AD 的疗效及其可能的作用机制,为生姜提取物临床治疗AD 提供一定的实验依据。
德国医生Alois Alzheime(1864~1915)于90年前首先对AD 进行描述,90 年里人们对AD 的研究取得了很大的进展,但发病机制至今未明,主要是原因是确切的病因和病理生理过程十分复杂,其主要的病理表现是脑内神经纤维缠结(主要成分是过磷酸化tau 蛋白)和老年斑(主要成分是β 淀粉样多肽,即Aβ)[6]。Aβ 具有神经毒性作用,能直接引起神经元的死亡和诱导的神经细胞凋亡都已被证实[7],Aβ 是AD 形成并发展的主要因素。因此本研究以Aβ 和氯化铝双干预建立AD 大鼠模型[8]。关于AD 的发病机制,目前比较认可的假说为氧化应激假说、能量代谢假说、amyloid 级联反应假说以及胆碱能假说等[9]。氧化应激的定义是指氧化物超过了机体内源性的抗氧化能力从而引起机体组织的分子氧化,并造成组织损伤。氧化应激假说能一定程度上解释AD 病理改变和认知及记忆功能的改变[10]。说明氧化应激是AD 主要病因之一,而氧化应激在一定程度上可以说是贯通于其他几种假说。
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)能有效地清除体内氧自由基,SOD 及CAT 的活性高低决定了机体清除氧自由基能力的大小。丙二醛(MDA)为多不饱和脂肪酸过氧化物的降解产物,是脂质氧化的终产物,机体内MDA 水平能反应出机体氧化应激的程度。
本研究显示,生姜提取物干预的OP + HG 组、OP + MG 组、OP + LG 组AD 大鼠大脑SOD、CAT的阳性表达活性较OP 组都有不同程度的升高,MDA 水平下降,但仅OP + HG 组差异性显著(P <0.05),OP + MG 组、OP + LG 组差异不显著(P >0.05)。
SHAM 组及OP + HupA 组较OP 组SOD、CAT阳性表达明显升高(P >0.05),MDA 水平明显降低(P >0.05)。在一定程度上说明侧脑室穿刺术对本实验影响较小,也说明了Aβ25-35 干预能较好地建立AD 大鼠模型。
综上所述,生姜提取物在高剂量时能够提高AD 大鼠大脑中SOD、CAT 阳性表达,并能降低MDA水平,即生姜提取物能在一定程度上改善阿尔茨海默病(AD)氧化应激反应。但生姜提取物是通过清除氧自由基还是提高相关酶的活性,抑或是两者都兼备,目前还不明了,其具体的机制仍需进一步研究。
1 Paxinos G,Watson C. The rat brain in stereotaxic coordinates. 4thed. New York:Elsevier Science & Technology Press,2004.
2 Buckingham SD,Jones AK,Brown LA,et al. Nicotinic aacetycholine receptor signalling:roles in Alzheimer’s disease and amyloid neuroprotection. Pharmacol Rev,2009,61(1):39-61.
3 Gackowski D,Rozalski R,Siomek A,et al. Oxidative stress and oxidative DNA damage is characteristic for mixed Alzheimer disease/vascu1ar dementia.J Neurol Sci,2008,266(1-2):57.
4 Yu YK,Zick S,Li XQ,et al.Examination of the pharmacokinetics of active ingredients of ginger in humans.American Assoc Pharm Sci J,2011,13:417-426.
5 Sun YJ(孙永金). Ginger pharmacological research. Mod J Integr Tradit Chin Western Med(现代中西医结合杂志),2007,16:561-564.
6 Grundke-Iqbal I,Iqbal K,Quinlan M,et al. Mieretubule-associated protein tau.A component of Alzheimer paired helical filaments.J Biol Chem,1986,261:6084-6089.
7 Cottrell DA,Blakely EL,Johnson MA,et al.Mitochondral enzyme-deficient hippocampal neurons and choroidal cells in AD.Neurology,2001,57:260.
8 Liu ZA(刘志安),Zhao WW(赵娓娓),Ma K(马凯),et al.Establishment of a Alzheimer’s disease rat model intervened by beta-amyloid protein 1-40 and aluminum chloride.J Clin Rehab Tissue Eng Res(中国组织工程研究与临床康复),2010,14:6917-6921.
9 Christian B. Alzheimer's disease and oxidative stress:implication for novel therapeutic approaches. Prog Neurobiol,1999,57:301.
10 Christen Y. Oxidative stress and Alzheimer disease. Am J Clin Nutr,2000,7l:62l-629.
