马胎盘提取物对淋巴细胞的免疫调节作用
2013-12-23王晓然高晓黎王春梅徐智勇
王晓然,高晓黎* ,王春梅,罗 俊,徐智勇
1新疆医科大学药学院,乌鲁木齐830011;2 新疆新姿源生物制药有限责任公司,伊犁835801
胎盘是维持胎儿在母体内生长发育的临时器官,《本草纲目》记载其具有“安神养血、补气、益精、解毒、补血”的功效。近年来研究发现,胎盘含有多种蛋白质、多肽、多糖、矿物质元素及维生素等,具有调节免疫功能[1]、抗氧化延缓衰老[2]、预防肿瘤、促进伤口愈合[3]、增强记忆力等保健功效。但是有关马胎盘的研究仍处于起步阶段,关于马胎盘的相关研究作者几乎未见国内文献报道,本实验旨在研究马胎盘提取物的免疫调节作用,为马胎盘的开发应用提供理论依据。
1 材料与方法
1.1 材料和仪器
刀豆蛋白ConA、脂多糖LPS、四甲基偶氮唑盐MTT(美国Sigma 公司);DMEM 培养基、新生胎牛血清(Hyclone 公司);Formanzan 溶解液(武汉博士德生物工程有限公司);人前列腺癌PC-3 细胞(购自上海中科院细胞库);昆明种小鼠(体重18~22 g,购自新疆医科大学动物实验中心);马胎盘(由新疆新姿源生物制药有限公司提供)。
3131 型二氧化碳培养箱(美国Termo Electron Corporation 公司);SB-JS-2 型洁净工作台(上海博迅实业有限公司医疗设备厂);Xmark 型酶标仪(Bio-RAD 公司);CKX41 型倒置显微镜(日本OLYMPUS公司);SC-3610 型低速离心机(科大创新股份有限公司中佳分公司);Allegra 64R 低温高速离心机(美国BECKMAN 公司);DRC-1100REG、FDU-2100 型冷冻干燥机(日本东京理化EYELA 公司);高速组织捣碎机(上海标本模型厂);S433D 型氨基酸分析仪(德国sykam 公司);96 孔细胞培养板、25 cm2细胞培养瓶(丹麦NUNC 公司)。
1.2 马胎盘提取物的制备
取适量新鲜马胎盘洗净,剪碎至1 cm3小块,按料液比1∶3(w/v)加入0.01 M 磷酸盐缓冲液(pH 7.2),组织匀浆(12000 rpm)。30 ℃静置提取1 h,低温高速离心(12000 rpm、15 min、4 ℃)收集上清液,透析,冷冻干燥得棕褐色粉末,4 ℃密封保存,临用前用基础DMEM 培养基溶解经0.22 μm 微孔滤膜过滤除菌。
1.3 淋巴细胞增殖活性实验[4]
脱颈处死小鼠,无菌制备小鼠脾淋巴细胞悬液,调节细胞密度为1.8 ×107/mL,并用台盼蓝染色检测细胞活力>95%。在96 孔平底细胞培养板中,每孔分别加入淋巴细胞悬液150 μL。在EPE 对正常淋巴细胞活性影响的实验中,设空白调零组、阴性对照组、EPE 组;在EPE 对ConA 诱导的T 淋巴细胞增殖活性影响的实验中,设空白调零组、阴性对照组、ConA 对照组、ConA+EPE 组;在EPE 对LPS 诱导的B 淋巴细胞增殖活性影响的实验中,设空白调零组、阴性对照组、LPS 对照组、LPS +EPE 组。每组均设5 个复孔。ConA 终浓度为10 μg/mL;LPS 终浓度为15 μg/mL;EPE 终浓度分别为1500、750、375、187.5、93.75、46.87、23.44 μg/mL。37 ℃、5%CO2饱和湿度细胞培养箱培养68 h 后,每孔加入20 μL MTT 溶液(5 mg/mL)继续培养4 h,板式离心机1200 ×g 离心15 min,吸弃上清120 μL,加入100 μL Formanzan 溶解液,过夜孵育,以空白对照孔调零,酶标仪570 nm 波长处测定各孔A 值。
1.4 NK 细胞杀伤活性实验[5]
小鼠脾淋巴细胞的制备同1.3 项的方法,取对数生长期的人前列腺癌细胞(PC-3)为靶细胞,调整细胞密度为2.5 ×105/mL,在96 孔平底细胞培养板中接种100 μL,培养4 h 后,按效靶比50∶1 加入淋巴细胞(NK 细胞为效应细胞),加入不同浓度EPE(终浓度分别为1500、375、93.75、23.44 μg/mL),同时设立空白调零组、靶细胞对照组、效靶细胞对照组,靶细胞+EPE(终浓度同上)对照组,每组均设5个复孔。37 ℃、5% CO2饱和湿度细胞培养箱培养72 h 后,吸弃培养液,用PBS 洗涤3 次,加入基础DMEM 培养基200 μL,每孔加入20 μL MTT 溶液(5 mg/mL)继续培养4 h,吸弃培养基然后加入150 μL Formanzan 溶解液,过夜孵育,以空白对照孔调零,酶标仪570 nm 波长处测定各孔A 值,并计算NK 细胞杀伤活性:NK 细胞杀伤活性% =(1-实验组A 平均值/靶细胞A 平均值)×100%。
1.5 EPE 氨基酸含量测定
采用GB/T 5009.124-2003 法,由农业部农产品质量监督检验测试中心(乌鲁木齐)检测。
1.6 数据处理及统计方法
实验数据用均数± 标准差(x ± s)表示,采用SPSS17.0 软件进行统计学处理,各组均数之间比较采用One-way ANOVA 检验。
2 结果与分析
2.1 EPE 对正常淋巴细胞活性的影响
与阴性对照组比较,低浓度EPE(93.75 μg/mL以下)对正常淋巴细胞的活性没有明显影响(P >0.05);随着EPE 浓度逐渐增大(187.5~750 μg/mL),对正常淋巴细胞的活性产生了明显的增殖影响(P <0.01),且EPE 浓度为187.5 μg/mL 时,增殖作用最明显(126.3 ±5.4%);但继续增大EPE 的浓度时(1500 μg/mL),对正常淋巴细胞的活性产生了明显毒性抑制作用(P <0.01),见表1。
表1 不同浓度EPE 对正常淋巴细胞活性的影响(n=5,±s)Table 1 Direct effect of different concentrations of EPE on the normal lymphocytes (n=5,±s)
注:与对照组比较,1)P <0.01。Note:vs control group,1)P <0.01.
组别Group浓度Concentrations(μg/mL)A570细胞活力Cell viability(%)对照组Control00.887 ±0.013100.0 ±1.5 EPE15000.776 ±0.0221) 87.5 ±2.51)7501.010 ±0.0181) 113.9 ±2.01)3750.984 ±0.0291) 111.0 ±3.31)187.51.120 ±0.0481) 126.3 ±5.41)93.750.889 ±0.015100.2 ±1.7 46.870.888 ±0.008100.1 ±0.9 23.440.872 ±0.02298.4 ±2.5
2.2 EPE 对ConA 诱导的T 淋巴细胞增殖活性的影响
与ConA 对照组比较,不同浓度的EPE 均能对ConA 诱导的T 淋巴细胞增殖活性产生明显的抑制作用(P <0.01);且呈剂量依赖性,随着EPE 浓度的增大,增殖活性的抑制作用逐渐增大;当EPE 浓度最大时(1500 μg/mL),增殖活性的抑制作用最强,但细胞活力已明显低于阴性对照组(72. 1 ±3.8%),见表2。
表2 不同浓度EPE 对ConA 诱导的T 淋巴细胞增殖活性的影响(n=5,±s)Table 2 Effect of different concentrations of EPE on the proliferation of T lymphocytes stimulated by ConA (n=5,±s)

表2 不同浓度EPE 对ConA 诱导的T 淋巴细胞增殖活性的影响(n=5,±s)Table 2 Effect of different concentrations of EPE on the proliferation of T lymphocytes stimulated by ConA (n=5,±s)
注:与对照组比较,1)P <0.01;与ConA 对照组比较,2)P <0.01。Note:vs control group,1)P <0.01;vs ConA control group,2)P <0.01.
组别Group ConA 浓度Concentrations of ConA(μg/mL)EPE 浓度Concentrations of EPE(μg/mL)A570细胞活力Cell viability(%)对照组Control 00.672 ±0.026 100.0 ±3.9 ConA1000.873 ±0.0111)129.9 ±1.61)1015000.485 ±0.0252)72.1 ±3.82)7500.725 ±0.0272)107.9 ±4.02)3750.765 ±0.0212)113.8 ±3.12)187.50.792 ±0.0242)117.8 ±3.62)EPE+ConA93.750.814 ±0.0162)121.1 ±2.32)46.870.820 ±0.0302)122.0 ±4.52)23.440.807 ±0.0222)120.1 ±3.32)0
2.3 EPE 对LPS 诱导的B 淋巴细胞增殖活性的影响
与LPS 对照组比较,仅两个高浓度的EPE 组(750、1500 μg/mL)对LPS 诱导的B 淋巴细胞增殖活性产生了明显的抑制作用(P <0.01),见表3。
表3 不同浓度EPE 对LPS 诱导的B 淋巴细胞增殖活性的影响(n=5,±s)Table 3 Effect of different concentrations of EPE on the proliferation of B lymphocytes stimulated by LPS (n =5,±s)

表3 不同浓度EPE 对LPS 诱导的B 淋巴细胞增殖活性的影响(n=5,±s)Table 3 Effect of different concentrations of EPE on the proliferation of B lymphocytes stimulated by LPS (n =5,±s)
组别Group LPS 浓度Concentrations of LPS(μg/mL)EPE 浓度Concentrations of EPE(μg/mL)A570细胞活力Cell viability(%)00.662 ±0.047 100.0 ±7.0 LPS1501.016 ±0.0151)153.4 ±2.21)1515000.712 ±0.0412)107.4 ±6.12)7500.889 ±0.0162)134.3 ±2.42)3750.984 ±0.018 148.5 ±2.7 EPE+LPS187.51.001 ±0.022 151.1 ±3.4对照组Control 0

注:与对照组比较,1)P <0.01;与LPS 对照组比较,2)P <0.01。Note:vs control group,1)P <0.01;vs LPS control group,2)P <0.01.
2.4 EPE 对NK 细胞杀伤活性的影响
EPE 与PC-3 细胞单独作用,与PC-3 对照组比较,仅有高浓度EPE(1500 μg/mL)对PC-3 细胞活性产生了明显的抑制作用(P <0.01);其他浓度对PC-3 细胞活性无明显影响(P >0.05),见表4。
表4 不同浓度EPE 对PC-3 细胞的直接作用(n=5,±s)Table 4 Direct effect of different concentrations of EPE on the PC-3 cells (n=5,±s)
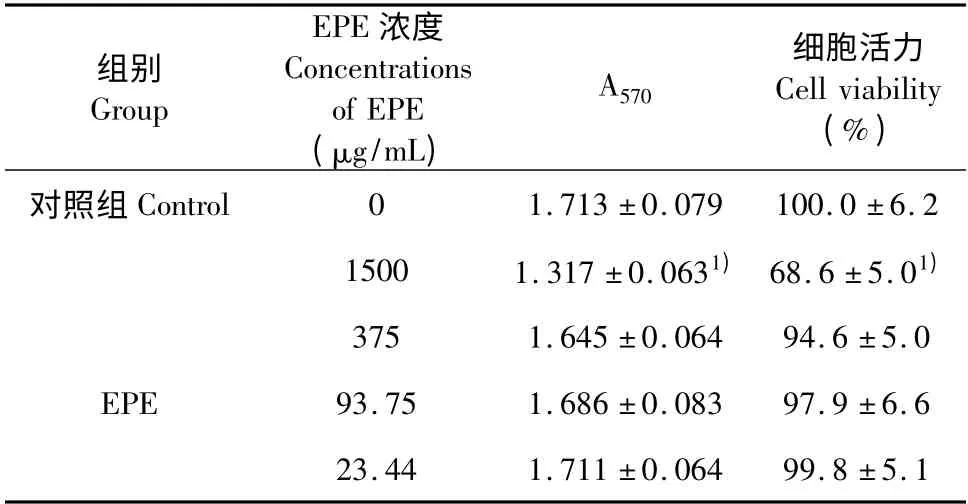
表4 不同浓度EPE 对PC-3 细胞的直接作用(n=5,±s)Table 4 Direct effect of different concentrations of EPE on the PC-3 cells (n=5,±s)
注:与对照组比较,1)P <0.01。Note:vs control group,1)P <0.01.
组别Group EPE 浓度Concentrations of EPE(μg/mL)A570细胞活力Cell viability(%)对照组Control01.713 ±0.079100.0 ±6.2 15001.317 ±0.0631) 68.6 ±5.01)3751.645 ±0.06494.6 ±5.0 EPE93.751.686 ±0.08397.9 ±6.6 23.441.711 ±0.06499.8 ±5.1
EPE 与NK 细胞和PC-3 细胞共同作用,与效靶细胞对照组比较,不同浓度的EPE 均能明显增强NK 细胞对PC-3 细胞的杀伤活性(P <0.01);且呈剂量依赖性,随着EPE 浓度的增大,杀伤活性逐渐增强;当EPE 浓度最大时(1500 μg/mL),杀伤活性的最强(44.4 ±2.8%),其次为375 μg/mL 组(30.1±4.3%)和93.75 μg/mL 组(25.3 ±6.4%),见表5。
表5 不同浓度EPE 对NK 细胞杀伤PC-3 细胞活性的影响(n=5,±s)Table 5 Effect of different concentrations of EPE on the cytotoxicity of NK cells against PC-3 cells (n=5,±s)

表5 不同浓度EPE 对NK 细胞杀伤PC-3 细胞活性的影响(n=5,±s)Table 5 Effect of different concentrations of EPE on the cytotoxicity of NK cells against PC-3 cells (n=5,±s)
组别Group EPE 浓度Concentrations of EPE(μg/mL)A570杀伤活性Cytotoxicity(%)靶细胞对照Target cell control 01.527 ±0.0520.0 ±3.4效靶细胞对照effector-target cell control 01.270 ±0.0611)16.8 ±4.01)15000.849 ±0.0422)44.4 ±2.82)3751.067 ±0.0662)30.1 ±4.32)EPE93.751.141 ±0.0972)25.3 ±6.42)

注:与靶细胞对照组比较,1)P <0.01;与效靶细胞对照组比较,2)P <0.01。Note:vs control group of target cells,1)P <0.01;vs control group of effector-target cells,2)P <0.01.
2.5 EPE 中氨基酸含量测定
EPE 中谷氨酸含量最高(7.53%),其次为天门冬氨酸(5.64%)和亮氨酸(5.54%),含有7 种必须氨基酸(色氨酸未测定)占氨基酸总量的38.9%。

表6 EPE 中氨基酸含量Table 6 Amino acid content of EPE
3 讨论
本实验研究显示马胎盘提取物(EPE)能一定程度增强正常淋巴细胞的活性,仅在最高浓度时(1500 μg/mL)表现出抑制正常淋巴细胞活性的作用,这可能是由于EPE 浓度过大对淋巴细胞产生了一定的毒性作用;不同浓度的EPE 对ConA 诱导的T 淋巴细胞增殖均具有显著的抑制作用,且具有剂量依赖效应,而对于LPS 诱导的B 淋巴细胞增殖的抑制作用相对较弱,仅在EPE 浓度为1500、750 μg/mL 时有抑制效应。这表明EPE 的免疫抑制作用更倾向于T 细胞介导的细胞免疫,而对于B 细胞介导的体液免疫作用相对较弱[6]。
ConA、LPS 可分别作用于T、B 淋巴细胞膜表面的相应受体,分别刺激活化T、B 淋巴细胞进入细胞周期进行有丝分裂增殖反应。Lankoff 等研究发现T淋巴细胞的增殖抑制作用可能与IL-2 分泌减少和IL-6 分泌增加有关[7],且IL-2 的减少可能是由于IL-2mRNA 稳定性的降低[8],而B 淋巴细胞增殖的抑制作用可能与B 细胞抗原受体和线粒体途径有关[9]。
EPE 单独作用于PC-3 细胞,除了最高浓度(1500 μg/mL)对PC-3 细胞产生毒性作用抑制其活性外,其他浓度对PC-3 细胞活性均没有明显影响,说明EPE 并不能直接抑制PC-3 细胞的活性;而EPE 与NK 细胞联合作用于PC-3 细胞,能明显抑制其活性,且呈剂量依赖性,随着EPE 浓度的增大,抑制率逐渐增大,说明EPE 能明显增强NK 细胞对PC-3 细胞的杀伤活力。
NK 细胞杀伤活性无MHC 限制,不依赖抗体,有非特异性识别靶细胞的能力,活化的NK 细胞可合成释放多种细胞因子,发挥调节免疫和直接杀伤靶细胞的作用。肿瘤细胞往往缺乏MHC-Ⅰ类分子的有效表达,故NK 细胞是肿瘤免疫治疗中的重要部分,通过药物增强NK 细胞活性继而提高其对肿瘤细胞的杀伤作用是肿瘤免疫治疗的重要研究方向[10]。
氨基酸含量分析结果表明EPE 中氨基酸含量丰富,且含有谷氨酸、甘氨酸、亮氨酸、精氨酸、天门冬氨酸等多种药效氨基酸。
综上所述,马胎盘提取物(EPE)对免疫功能具有一定程度的调节作用,且自身毒性小,氨基酸营养丰富等特点。在免疫保健方面可能具有潜在的应用价值,其作用机制还有待进一步研究。
1 Djian V,Menu E,Thibault G,et al.Immunoactive products of placenta.V. Immunoregulatory properties of a low molecular weight compound obtained from human placental cultures.Am J Reprod Immunol,1996,36:11-24.
2 Shinde V,Dhalwal K,Paradkar AR,et al. Evaluation of in vitro antioxidant activity of human placental extract.Pharmacologyonline,2006,3:172-179.
3 Chakraborty PD,De D,Bandyopadhyay S,et al.Human aqueous placental extract as a wound healer. J Wound Care,2009,11:464-467.
4 Zhou LT(周莉婷),Zhao JJ(赵晶晶),Wu YZ(吴彦卓),et al. Preparation of Mycobacterium polysaccharides and their effect on lymphocyte proliferation. Chin J New Drugs(中国新药杂志),2011,20:1136-1140.
5 Gu ZM(顾忠民),Ma ZS(马忠森),An JH(安继红),et al.Determination of NK cytotoxicity by improved MTT assay. J Norman Bethune Univ Med Sci (吉林大学学报医学版),2003,29:119-120.
6 Yang XZ(杨向竹),Zhao JY(赵俊云),Xue HQ(薛慧清),et al.Effects of Huangqi glycoprotein on mouse lymphocytes in vitro.Chin Pharm J (中国药学杂志),2011,46:1811-1813.
7 Lankoff A,Carmichael WW,Grasman KA,et al.The uptake kinetics and immunotoxic effects of microcystin-LR in human and chicken peripheral blood lymphocytes in vitro. Toxicology,2004,204:23-40.
8 Yea SS,Kim HM,Oh HM,et al. Microcystin-induced downregulation of lymphocyte functions through IL-2 mRNA stability.Toxicol Lett,2001,122:21-31.
9 Teneva I,Mladenov R,Popov N,et al.Cytotoxicity and apoptotic effects of microcystin-LR and anatoxin-a in mouse lymphocytes.Folia Biol (Praha),2005,51(3):62-67.
10 Zhao JX(赵敬湘),Wang ZL(王字玲).Advances of enhancing cytotoxicity of NK cells. Chin J Cancer Prev Treat (中华肿瘤防治杂志),2009,16:1267-1271.
