银杏叶内生真菌Aspergillus sp.YXf3 活性次生代谢产物的研究
2013-12-23郭志凯刘寿柏
郭志凯 ,刘寿柏,马 帅
1中国热带农业科学院热带生物技术研究所农业部热带作物生物学与遗传资源利用重点实验室,海口571101;2 海南大学园艺园林学院,海口570228
银杏(Ginkgo biolaba)又名白果、公孙树,为裸子植物亚门银杏纲、银杏科单种属植物,是我国一种特有的珍贵树种,是一种经济价值较高的重要药用植物,其叶和根皮中存在的银杏内酯能阻断血小板激活因子的活性,改善血液循环,活化细胞代谢,进而具有保护心脑缺血缺氧不受损害,防治冠心病、脑血栓等多种作用[1]。植物普遍与内生菌存在着密切的互利共生关系,植物内生菌生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部,被感染的宿主植物(至少是暂时)不表现出外在病症,即植物内生菌可理解为植物组织内的正常菌群[2]。植物内生菌能够产生多种骨架类型的新颖活性天然产物,是微生物天然产物研究的一个热点[3]。前人已从银杏植物组织中分离鉴定出内生真菌[4],并对其次生代谢产物进行了初步研究[5,6]。内生真菌菌株Aspergillus sp. YXf3 是从银杏叶片中分离获得的,前期已从其发酵液中分离鉴定出结构新颖的三联苯类化合物和二萜类化合物[7]。进一步对其发酵液乙酸乙酯提取物的化学成分研究,从中分离鉴定得到5 个化合物,分别为terreinol (1)、cyclo-(L-Leu-L-Trp)(2)、sphaeropsidin A(3)、sphaeropsidin B(4)和4-hydroxy-3-(3'- methyl-2'-butenyl)benzoic acid(5)。体外神经氨酸酶抑制剂活性的初步评价结果表明,化合物cyclo-(L-Leu-L-Trp)(2)和sphaeropsidin B(4)具有较强的抑制活性,其IC50分别为4.67 和3.40 μM,具有潜在的利用前景。
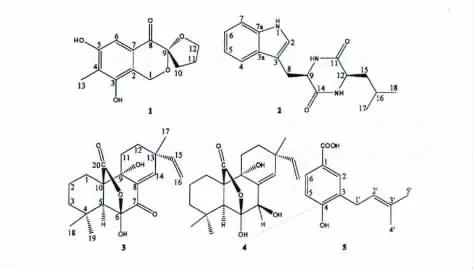
图1 化合物1~5 的化学结构Fig.1 Chemical structures of compounds 1-5
1 材料与方法
1.1 材料
1.1.1 仪器与试剂
高分辨质谱(HR-ESI-MS)由Agilent 6210 TOF LC-MS 质谱仪测定(Agilent,美国);单体化合物的1H 和13C NMR 数据由Bruker DRX 500 和/或Bruker DRX 300 核磁共振仪(Bruker,德国)测定,并以四甲基硅烷(TMS)为内标,化学位移以δ (ppm)表示;层析柱硅胶(200~300 目)和薄层层析硅胶(GF254)均为青岛海洋化工厂出品;Sephadex LH-20由瑞典Pharmacia Biotech 生产;ODS 硅胶来自日本京都Nacalai Tesque 公司;HPLC 系统:Waters ODS-5 μm (250 × 4.6 mm,5 μm),Hitachi pump L-7100 和UV detector L-7400。神经氨酸酶抑制测试试剂盒购自Beyotime Instistute of Biotechnology(中国,海门),利用SUNRISE 酶标仪(Tecan,奥地利)记录。HPLC 实验均利用色谱纯试剂,其它使用的试剂均为分析纯。
1.1.2 培养基
麦芽固体培养基(MEA):麦芽20.0 g、蔗糖20.0 g、蛋白胨1.0 g、琼脂条20.0 g、重蒸水定容至1000 mL,pH 值自然。麦芽沸水煮30 min 后,过滤、定容分装。种子平板为MEA 培养基平板;发酵培养基为麦芽液体培养基,pH 值自然。
1.1.3 菌株
内生真菌菌株Aspergillus sp. YXf3 是从江苏南京大学鼓楼校区校园采集的健康银杏叶片上通过组织分离法分离获得的[7]。
1.2 实验方法
1.2.1 菌株发酵
Aspergillus sp. YXf3 经MEA 固体平板活化,培养条件为28 ℃,暗培养5 d。之后将平板中的菌落块直接接种到装有300 mL MEA 液体培养基的1000 mL 三角瓶中,三层摇床上发酵13 d(摇速为140 rpm,26 ℃)后,过滤得菌液。
1.2.2 提取与分离
发酵结束后,用三层纱布过滤除去菌体得发酵液约15 L,经等体积的乙酸乙酯萃取4 遍,减压浓缩得乙酸乙酯粗膏3.5 g。该浸膏经减压硅胶柱层析,以氯仿-甲醇梯度洗脱,在TLC 检测下合并相似流份得8 个流份(Fr.1~ Fr.8)。Fr.2(0.68 g)(氯仿-甲醇,100∶1)经常压C18ODS 反相柱层析(洗脱液为梯度甲醇水)后,将70%的甲醇水部位(10.6 mg)经多次Sephadex LH-20 凝胶柱层析(甲醇为洗脱液)得化合物3(2.0 mg)。其60%的甲醇水部位(205.2 mg)经Sephadex LH-20 凝胶柱层析(甲醇为洗脱液)得Fr.2-3-3(120.4 mg),再经HPLC 纯化得到化合物4(21.0 mg;甲醇∶水,64∶36;保留时间为30.0 min)。Fr.3(0.20 g)(氯仿-甲醇,100∶2)经常压C18ODS 反相柱层析(洗脱液为梯度甲醇水),其75%的甲醇水部位(17.3 mg)经多次Sephadex LH-20 凝胶柱层析(甲醇为洗脱液)得化合物1(5.0 mg)。Fr.4(0.78 g)(氯仿-甲醇,100∶4)经常压C18 ODS 反相柱层析(洗脱液为梯度甲醇水),将得到的60%甲醇水部位(32.1 mg)经HPLC 分离和Sephadex LH-20凝胶柱层析纯化得到化合物5(8.5 mg;甲醇∶水,60∶40;保留时间为19.8 min)。其70%的甲醇水部位(28.2 mg)经HPLC 纯化得到化合物2 (6.4 mg;甲醇∶水,52∶48;保留时间为26.1 min)。
1.2.3 神经氨酸酶抑制剂活性的测定
按照试剂盒提供的标准方法进行(供试的神经氨酸酶与禽流感病毒来源的神经氨酸酶高度保守):1.标准曲线检测的准备:(a)在96 孔荧光酶标板内每孔加入70 μL 神经氨酸酶检测缓冲液;(b)每孔再分别加入0、1、2、5、7.5 和10 μL 神经氨酸酶;(c)每孔再加入0~20 μL Milli-Q 水使每孔总体积为90 μL。2.样品检测的准备:(a)在96 孔荧光酶标板内每孔加入70 μL 神经氨酸酶检测缓冲液;(b)每孔再加入10 μL 神经氨酸酶;(c)每孔再加入0~10 μL 待筛选的神经氨酸酶抑制剂样品;(d)每孔再加入0~10 μL Milli-Q 水使每孔总体积为90 μL。3.检测:(a)振动混匀约1 min;(b)37 ℃孵育2 min 使抑制剂和神经氨酸酶充分相互作用,做标准曲线的样品也一起孵育;(c)每孔加入10 μL 神经氨酸酶荧光底物;(d)再振动混匀约1 min;(e)37℃孵育20 min 后进行荧光测定,激发波长为360 nm、发射波长为440 nm。4.计算:根据标准曲线可以计算出样品对于神经氨酸酶的抑制百分比。以上每个处理做3 个重复,并对检测出来的有效抑制剂,做适当的浓度曲线后得出该抑制剂的IC50值。
2 结果与讨论
2.1 结构鉴定
化合物1 灰白色粉末(甲醇);HR-ESI-MS m/z 273.0898 (calcd for C13H14O5Na,273.0733);1H NMR (DMSO-d6,300 MHz)δ:4.83 (1H,d,J =15.7 Hz,H-1a),4.70 (1H,d,J = 15.7 Hz,H-1b),6.93 (1H,s,H-6),2.54 (1H,dt,J = 8.9,12.7 Hz,H-10a),1.84 (1H,ddd,J = 4.4,8.3,12.7 Hz,H-10b),2.06 (1H,m,H-11a),1.98 (1H,m,H-11b),3.99 (1H,dd,J = 7.6,14.3 Hz,H-12a),3.92(1H,dd,J = 7.6,14.3 Hz,H-12b),2.07 (3H,s,H-13),8.83 (1H,s,HO-3),9.64 (1H,s,HO-5);13C NMR (DMSO-d6,75 MHz)δ:58.1 (t,C-1),120.9(s,C-2),150.9 (s,C-3),119.2 (s,C-4),155.2 (s,C-5),103.1 (d,C-6),126.0 (s,C-7),188.3 (s,C-8),104.6 (s,C-9),32.2 (t,C-10),24.3 (t,C-11),69.4 (t,C-12),9.5 (q,C-13)。分析以上波谱数据,其与文献[8-10]报道一致,故将化合物1 鉴定为terreinol。
化合物2 白色粉末(丙酮);HR-ESI-MS m/z 322.1526 (calcd for C17H21N3O2Na,322.1526);1H NMR (DMSO-d6,500 MHz)δ:10.89 (1H,br s,NH-1),7.08 (1H,s,H-2),7.57 (1H,d,J = 7.7 Hz,H-4),6.94 (1H,t,J = 7.7 Hz,H-5),7.04 (1H,t,J= 7.7 Hz,H-6),7.31 (1H,d,J = 7.7 Hz,H-7),3.25 (1H,dd,J = 9.5,14.7 Hz,H-8a),3.03 (1H,dd,J = 4.3,14.7 Hz,H-8b),4.09 (1H,m,H-9),7.87 (1H,br s,NH-10),2.91 (1H,br dt,J = 1.3,6.5 Hz,H-12),7.95 (1H,br s,NH-13),1.41 (1H,m,H-15a),1.31 (1H,m,H-15b),1.66 (1H,m,H-16),0.65 (3H,d,J = 6.5 Hz,H-17),0.73 (3H,d,J = 6.5 Hz,H-18);13C NMR (acetone-d6,125 MHz)δ:125.6 (d,C-2),109.8 (s,C-3),128.6 (s,C-3a),119.7 (d,C-4),119.8 (d,C-5),122.3 (d,C-6),112.1 (d,C-7),137.5 (s,C-7a),30.2 (t,C-8),56.4 (d,C-9),169.7 (s,C-11),53.3 (d,C-12),169.6 (s,C-14),42.3 (t,C-15),24.7 (d,C-16),21.9 (q,C-17),23.2 (q,C-18)。以上波谱数据与文献[11]报道基本一致,故将化合物2 鉴定为环二肽化合物cyclo-(L-Leu-L-Trp)。
化合物3 无色针状晶体(氯仿);HR-ESI-MS m/z 369.1678 (calcd for C20H26O5Na,369.1672);1H NMR (CDCl3,500 MHz)δ:2.22 (1H,br d,J =10.7 Hz,H-1a),1.58 (1H,m,H-1b),1.58 (2H,m,H-2),1.86 (1H,m,H-3a),1.82 (1H,m,H-3b),2.72 (1H,s,H-5),1.35 (1H,br d,J = 14.0 Hz,H-11a),1.18 (1H,m,H-11b),1.84 (1H,m,H-12a),1.64 (1H,m,H-12b),6.84 (1H,s,H-14),5.83(1H,dd,J = 10.5,17.5 Hz,H-15),5.08 (2H,dd,J= 10.5,17.5 Hz,H-16),1.06 (3H,s,H-17),1.17(3H,s,H-18),1.16 (3H,s,H-19),5.24 (1H,br s,HO-6)。以上氢谱数据与文献[12]报道一致,故将化合物3 鉴定为海松烷型二萜化合物sphaeropsidin A。
化合物4 无色针状晶体(氯仿);HR-ESI-MS m/z 371.1858 (calcd for C20H28O5Na,371.1829);1H NMR (CDCl3,500 MHz)δ:2.13 (1H,br d,J =12.3 Hz,H-1a),1.48 (1H,m,H-1b),1.55 (2H,m,H-2),1.97 (1H,m,H-3a),1.48 (1H,m,H-3b),2.57 (1H,s,H-5),4.22 (1H,s,H-7),1.30 (1H,br d,J = 13.3 Hz,H-11a),1.16 (1H,m,H-11b),1.69(1H,m,H-12a),1.59 (1H,m,H-12b),5.88 (1H,br s,H-14),5.82 (1H,dd,J = 10.0,17.0 Hz,H-15),5.02 (1H,d,J = 17.0 Hz,H-16a),4.99 (1H,d,J= 10.0 Hz,H-16b),1.00 (3H,s,H-17),1.22 (3H,s,H-18),1.11 (3H,s,H-19);13C NMR (acetone-d6,125 MHz)δ:23.1 (t,C-1),19.2 (t,C-2),28.2 (t,C-3),32.5 (s,C-4),52.3 (d,C-5),111.2 (s,C-6),74.9 (d,C-7),136.8 (s,C-8),71.7 (s,C-9),58.7(s,C-10),41.4 (t,C-11),31.0 (t,C-12),38.6 (s,C-13),133.6 (d,C-14),148.8 (d,C-15),111.2 (t,C-16),24.3 (q,C-17),33.2 (q,C-18),22.6 (q,C-19),176.2 (s,C-20)。以上波谱数据与文献[12]报道一致,故将化合物4 鉴定为海松烷型二萜化合物sphaeropsidin B。
化合物5 白色粉末(氯仿);HR-ESI-MS m/z 229.0835 (calcd for C12H14O3Na,229.0844);1H NMR (CDCl3,300 MHz)δ:7.89 (1H,s,H-2),6.85(1H,d,J = 8.0 Hz,H-5),7.90 (1H,d,J = 8.0 Hz,H-6),3.40 (2H,d,J = 6.8 Hz,H-1'),5.32(1H,br t,J = 6.8 Hz,H-2'),1.80 (6H,s,H-4',-5');部分13C NMR 数据(acetone-d6,75 MHz)δ:122.8 (s,C-1),132.3 (d,C-2),128.7 (s,C-3),160.2 (s,C-4),115.2 (d,C-5),130.1 (d,C-6),28.8 (t,C-1'),123.2 (d,C-2'),133.0 (s,C-3'),17.9 (q,C-4'),25.9 (q,C-5')。以上波谱数据与文献[13]报道基本一致,故将化合物5 鉴定为4-hydroxy-3-(3'-methyl-2'-butenyl)benzoic acid。
2.2 神经氨酸酶抑制剂活性的初步评价
利用神经氨酸酶抑制活性测试试剂盒,对化合物1~5 进行了体外抑制活性测定,以瑞士罗氏制药公司生产的Oseltamivir(Tamifu,达菲为其商品名)为阳性对照。测试结果显示,环二肽类化合物2 和二萜化合物4 具有较强的体外神经氨酸酶抑制活性,IC50分别为4.67 和3.40 μM,而化合物1、3 和5抑制活性弱,IC50大于30 μM。阳性对照药Oseltamivir 体外神经氨酸酶抑制IC50为0.14 μM。
2.3 讨论
本文对银杏叶内生真菌Aspergillus sp. YXf3 次生代谢产物进行了研究,并首次从银杏内生真菌产物中分离鉴定了5 个化合物terreinol(1)、cyclo-(LLeu-L-Trp)(2)、sphaeropsidin A(3)、sphaeropsidin B(4)和4-hydroxy-3-(3'-methyl-2'-butenyl)benzoic acid(5)。其中化合物1 首次报道发现于土壤真菌Aspergillus terreus[8],但尚未见其活性报道。植物病原真菌Sphaeropsis sapinea f sp. cupressi 产生植物毒素sphaeropsidin A(3)和sphaeropsidin B(4),并具有抗真菌活性[12],但其首次由Ellestad GA 等[14]从真菌Aspergillus chevalieri 中分离得到[分别为LLS491β (3)和γ(4)],并且发现化合物3 对一些革兰氏阳性菌具有显著的抗菌活性,化合物4 具有抗疱疹病毒活性,且二者都具有强抗梨形四膜虫的活性。化合物5 首次从山茱萸炭疽病病原真菌Discula sp.分离得到,也具有植物毒活性[13]。本文对化合物1~5 首次开展了神经氨酸酶抑制剂活性测试,发现化合物2 和4 具有较强的体外神经氨酸酶抑制活性。而目前治疗H5N1 型禽流感病毒的药物都是神经氨酸酶抑制剂,如达菲、Zanamivir 等。但达菲价格昂贵,且已发现了达菲耐受型禽流感病毒,而Zanamivir 不能口服,其应用受到限制,因此迫切需要寻找治疗禽流感的新型候选药物。本文从银杏内生真菌中分离出的化合物2 和4 具有较强的体外神经氨酸酶抑制活性,但供试的神经氨酸酶不是来源于禽流感病毒,还需对其做进一步的活性评价。
1 Wu H(吴荭).Development and utilization of Ginkgo biloba leaves.Resource Development & Market(资源开发与市场),1994,10:154-155.
2 Zhang HW,Song YC,Tan RX.Biology and chemistry of endophytes.Nat Prod Rep,2006,23:753-771.
3 Ge HM(戈惠明),Tan RX(谭仁祥).Symbionts,an important source of new bioactive natural products. Progress in Chem(化学进展),2009,21:30-46.
4 Yan ZY(严铸云),Pang L(庞蕾),Luo J(罗静),et al.Isolation and identification of endophytic fungi in Ginkgo biloba L..West China J Pharm Sci(华西药学杂志),2006,21:425-427.
5 Zhou SL(周松林),Chen SL(陈双林),Tan GH(谭光宏),et al. Antibacterial substances of endophytic fungus isolated from Ginkgo biloba.Nat Prod Res Dev(天然产物研究与开发),2010,22:193-196.
6 Wang GP(王国平),Wang LW(王丽薇),Zhang YL(张亚磊),et al. Identification of an endophytic fungus of Ginkgo biloba TMSF169 and its antifungal metabolites. Chin J Biol Control(中国生物防治学报),2012,28:226-234.
7 Guo ZK,Yan T,Guo Y,et al. p-Terphenyl and diterpenoid metabolites from endophytic Aspergillus sp. YXf3. J Nat Prod,2012,75:15-21.
8 de Macedo Jr FC,Porto AL,Marsaioli AJ.Terreinol – a novel metabolite from Aspergillus terreus:structure and13C labeling.Tetrahedron Lett,2004,45:53-55.
9 de Macedo Jr FC,Marsaioli AJ. Total structural assignment and absolute configuration of terreinol by13C and1H NMR.Magn Reson Chem,2005,43:251-255.
10 Wei WG,Zhang YX,Yao ZJ. Efficient construction of novel α-keto spiro ketal and the total synthesis of(±)-terreinol.Tetrahedron,2005,61:11882-11886.
11 Deslauriers R,Grzonka Z,Schaumburg K,et al. Carbon-13 nuclear magnetic resonance studies of the conformations of cyclic dipeptides.J Am Chem Soc,1975,97:5093-5100.
12 Evidente A,Sparapano L,Fierro O,et al. Sphaeropsidins B and C,phytotoxic pimarane diterpenes from Sphaeropsis sapinea F. sp. cupressi and Diplodia mutila. Phytochemistry,1997,45:705-713.
13 Venkatasubbaiah P,Chilton WS.Toxins produced by the dogwood anthracnose fungus Discula sp..J Nat Prod,1991,54:1293-1297.
14 Ellestad GA,Kunstmann MP,Mirando P,et al. Structures of fungal diterpene antibiotics LL-S491β and -γ. J Am Chem Soc,1972,94:6206-6208.
