贝那普利联合缬沙坦治疗早期糖尿病肾病的效果与安全性分析
2013-12-23吴运斗李大勇黄映红陈远美
吴运斗 朱 厉 李大勇 李 萌 黄映红 陈远美
1.长沙市第一医院肾内科,湖南长沙 417000;2.北京大学第一医院肾脏内科,北京 100034
糖尿病肾病(DN)是糖尿病(DM)最常见的并发症之一,亦是目前临床上终末期肾衰竭常见的致病原因[1]。给予早期糖尿病肾病(EDN)患者干预措施,可以在一定程度上延缓疾病的进展。 目前EDN 的干预方案较多,不同方案的疗效与不良反应不一,本研究旨在探讨贝那普利联合缬沙坦治疗EDN 的疗效与安全性,现报道如下:
1 资料与方法
1.1 一般资料
选取2009 年3 月~2012 年5 月长沙市第一医院肾内科收治的180 例患者作为研究对象。 纳入标准:①临床分型为2 型糖尿病(T2DM);②符合DN 的诊断标准[2];③尿白蛋白排泄率(UAER)在20~200 μg/min 之间;④病情稳定,血糖控制良好。 排除标准:①对贝那普利或缬沙坦过敏的患者;②合并血管神经性水肿的患者;③合并其他因素所致肾损伤的患者。 将上述研究对象随机分为A、B、C 三组,三组患者一般资料相比差异无统计学意义 (P >0.05),具有可比性,见表1。
1.2 方法
在降血糖治疗基础上,A、B、C 组患者分别接受贝那普利(北京诺华制药有限公司生产,国药准字H20030514,规格10 mg/片)、缬沙坦(北京诺华制药厂有限公司生产,国药准字H20040217,规格80 mg/片)、贝那普利联合缬沙坦治疗。A 组患者具体方法为贝那普利10 mg/次,口服,1 次/d。B 组患者具体方法为缬沙坦80 mg/次,口服,1 次/d。C 组患者贝那普利使用方法与A 组患者一致,缬沙坦使用方法与B 组患者一致。 所有患者疗程均为20 周。
表1 三组一般资料比较(s)
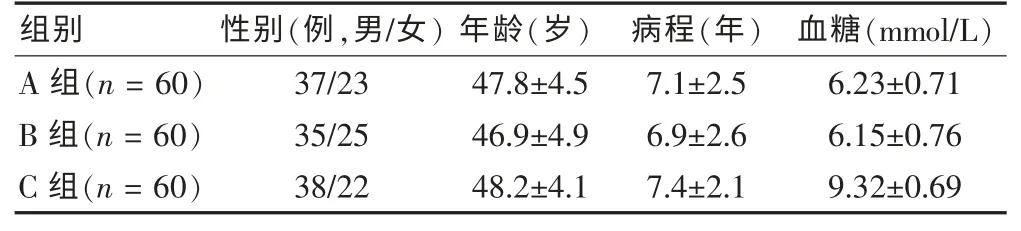
表1 三组一般资料比较(s)
组别 性别(例,男/女) 年龄(岁) 病程(年) 血糖(mmol/L)A 组(n = 60)B 组(n = 60)C 组(n = 60)37/23 35/25 38/22 47.8±4.5 46.9±4.9 48.2±4.1 7.1±2.5 6.9±2.6 7.4±2.1 6.23±0.71 6.15±0.76 9.32±0.69
1.3 仪器与试剂
欧姆龙(大连)有限公司生产的HEM-7200 电子血压计。 罗氏公司生产的Elecsys E170 化学发光仪及配套UAER、β2微球蛋白(β2-MG)、转化生长因子β(TGF-β)试剂盒。奥林巴斯公司生产的Olympus 2700 全自动生化分析仪,上海科华生物工程股份有限公司生产的血清胱抑素C(Cys C)试剂盒。
1.4 观察指标
①平均动脉压(MAP):在静息状态下,先测定患者收缩 压(SBP)、舒 张 压(DBP),MAP=DBP+(SBP-DBP)/3[3]。②UAER:先准确收集患者24 h 尿液,然后测量尿量(V),取3 mL 尿液测定微量白蛋白浓度(mAlb),UAER=[mAlb(μg/L)×V(L)]/1440[4]。 ③β2-MG:先测定尿β2-MG 浓 度(E),β2-MG=E(μg/L)×V(L)。④TGF-β:与UAER 测定方法一致。⑤Cys C:抽取患者静脉血3 mL,3000 r/min 离心5 min后分离血清,取血清上机检测。
1.5 统计学方法
采用SPSS 19.0 统计软件进行数据分析,计量资料用均数±标准差(s)表示,计数资料用率表示。多个样本均数间的比较采用完全随机设计资料的方差分析或完全随机设计多个样本比较的Krusskal-Wallis H 检验,其对应的组间两两比较分别为q 检验、Nemenyi 法检验;多个样本率的比较采用χ2检验。 以P <0.05 为差异有统计学意义。
2 结果
2.1 三组治疗效果比较
治疗前,三组患者MAP、UAER、β2-MG、TGF-β、Cys C相比差异无统计学意义(P >0.05)。 治疗后,三组患者上述指标均显著下降 (均P <0.05),C 组患者上述指标均显著低于A 组与B 组(均P <0.05)。 见表2。
表2 三组治疗效果比较(s)

表2 三组治疗效果比较(s)
注:MAP: 平均动脉压;UAER: 尿白蛋白排泄率;β2-MG:β2 微球蛋白;TGF-β:转化生长因子β;Cys C:血清胱抑素C;1 mmHg = 0.133 kPa
UAER(μg/min)β2-MG(μg/24 h)TGF-β(pg/min)Cys C(mg/L)A 组(n = 60)治疗前治疗后B 组(n = 60)治疗前治疗后C 组(n = 60)治疗前治疗后99.1±13.2 92.3±10.7 83.4±18.7 53.9±12.5 137.1±35.4 95.7±24.7 24.9±5.7 15.7±2.5 1.75±0.51 1.54±0.45 98.8±13.4 91.9±11.0 82.9±19.0 54.7±12.2 136.5±36.2 96.4±25.1 23.5±6.2 15.1±2.9 1.69±0.57 1.51±0.47 99.5±13.0 88.1±10.3 83.5±18.4 39.8±10.9 137.5±35.0 73.0±19.8 24.5±5.9 10.4±1.8 1.73±0.59 1.29±0.36
2.2 三组不良反应发生率比较
A 组患者有5 例患者出现不良反应, 包括干咳3 例,头痛、头晕2 例,发生率为8.3%;B 组患者有4 例患者出现不良反应,包括头痛3 例,水肿1 例,发生率为6.7%;C 组患者有5 例患者出现不良反应,包括咳嗽4 例,肌肉酸痛1例,发生率为8.3%; 三组患者不良反应发生率相比差异无统计学意义(P >0.05)。 此外,上述不良反应均症状轻微,患者均可耐受,未终止治疗。
3 讨论
在DM 患者体内,长期高血糖可以导致蛋白质发生非酶促糖基化反应形成糖化蛋白质,后者与未糖化蛋白质分子互相结合、交联,使蛋白质分子逐渐加大,形成大分子糖化产物[5]。当该反应发生在肾小球微动脉弹性硬蛋白时,可以导致血管基底膜增厚,从而逐步导致EDN 的发生。
值得注意的是,在DN 发生、发展过程中,血管紧张素Ⅱ(AngⅡ)发挥了重要的作用:一方面,AngⅡ可以显著收缩肾小球出球小动脉,从而导致肾小囊内高压,肾小球孔径屏障功能下降,使肾小球基底膜受损;另一方面,AngⅡ还具有一定的促生长作用,它可以促进肾小球系膜细胞的增生、肥大,同时刺激胶原蛋白合成、纤维细胞增生,进一步导致肾小球硬化的发生[6]。 上述作用呈进行性、不可逆性,因此早期诊断、早期治疗对EDN 来说意义是十分重大的。
目前早期干预EDN 的方案较多, 本研究主要探讨的是贝那普利、缬沙坦联合方案对EDN 的疗效与安全性。 贝那普利属于血管紧张素Ⅰ转化酶抑制剂(ACEI)类药物,它可以抑制血管紧张素Ⅰ(AngⅠ)转化为AngⅡ,通过降低肾组织AngⅡ浓度发挥肾脏保护作用,如恢复肾小球孔径屏障功能、防止肾小球硬化等[7]。缬沙坦则属于血管紧张素Ⅱ受体拮抗剂(ARB)类药物,它与AngⅡ受体1(AT1)具有高度特异性,可以阻断AngⅡ与AT1 结合,从而发挥降低肾小球有效滤过压以及肾小球滤过膜通透性等肾脏保护作用[8]。
本研究将180 例EDN 患者随机分为A、B、C 三组,在降血糖方案基础上A 组患者接受贝那普利治疗,B 组接受缬沙坦治疗,C 组接受贝那普利联合缬沙坦治疗。 本研究结果显示,A 组患者与B 组患者均可以取得一定的疗效,患者病情得到一定程度的控制,但是C 组患者的疗效显著优于A、B 组患者,亦即C 组患者病情得到了最佳控制。 此外, 本研究还对比分析了三组患者的不良反应发生率,结果显示三组患者不良反应发生率相比差异无统计学意义(P >0.05),并且三组患者不良反应均症状轻微,患者可耐受,未终止治疗。
综上所述, 贝那普利联合缬沙坦治疗EDN 的疗效确切,可显著改善患者肾功能,还具有耐受性好等优点,因此该方案是治疗EDN 的有效方案之一。
[1] McKnight AJ,Currie D,Patterson CC,et al. Targeted genome-wide investigation identifies novel SNPs associated with diabetic nephropathy [J]. Hugo J,2009,3(1-4):77-82.
[2] Wang QY,Guan QH,Chen FQ.The changes of platelet-derived growth factor-BB(PDGF-BB)in T2DM and its clinical significance for early diagnosis of diabetic nephropathy[J].Res Clin Pract,2009,85(2):166-170.
[3] Macdonald-Wallis C,Lawlor DA,Palmer T,et al. Multivariate multilevel spline models for parallel growth processes:application to weight and mean arterial pressure in pregnancy [J]. Stat Med,2012,31(26):3147-3164.
[4] Uno H,Ishikawa J,Hoshide S,et al. Effects of strict blood pressure control by a long-acting calcium channel blocker on brain natriuretic peptide and urinary albumin excretion rate in Japanese hypertensive patients [J]. Hypertens Res,2008,31(5):887-896.
[5] Calabrese V,Mancuso C,Sapienza M,et al. Oxidative stress and cellular stress response in diabetic nephropathy[J].Cell Stress Chaperones,2007,12(4):299-306.
[6] Shamkhlova MS,Trubitsyna NP,Katsaia GV,et al. The angiotensin Ⅱinhibition escape phenomenon in patients with type 2 diabetes and diabetic nephropathy [J]. Ter Arkh,2008,80(1):49-52.
[7] Jia ZH,Liu ZH,Zheng JM,et al. Combined therapy of rhein and benazepril on the treatment of diabetic nephropathy in db/db mice [J].Exp Clin Endocrinol Diabetes,2007,115(9):571-576.
[8] Dong YF,Liu L,Lai ZF,et al. Aliskiren enhances protective effects of valsartan against type 2 diabetic nephropathy in mice [J]. J Hypertens,2010,28(7):1554-1565.
