赣中亚热带森林转换对土壤氮素矿化及有效性的影响
2013-12-20宋庆妮杨清培余定坤赵广东俞社保
宋庆妮,杨清培,* ,余定坤,方 楷,赵广东,俞社保,
(1.江西农业大学江西省竹子种质资源与利用重点实验室,南昌 330045;2.中国林业科学研究院森林生态环境与保护研究所,北京 100091)
森林是陆地生态系统的主体,在世界林业发展和全球生态系统碳氮功能维护中发挥了巨大作用,但长期的人类活动已引起森林利用格局发生剧烈变化[1],世界各国都在努力探索有效的森林经营与管理方式[2]。上世纪末我国开始实施了天然林保护和退耕还林等重大林业生态工程,现在各种天然林和人工林面积得到明显增加,实现了蓄积和面积的双增长,生态功能得到明显改善[3],然而有关这一变化过程中土壤养分转化问题却较少关注。
氮是植物从土壤中吸收量最多的营养元素,但土壤中80%以上的氮素以有机态形式存在,它们必须通过矿化作用转化为无机氮才能被植物吸收,所以土壤氮素的矿化作用及有效性强烈影响着森林生产力[4-5]。同时,矿化过程产生的无机氮若不能被植物及时吸收就会发生挥发、淋溶,从而引起生态环境问题[6]。因此,森林土壤氮素矿化作用一直是森林生态学的研究热点,尤其是在全球土地利用方式/覆被变化背景下,森林类型与经营方式转换对土壤氮素循环的影响倍受关注[7]。研究发现,温带和热带原生林受到人为干扰或转换成人工林后,土壤供氮能力与无机氮维持能力显著下降[8-10],而一些热带雨林转换成农林生态系统或草地后,土壤矿化作用却出现明显增强的现象[11-12]。另外,对干扰形成的残次林和人工林进行有效保护与合理经营,其养分功能会得到恢复与提高[13-16]。我国亚热带地区人类活动频繁,森林植被正经历着各式各样的剧烈变化,因此,开展本地区森林类型转换过程中土壤氮素矿化及有效性研究,对保护森林资源和提高环境质量具有重要意义[17]。
江西地处中亚热带东部,地带性植被是常绿阔叶林[18]。作为我国南方集体林区重要省份之一,它在为国家提供大量林产品的同时,其原生植被也曾遭到了严重破坏。但近年随着各种封山育林、荒山造林措施的广泛开展,全省森林覆盖率升至63.1%,居全国之首[19]。因此,江西在亚热带地区林业发展和生态建设中具有较强的代表性。本文在江西大岗山选取常绿阔叶林、天然马尾松林、人工杉木林、人工马褂木林,进行土壤氮素矿化作用及有效性比较研究,试图探讨以下问题:(1)亚热带森林转换过程中土壤氮素有效性怎样变化?(2)土壤氮素能否满足各种森林生长的需求?(3)地带性森林转换成次生林过程中是否易造成N流失?以便深刻理解不同森林管理方式对土壤肥力和生态环境功能的影响,以期为亚热带森林保护、恢复与人工林经营提供理论指导,同时为全球森林氮素循环格局研究提供重要参考。
1 材料与方法
1.1 试验地概况
试验地位于赣中分宜县境内的大岗山国家森林生态站,114°30'—114°45'E,27°30'—27°50'N,年平均气温15.8—17.7℃,年平均降水量为1 591 mm,降水主要集中在6—9月,属亚热带湿润气候。土壤主要是低山丘陵红壤、黄壤类型及其各种亚类型。地带性植被是常绿阔叶林[20],但因多种经营活动的广泛开展,现存植被主要有常绿阔叶林、马尾松林以及杉木、马褂木等人工林[21]。
样地海拔高度280—320 m,常绿阔叶林优势种是栲树。(Castanopsis fargesii),林龄为40—50 a,伴生树种主要有苦槠(Castanopsis sclerophylla)、小叶栎(Quercus chenii)、黄牛奶树(Symplocos laurina)等;下木层主要有绒毛润楠(Machilus velutina)、黄牛奶树、油茶(Camellia oleifera)等,草本植物主要有淡竹叶(Lophatherum gracile)、草珊瑚(Sarcandra glabra)、芒萁(Dicranopteris dichotoma)等。马尾松林由封山育林形成,木荷(Schima superba)、苦槠等阔叶树种逐渐成为次优种;灌木层主要有檵木(Loropetalum chinensis)、油茶等。杉木林和马褂木林是在常绿阔叶林采伐迹地上营造的人工纯林,且无施肥处理。这些林分相距不远或相互毗邻,本底条件(母岩、土层厚度、土壤层次)相似,从而为森林转换对土壤氮素矿化作用影响研究提供了良好的试验地条件(表1)。

表1 样地植被状况Table 1 The site features of vegetation composition of the sampled plots
1.2 试验方案
2010年4月20日至12月20日,选取4种森林类型并各设置2块面积为20 m×20 m的样地。采用PVC顶盖埋管法,在每块样地的四角及中心位置确定5个采样点,去除地表植物和凋落物,将2根长为17 cm、内径为5 cm的PVC管垂直打入土中(以装满为准),二者相距较近(<5 cm),小心取出其中1根,带回实验室;另1根盖上顶盖,留在原位培养,待培养结束时取回。如此,将下一批管按上述方法布置于前一次培养点附近。掏出每次取回PVC管中的土壤,并拣去根系和石砾,过2 mm筛,再分别测定每样点土壤NH+4-N、NO-3-N 含量。共计5个培养期6次无机氮分析(4月20日,5月30日,7月10日,8月30日,11月5日,12月20日)。同时,还用土钻(φ=4.9 cm)在PVC管附近(<10 cm)取细根生物量。
1.3 样品测定方法
室内土壤分析包括NH+4-N、NO-3-N及其他相关土壤理化性质的测定。NH+4-N测定采用靛酚蓝比色法;NO-3-N测定采用镀铜镉还原-重氮化偶合比色法[22];全氮(STN)采用半微量凯氏法;有机碳(SOC)采用重铬酸钾外加热氧化法;土壤容重采用环刀法;土壤含水率采用烘干法(105℃,12 h);土壤pH值采用玻璃电极法(土水比为1∶2.5)[22]。测定结果均以土壤干重计算。
1.4 数据处理与分析
土壤氮素矿化速率和植被氮素吸收速率,参考Wei[23]和Katrin[24]等人的方法:
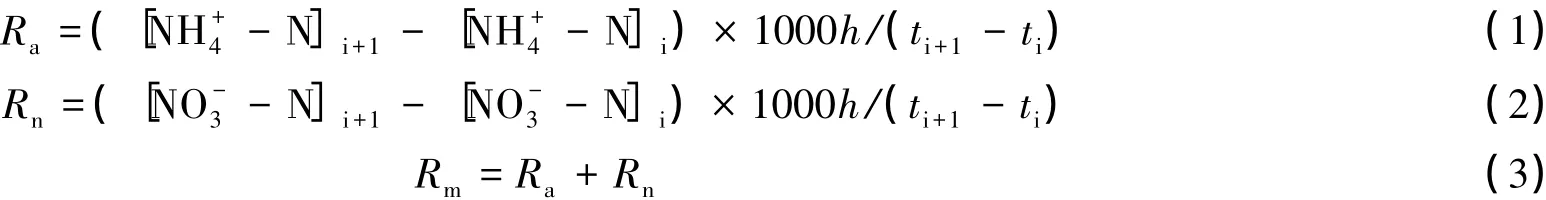
式中,Ra、Rn、Rm分别代表土壤氨化速率、硝化速率和矿化速率(mg·m-·2d-1);[NH+4-N]i、[NH+4-N]i+1分别代表培养前后NH+4-N 含量(mg/kg);[NO-3-N]i、[NO-3-N]i+1分别代表培养前后 NO-3-N 含量(mg/kg)。1000 为单位转换系数,h代表土层厚度0.15 m,ti、ti+1分别表示各培养期开始与结束时间(d)。

式中,Ruap、Runp、Rump分别代表森林植物对土壤NH+4-N、NO-3-N和无机氮的吸收速率(mg·m-·2d-1),[NH+4-N]in、[NH+4-N]out分别代表培养后管内与管外NH+4-N 的含量(mg/kg);[NO-3-N]in、[NO-3-N]out分别代表培养后管内与管外NO-3-N 的含量(mg/kg);h、ti、ti+1同上。
根据土壤氮素含量、土壤容重和培养时间,可分别计算出不同时间土壤氮库(kg/hm2)、任意培养期内氮素净矿化量和植被吸收量(kg/hm2)。
同时,采用费歇尔(R.A.Fisher)最小显著差异法(LSD)分析不同森林间土壤无机氮(NH+4-N、NO-3-N)、净矿化(氨化、硝化)速率、氮素吸收速率等差异性。上述计算、分析与图形制作,采用Excel 2010,SPSS 15和Matlab 7.5软件完成。
2 结果与分析
2.1 土壤基本性质及细根生物量
不同森林表层土壤全氮(STN)含量、有机质(SOM)、C/N、细根生物量及死细根储量差异较大(表2),但pH值与容重差异不大。马尾松林、杉木林和马褂木林土壤全氮含量都比常绿阔叶林高。马尾松林土壤有机质含量最高,其次是杉木林,最低是常绿阔叶林和马褂木林。常绿阔叶林与马尾松林细根生物量及死细根储量都较高,杉木林、马褂木林较低。说明常绿阔叶林转换成马尾松林和杉木、马褂木人工林后,土壤基本性质与地下细根量会发生不同程度的变化[21]。

表2 不同森林土壤基本性质及细根生物量Table 2 General soil properties and fine root biomass(0—15 cm in depth)of 4 forests
2.2 土壤无机氮库季节动态
不同森林土壤无机氮库呈现的季节动态趋势相同,但大小差异较大(图1)。NH+4-N库冬春季节较大11.64—15.55 kg/hm2,夏秋季节较小3.89—8.36 kg/hm2,相反 NO-3-N 库是夏秋较大 0.42—8.60 kg/hm2,冬春较小0.24—6.10 kg/hm2。NH+4-N库明显大于NO-3-N 库,NH+4-N是赣中亚热带各种森林土壤无机氮库的主体。从年均NH+4-N库来看,马尾松林与常绿阔叶林相似(10.70—11.08 kg/hm2),且明显高于杉木和马褂木林(8.58—7.68 kg/hm2),但杉木林、马褂木林土壤NO-3-N库(3.37—5.20 kg/hm2)明显大于常绿阔叶林和马尾松林(1.44—1.46 kg/hm2),且杉木林、马褂木占总无机氮库比例分别达37.37%和33.39%,夏季更高达54.21%和54.37%。这说明封山育林可保持森林土壤无机氮库,人工造林会增加土壤NO-3-N 含量,从而增加了氮素流失的危险性[25]。
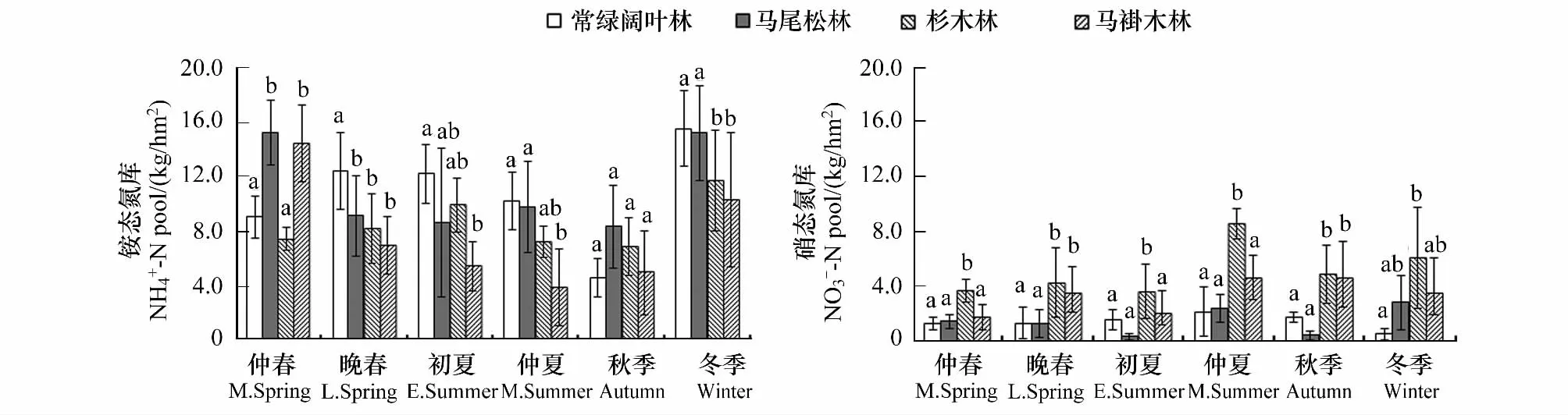
图1 不同森林土壤无机氮库大小及季节动态Fig.1 Seasonal dynamics of soil inorganic N pools of 4 forests
2.3 土壤氮素矿化速率季节动态
不同森林土壤氮素矿化动态趋势相同,但速率大小差异较大(图2,表3)。4种森林土壤氨化速率与硝化速率基本上都是夏秋最高,达5.08—42.79 mg·m-·2d-1,冬春较低,仅为-2.54—11.14 mg·m-·2d-1。硝化速率普遍高于氨化速率,夏季可达12.99—73.40 mg·m-·2d-1,冬季为15.97—18.41 mg·m-·2d-1。常绿阔叶林转成马尾松林、杉木林、马褂木林后,年均氨化速率下降了110.67%、100.76%、96.20%,但硝化速率增长了115.84%、61.06%、44.42%,尤其是在高温多雨的夏季,硝化速率分别高出3—6倍。究其原因可能是马尾松林、杉木林和马褂木林对NH+4-N吸收较少,因而就有更多的NH+4-N参与硝化过程[11],再加上马尾松林、杉木林和马褂木的郁闭度较低(表1),夏季林下土壤可接受到更多的热量和水分,从而增加了氮素的硝化作用[8]。

表3 林型和季节对土壤净氨化、硝化和矿化速率的影响Table 3 Effects of forest and period on soil net ammonification,nitrification and N-mineralization rates
2.4 土壤氮素供给与植被吸收
不同森林土壤氮素年矿化供给量和植被吸收量差异较大(表4)。常绿阔叶林、马尾松林、杉木林、马褂木林年无机氮供给量分别为118.94、111.85、89.58、88.00 kg·hm-2·a-1,而植被无机氮吸收量为93.89、137.83、92.76、99.28 kg·hm-2·a-1。可见,除常绿阔叶林外,马尾松林、杉木林与马褂木林净矿化量都小于吸收量。氮素会成为马尾松林、杉木林与马褂木林生长发育的限制因子。
另外,常绿阔叶林转换成其它森林时,氮素周转速率(矿化氮量与全氮量的比例)会不同程度下降,尤其是马褂木林下降最大,达55.06%。这样会造成土壤总N积累,有效氮供应不足。
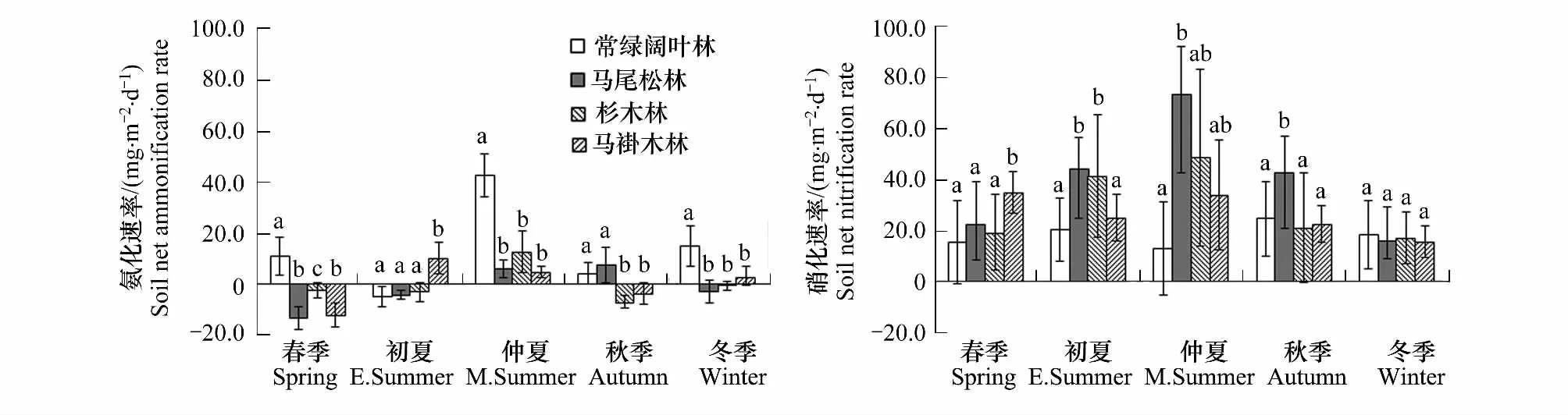
图2 不同森林土壤氮素矿化速率及季节动态Fig.2 Seasonal dynamics of soil N mineralization of 4 forests
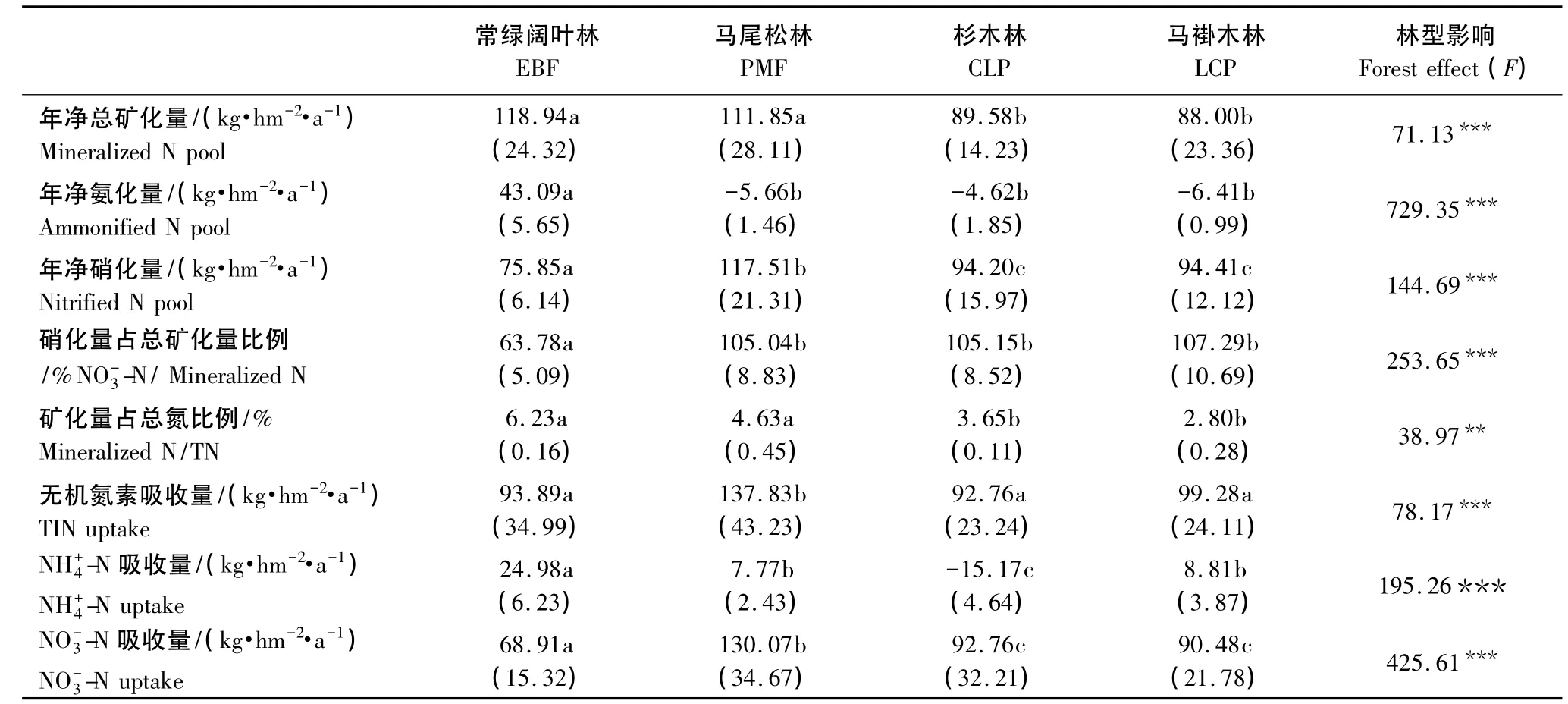
表4 土壤氮素年净矿化量与植被吸收量Table 4 Annual soil N mineralization and uptake of 4 forests in subtropical region
3 讨论
3.1 森林类型转换对土壤氮素矿化作用的影响
土壤氮素矿化作用通常可以指示氮素有效性,净氮矿化量大说明氮素有效性高[26]。森林类型转换或经营方式改变,会强烈地影响到土壤氮素矿化速率及其有效性大小[7]。一般情况下,由原生林转换成次生林,矿化作用会减弱,但对次生林采取有效保护或恢复措施,则会提高其土壤氮素有效性[13,17]。本研究结果显示,亚热带常绿阔叶林转换成杉木、马褂木人工林后,土壤氮素矿化方式发生明显改变,其氨化作用减弱,硝化作用增强,但其年净矿化量显著降低(图2,表4)。本文研究结果与我国西双版纳季雨林和季风常绿阔叶林转成橡胶林,土壤氮矿化速率显著降低的现象相似[13],也与澳大利亚大叶南洋杉天然林转成南洋杉人工林时氮素矿化作用减弱的结果相同[7]。同时,经封山育林自然更新形成的马尾松天然林,虽矿化方式有所差异,但总矿化能力与常绿阔叶林相近,这与沙丽清[27]、李明锐等[13]对热带受损森林恢复研究结果相同。说明亚热带原生林转变成人工林时,会将低土壤氮素有效性,封山育林有利于土壤氮素有效性保持。
3.2 森林类型转换对土壤氮库及氮素供求关系的影响
土壤无机氮库包括NH+4-N 和 NO-3-N库,它们的大小决定于输入与输出两个过程。氮输入主要有氮素矿化、大气氮沉降和生物固氮,输出过程主要有植物吸收、微生物固持、淋溶和反硝化作用[6,24,28],但在工业不发达地区,森林土壤无机氮库大小主要还是取决于氮素矿化与植物吸收两个过程[29]。本文4种森林无机氮库与矿化速率和植被吸收速率密切相关(图3)。从春季到夏季,土壤氮素氨化速率小于森林植被对NH+4-N 的吸收速率,NH+4-N库逐渐减小;由夏季到冬季,氨化速率大于NH+4-N 吸收速率,NH+4-N库逐渐增大(图3)。同样,从春季到夏季,硝化速率稍大于森林植被对NO-3-N 的吸收速率,NO-3-N库增大,由夏季到冬季,硝化速率小于NO-3-N 吸收速率,NO-3-N库减小,但氮素硝化速率与NO-3-N吸收速率变化趋势一致,所以总体上NO-3-N库变化不及NH+4-N库剧烈(图3)。这说明赣中亚热带森林土壤无机氮库的季节变化主要由土壤氮素矿化与植物吸收共同决定,而不是单由土壤氮素矿化供应所引起的。同时,森林转换前后所有植被对NO-3-N 偏向性吸收,所以尽管各森林土壤硝化作用较大,但无机氮库却以NH+4-N占主体,这一研究结果与美国北部的草地和针叶林相似[30]。本研究发现常绿阔叶林土壤氮素供给量大于植被吸收量,而马尾松、杉木林、马褂木林土壤氮素供应满足不了植被吸收需求。氮素缺乏可能成为这些次生林的重要限制因子。

图3 土壤无机氮库与矿化速率、吸收速率的相互关系Fig.3 The relationship of nitrogen mineralization rates,uptake rates and inorganic nitrogen pools in subtropical forests
3.3 土壤氮素矿化作用的影响因子
土壤氮素矿化过程与细根分解、植被对无机氮的吸收等因素密切相关[31]。本研究发现死细根储量与氮素矿化速率呈显著正相关关系,而且细根生物量与无机氮吸收量也呈明显的正相关关系(图4),这说明细根在森林生态系统养分转化过程中具有重要作用[32-33]。森林类型转换和经营方式会改变细根生物量与周转速率,从而影响土壤氮素转化过程及季节性变化[34]。常绿阔叶林、马尾松林的死细根储量与细根生物量都大于杉木林和马褂木林(表2),所以其氮素净矿化速率与吸收量也都相应较大(表4)。

图4 森林土壤氮素矿化、吸收速率与细根的关系Fig.4 The Relationship of N mineralization,uptake rate and fine root biomass for subtropical forests
同时,本研究还发现土壤氮素硝化作用与NH+4-N含量呈显著正相关关系,而与植被NH+4-N 吸收速率呈显著负相关关系(图5)。常绿阔叶林转换为马尾松林、杉木林和马褂木林后,植被对NH+4-N 吸收量较少(表4),结果就有更多的NH+4-N参与硝化过程,从而提高硝化速率(图2),结果导致NO-3-N库明显增大,尤其是在夏季(图1)。如果此时NO-3-N不能及时被植被吸收或微生物固持,就会大大增加了这些次生林氮素流失的危险性[35]。

图5 硝化速率与NH+4-N含量、植被吸收速率的关系Fig.5 Relationships of soil nitrogen nitrification rate with NH+4-N content and NH+4-N uptake rate
3.4 本研究在全球森林土壤氮素矿化研究中的地位
一般来说,温暖湿润的气候有利于参与矿化作用的微生物的生存和繁殖,其土壤矿化速率要明显高于寒冷干燥气候[8]。因此,从全球尺度看,森林土壤氮素矿化速率与纬度密切相关,随纬度升高,森林氮素矿化速率呈逐渐降低趋势(图6),且在中低纬度同一地区,阔叶林>针叶林,天然林>人工林(图6)。本文试验地处北纬27°亚热带地区,与世界其它地区森林的土壤矿化作用相比较,阔叶林、天然林氮净矿化速率稍偏低,而针叶林、人工林稍有偏高,但不同森林类型土壤年矿化量均在热带、亚热带森林土壤氮素年均矿化量范围内(54.0—222.0 kg·hm-2·a-1)[17,31]。本文研究结果符合全球森林土壤氮素矿化速率的分布规律,为全球森林土壤氮素矿化研究提供了有效的补充。
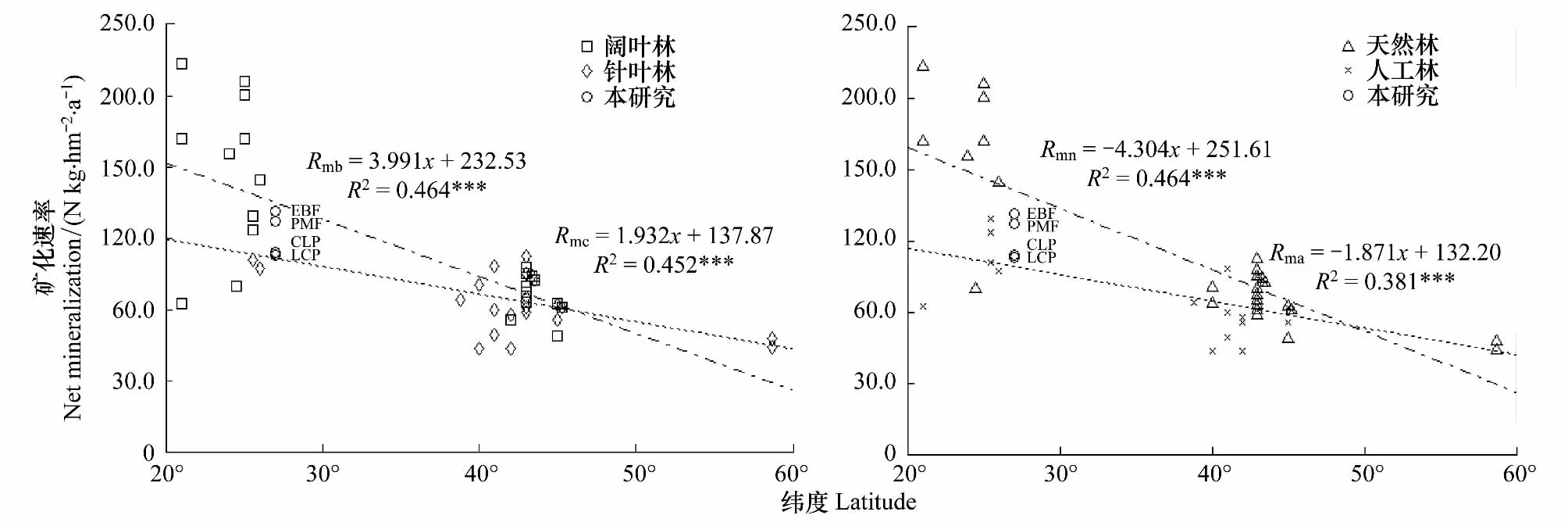
图6 不同森林土壤年净矿化速率与纬度的关系Fig.6 The relationship between forest soil N mineraliztion and latitude
当然,本研究暂未考虑微生物-土壤-植物系统之间的反馈调节作用[36]。大气氮沉降、淋溶、反硝化作用对土壤氮库有着重要影响[37-39],在今后研究土壤氮矿化和森林转换的关系时应该进行测定评估,才能更加准确和完整地反映森林转换对氮素矿化的影响。
4 结论
1)赣中亚热带地区森林土壤无机氮库和矿化速率都具有明显的季节动态。NH+4-N是无机氮存在的主体形式,冬春较大,夏秋较小,而NO-3-N库冬春较低,夏秋较大;土壤氮素矿化速率冬春低而夏秋较高,且硝化作用在各森林土壤氮素矿化过程中占主导。
2)森林转换对土壤氮素矿化作用造成不同程度的影响。常绿阔叶林转换成马尾松林,土壤氮素年均净矿化速率基本近似,而转换成杉木、马褂木人工林后,土壤氮素年均净矿化速率分别减少了24.68%和26.01%,但所有转换后的森林土壤硝化速率都有所提高,土壤NO-3-N含量增大,增加了氮素流失的危险性。
3)除常绿阔叶林外,马尾松林、杉木林、马褂木林土壤氮素净矿化量均小于吸收量,氮素缺乏可能成为这些森林的限制因子。因此,合理施肥才能保证这些森林的生产力。
总之,常绿阔叶林土壤氮矿化及有效性水平较高,封山育林有助于保持土壤氮素供应水平,而人工造林会降低土壤氮素矿化作用,也不利于土壤无机氮库维持。因此,为促进亚热带地区氮素生物化学循环和可持续发展,必须保护常绿阔叶林,同时加强封山育林促进森林天然更新。
[1]Kastner T,Erb K H,Nonhebel S.International wood trade and forest change:a global analysis.Global Environmental Change,2011,21(3):947-956.
[2]Kuuluvainen T.Forest management and biodiversity conservation based on natural ecosystem dynamics in northern Europe:the complexity challenge.AMBIO:A Journal of the Human Environment,2009,38(6):309-315.
[3]Department of Forest Resources Management,SFA.China's forest resources status and dynamic change-based on analysis of the seventh national forest resource inventory results.Forestry Economics,2010,(2):66-72.
[4]LeBauer D S,Treseder K K.Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed.Ecology,2008,89(2):371-379.
[5]Siddique I,Vieira I C,Schmidt S,Lamb D,Carvalho C J,Figueiredo R O,Blomberg S,Davidson E A.Nitrogen and phosphorus additions negatively affect tree species diversity in tropical forest regrowth trajectories.Ecology,2010,91(7):2121-2131.
[6]Gundersen P,Callesen I,de Vries W.Nitrate leaching in forest ecosystems is related to forest floor C/N ratios.Environmental Pollution,1998,102(Supplement 1):403-407.
[7]Xu Z H,Ward S,Chen C R,Blumfield T,Prasolova N,Liu,J X.Soil carbon and nutrient pools,microbial properties and gross nitrogen transformations in adjacent natural forest and hoop pine plantations of subtropical Australia.Journal of Soils and Sediments,2008,8(2):99-105.
[8]Su B,Han X G,Qu CM,Huang JH.Net nitrogen mineralization and nitrification in one pure pine(Pinustabulaeformis)forest and one pine-oak mixed forest in Dongling mountainous region.Acta Phytoecologica,2001,25(2):195-203.
[9]Zhong Z K,Makeschin F.Comparison of soil nitrogen dynamics under beech,Norway spruce and Scots pine in central Germany.European Journal of Forest Research,2004,123(1):29-37.
[10]Fu M J,Wang C K,Wang Y,Liu S.Temporal and spatial patterns of soil nitrogen mineralization and nitrification in four temperate forests.Acta Ecologica Sinica,2009,29(7):3747-3758.
[11]Montagnini F,Buschbacher R.Nitrification rates in two undisturbed tropical rain forests and three slash-and-burn sites of the Venezuelan Amazon.Biotropica,1989,21(1):9-14.
[12]Corre M D,Dechert G,Veldkamp E.Soil nitrogen cycling following montane forest conversion in central Sulawesi,Indonesia.Soil Science Society of America Journal,2006,70(2):359-366.
[13]Li M R,Sha L Q.Soil nitrogen mineralization under different landuse patterns in Xishuangbanna.Chinese Journal of Applied Ecology,2005,16(1):54-58.
[14]Wang F M,Zhu W X,Xia H P,Fu SL,Li ZA.Nitrogen mineralization and leaching in the early stages of a subtropical reforestation in Southern China.Restoration Ecology,2010,18(S2):313-322.
[15]Wang C T,Long R J,Wang Q L,Liu W,Jing Z C,Zhang L.Fertilization and litter effects on the functional group biomass,species diversity of plants,microbial biomass,and enzyme activity of two alpine meadow communities.Plant and Soil,2010,331(1/2):377-389.
[16]Goodale C L,Aber JD.The long-term effects of land-use history on nitrogen cycling in northern hardwood forests.Ecological Applications,2001,11(1):253-267.
[17]Yan E R,Wang X H,Huang JJ,Li G Y,Zhou W.Decline of soil nitrogen mineralization and nitrification during forest conversion of evergreen broad-leaved forest to plantations in the subtropical area of Eastern China.Biogeochemistry,2008,89(2):239-251.
[18]Editorial Committee of Forests of Jiangxi.Forests of Jiangxi.Beijing:China Forestry Publishing House;Nanchang:Jiangxi Science and Technology Publishing House,1986.
[19]Jiangxi Provincial Forestry Administration.Ten highlights of jiangxi forestry in“11th-Five Year Plan”period.Jiangxi Forestry Science and Technology,2011,(2):3-4.
[20]Wang B,Li H J,Guo Q S.Studies on Biodiversity of Forest in Dagangshan Mountain,Jiangxi Province.Beijing:China Forestry Publishing House,2005.
[21]Wang X Q,Dai W,Xia L F,Dong Z F,Yu H X,Nie L S.Effects of different subtropical plantations on physical and chemical properties of soil.Journal of Beijing Forestry University,2006,28(6):56-59.
[22]Lu R K.Method of Soil Agricultural Chemical Analysis.Beijing:China Agricultural Science and Technology Press,2000.
[23]Wei X R,Shao M A,Fu X L,Ågren G I,Yin X Q.The effects of land use on soil N mineralization during the growing season on the northern Loess Plateau of China.Geoderma 2011,160(3/4):590-598.
[24]Pajuste K,Frey J.Nitrogen mineralisation in podzol soils under boreal Scots pine and Norway spruce stands.Plant and Soil,2003,257(1):237-247.
[25]Su B,Han X G,Qu CM,Li G C.Factors affecting soil N availability in forest ecosystems:A literature review.Chinese Journal of Ecology,2002,21(2):40-46.
[26]Binkley D,Hart SC.The components of nitrogen availability assessments in forest soils.Advances in Soil Science,1989,10:57-112.
[27]Sha L Q,Meng Y,Feng Z L,Zheng Z,Cao L,Liu H M.Nitrification and net N mineralization rate of soils under different tropical forests in Xishuanbanna,Southwest China.Acta Phytoecologica Sinica,2000,24(2):152-156.
[28]Xiong Z Q,Huang TQ,Ma Y C,Xing GX,Zhu Z L.Nitrateand ammonium leaching in variable-and permanent-charge paddy soils.Pedosphere an International Journal,2010,20(2):209-216.
[29]Cui X Y.The Northeast Forest Nitrogen Nutrition Ecology:Soil Environment,Tree Behavior and Nitrogen Nutrient Niche.Harbin:Northeast Forestry University Press,1998.
[30]McKinley D C,Rice C W,Blair J M.Conversion of grassland to coniferous woodland has limited effects on soil nitrogen cycle processes.Soil Biology and Biochemistry,2008,40(10):2627-2633.
[31]Meng Y,Xue J Y,Sha L Q,Tang J W.Variations of soil NH+4-N,NO-3-N and N mineralization under different forests in Xishuangbanna,southwest China.Acta Phytoecologica Sinica,2001,25(1):99-104.
[32]Lin C F,Yang Y S,Guo JF,Chen G S,Xie JS.Fine root decomposition of evergreen broadleaved and coniferous tree species in mid-subtropical China:dynamics of dry mass,nutrient and organic fractions.Plant and Soil,2010,338(1/2):311-327.
[33]Majdi H,Andersson P.Fine root production and turnover in a norway spruce stand in northern Sweden:effects of nitrogen and water manipulation.Ecosystems,2005,8(2):191-199.
[34]Zhu W X,Carreiro M M.Temporal and spatial variations in nitrogen transformations in deciduous forest ecosystems along an urban-rural gradient.Soil Biology and Biochemistry,2004,36(2):267-278.
[35]Piccolo M C,Neill C,Cerri CC.Net nitrogen mineralization and net nitrification along a tropical forest-to-pasture chronosequence.Plant and Soil,1994,162(1):61-70.
[36]Ehrenfeld J G,Ravit B,Elgersma K.Feedback in the plant-soil system.Annual Review of Environment and Resources,2005,30(1):75-115.
[37]Jost G,Dirnböck T,Grabner M T,Mirtl M.Nitrogen leaching of two forest ecosystems in a Karst Watershed.Water,Air and Soil Pollution,2011,218(1/4):633-649.
[38]Vanitchung S,Conrad R,Harvey NW,Chidthaisong A.Fluxes and production pathways of nitrous oxide in different types of tropical forest soils in Thailand.Soil Science and Plant Nutrition,2011,57(5):650-658.
[39]Fang Y T,Gundersen P,Vogt R D,Koba K,Chen F S,Chen X Y,Yoh M.Atmospheric deposition and leaching of nitrogen in Chinese forest ecosystems.Journal of Forest Research,2011,16(5):341-350.
参考文献:
[3]国家林业局森林资源管理司.中国森林资源第七次清查结果及其分析.林业经济,2010,(2):66-72.
[8]苏波,韩兴国,渠春梅,黄建辉.东灵山油松纯林和油松-辽东栎针阔混交林土壤氮素矿化/硝化作用研究.植物生态学报,2001,25(2):195-203.
[10]傅民杰,王传宽,王颖,刘实.四种温带森林土壤氮矿化与硝化时空格局.生态学报,2009,29(7):3747-3758.
[13]李明锐,沙丽清.西双版纳不同土地利用方式下土壤氮矿化作用研究.应用生态学报,2005,16(1):54-58.
[18]江西森林编委会.江西森林.南昌:江西科技出版社,北京:中国林业出版社,1986.
[19]江西省林业厅办公室.“十一五”江西林业十大亮点.江西林业科技,2011,(2):3-4.
[20]王兵,李海静,郭泉水.江西大岗山森林生物多样性研究.北京:中国林业出版社,2005.
[21]王旭琴,戴伟,夏良放,邓宗付,于海霞,聂立水.亚热带不同人工林土壤理化性质的研究.北京林业大学学报,2006,28(6):56-59.
[22]鲁如坤.土壤农业化学分析方法.北京:中国农业科技出版社,2000.
[25]苏波,韩兴国,渠春梅,李贵才.森林土壤氮素可利用性的影响因素研究综述.生态学杂志,2002,21(2):40-46.
[27]沙丽清,孟盈,冯志立,郑征,曹敏,刘宏茂.西双版纳不同热带森林土壤氮矿化和硝化作用研究.植物生态学报,2000,24(2):152-156.
[29]崔晓阳.东北森林氮素营养的生态学:土壤环境、树种行为及氮营养生态位.哈尔滨:东北林业大学出版社,1998.
[31]孟盈,薛敬意,沙丽清,唐建维.西双版纳不同热带森林下土壤铵态氮和硝态氮动态研究.植物生态学报,2001,25(1):99-104.
