太湖新银鱼线粒体Cytb基因PCR扩增条件的优化
2013-12-19王维维位晓三
王维维,赵 亮,位晓三
宿州学院化学与生命科学学院,安徽宿州,234000
太湖新银鱼(NeosalanxtaihuensisChen)又名太湖短吻银鱼,中国特有种[1],隶属银鱼科(Salangidae)新银鱼属(Neosalanx),是我国重要的经济鱼类[2]。
近年来,太湖新银鱼资源量大量下降,大多数银鱼的原产地已失去渔业价值,因此银鱼科鱼类资源亟待加以保护[3]。太湖新银鱼线粒体Cytb基因的研究对于研究银鱼种群的遗传多样性、遗传结构及种群历史动态等方面具有重要的意义。太湖新银鱼Cytb基因为线粒体基因组中进化较快的片段,具有分子量小、分子结构简单、母系遗传和进化速度快等特点,尤其是线粒体所编码的Cytb基因,被认为是探讨系统进化和分类研究的良好指标,有较强的适用性,已在多种动物类群的系统发育中得到了有效的应用[4-6]。本文采用正交设计实验,对太湖新银鱼线粒体Cytb基因扩增的条件进行优化。采用正交实验设计,用较少的处理组合研究较多的实验因素,大量节约了实验时间。最终对结果进行方差分析,摸索出高效的太湖新银鱼线粒体Cytb基因PCR扩增条件,可以为太湖新银鱼的进一步研究提供一定的技术基础,具有重要的理论和实践意义。
1 材料与方法
1.1 实验材料
实验样本为淮河流域太湖新银鱼个体,所采集的样本清洗后置于250 mL采样瓶中,加入适量的95%乙醇保存。
1.2 实验试剂
dNTPs、10×PCR buffer(15 pmol/μL Mg2+plus)、Taq DNA聚合酶均为北京全式金生物科技有限公司公司生产,DNA Marker(DL2000)为Takara公司产品,其余的化学试剂均为国产分析纯试剂。
1.3 仪器设备
凝胶成像系统Tanon(天能公司GIS-2008型)、台式高速冷冻离心机(SIGMA 1-15k型)、普通冰箱(格力)、微波炉(格兰仕)、PCR 扩增仪(TL-512)、电泳系统(BIO RAD伯乐公司 PAC300)、纯水仪(MICLIPORE Elix系列)、小型高速离心机(Hema TGL-16H,上海安亭TGL-16C)、高压灭菌锅(HIRAYA HVE-50)、恒温水浴锅(Grant GA100)。
1.4 实验方法
1.4.1 基因组DNA的提取
将100~300 mg太湖新银鱼背部肌肉剪碎后置入500~700 μL裂解缓冲液中,静置30 min,采用氯仿抽提法[7]进行DNA的提取。取4 μL总DNA产物,在120 V电压下电泳40 min。电泳结束后,在紫外投射分析仪下观察结果,并使用凝胶成像系统拍照。DNA样品置于-20℃中保存。
1.4.2 引物设计
用引物设计软件Oligo6自行设计太湖新银鱼线粒体Cytb基因扩增引物。经筛选获得有效扩增引物:前端扩增引物为L14321,即5′-CAGTGACTTG AAAAACCACCG-3′,后端扩增引物为H15634,即5′-CTTAGCTTTGGGAGTTAAGGG-3′。
1.4.3 PCR扩增
采用五因素四水平正交实验[8]设定不同的扩增条件,观察体系中引物浓度、Taq酶浓度、dNTPs浓度、基因组模板浓度、退火温度对扩增结果的影响,选择最佳的PCR扩增条件。扩增条件的正交设计方案如表1,每个方案重复3次,反应扩增程序为:94℃预变性5 min,30个循环每个循环包括94℃变性30 s,不同退火温度退火60 s,72℃延伸2 min,72℃延伸5 min,将PCR产物置于4℃冰箱中保存。

表1 PCR扩增条件正交设计表L16(45)
1.4.4 PCR产物电泳检测
取PCR扩增产物,在1%琼脂糖凝胶上电泳,DL2000 Marker作为标准。在紫外投射分析仪下观察扩增结果,并使用凝胶成像系统拍照备份。检测不同扩增条件下扩增出的条带形状及亮度,采用直观分析法对扩增结果进行评分。
2 结果与分析
2.1 DNA电泳结果
将基因组DNA的提取产物经含0.05% green Ⅰ的1%琼脂糖凝胶电泳在凝胶成像仪上观察,只选取重复性好、电泳清晰的谱带用于PCR。经过分析,第六条带结果最好,如图1,M为DL2000 Marker Plus Ⅱ。

图1 基因组电泳结果
2.2 PCR扩增结果
按照正交设计方案设定的16个处理组合进行PCR扩增,将产物电泳的结果,参照何正文等的正交直观分析[8]方法,将条带最亮、带形规则的扩增结果计为10分,未扩增出结果或出现多条扩增条带的非特异性结果计为1分,其他条带根据条带的强弱和杂带的多少分别打分,结果如下,第1次重复的分值为1~16:5,10,8,2,3,7,6,3,8,4,1,1,6,9,1,1;第2次重复的分值为1~16:4,10,7,3,5,7,5,4,8,8,1,1,7,8,1,1;第3次重复的分值为1~16:5,10,8,3,3,6,5,3,8,4,1,1,7,9,1,2。3次重复结果相差较小,趋于一致,图2为第1次重复的电泳结果图,1~16泳道分别代表相应的处理组合,M表示DL-2000 Marker。16个处理组合的记分结果如上。
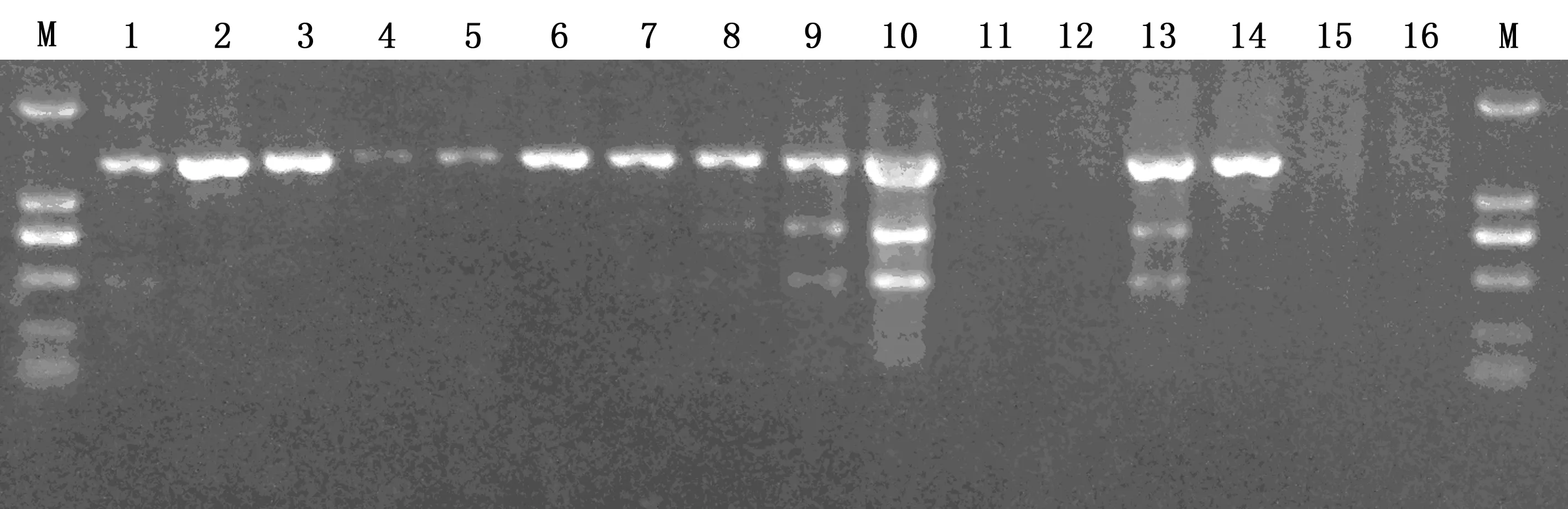
图2 PCR产物电泳结果
2.3 方差分析
将评分结果用正交设计助手[9]软件进行方差分析,结果如表2和图3效应曲线图,F比与临界值比较可知:dNTPs浓度对扩增结果影响最大,达极显著水平;Taq酶浓度对扩增结果影响最小,不显著;退火温度、引物浓度对扩增结果也存在影响,达显著水平。在一定浓度范围内,随dNTPs浓度增加,扩增条带亮度增加,但高于一定浓度后,条带亮度降低。退火温度过高,条带特异性强,但亮度较弱,退火温度过低,非特异性反应增强,这可能是因为退火温度低,单引物随机扩增增强,退火温度过高,引物与模板结合差,PCR扩增产物丰度下降。扩增条带亮度受体系中模板浓度影响较小,这可能是因为条带亮度主要受PCR扩增产物富集影响,在低于阀值的范围内,产物亮度与循环数成正比,在适宜的模板浓度范围内,高模板浓度与低模板浓度效果一致。
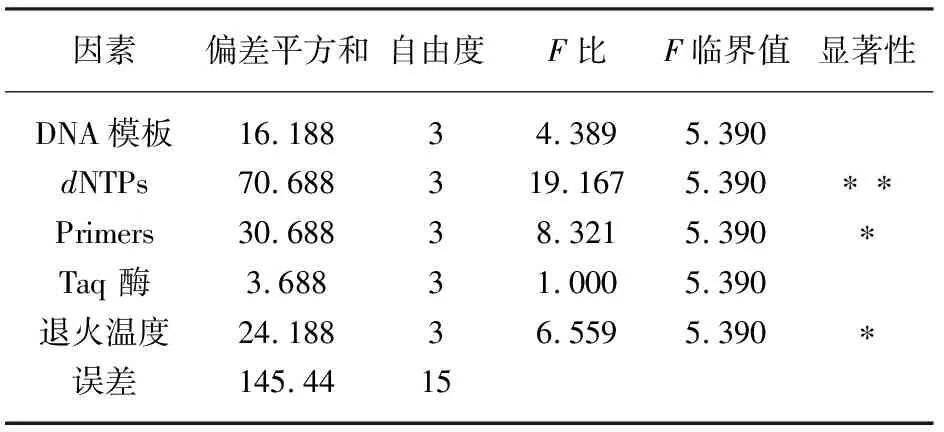
表2 方差分析表

图3 效应曲线图
3 结 论
本实验研究了Taq酶浓度、退火温度、引物浓度、dNTPs浓度和模板浓度对PCR扩增结果的影响,结果表明:引物浓度、退火温度对实验结果的影响较大,达显著水平;模板浓度、Taq酶浓度对实验结果的影响较小,不显著;dNTPs浓度是影响PCR反应最显著的因素,dNTPs浓度过高可能会产生错误掺入,而浓度过低会降低产量,反复冻融使之活性降低,甚至出现假阴性结果,本试验最佳浓度为2.5 mmol/L。
本文摸索出了适合太湖新银鱼线粒体Cytb基因的最优反应体系,即25 μL的反应体系中,在退火温度为50℃、引物浓度为0.5 umol/L、Taq酶浓度为2.5 U/μL、模板浓度为5 ng/μL、dNTPs浓度为2.5 mmol/L的条件下,太湖新银鱼线粒体Cytb基因扩增效果为最佳,电泳条带清晰、规则。此结果对进一步研究太湖新银鱼种群的遗传多样性、遗传结构及种群历史动态等方面具有重要的意义。
参考文献:
[1]XIE Yu-hao,XIE Han.Classification,Distribution,and Popu-lation Ecology Salangdae Fishes[J].Chinese Journal of Fish-eries,1997,10(2):11-19
[2]ZHANG Yu-ling.A Taxonomic Study on the Chinese Icefishes of the GenusNeo salanx(Pisces:Salangidae) with Description of a New Species form the Lake Taihu[J].Zoological Research,1987,8(3):227-286
[3]ZHAO Liang,XIE Ben-Gui,LIU Zhi-Jin,et al.Molecular Structure and DNA Substitution Rate of the Mitochondrial Control Region and Cytochrome b in Taihu Salangid,Neosalanx taihuensis[J].Chinese Journal of Zoology,2010,45(2):27-38
[4]Tanaka-Ueno T,Matsui M,Sato T,et al,Phylogenetic relationships of brown frogs with 24 chromosomes from Far East Russia and Hokkaido assessed by mitochondrial cytochromeb gene sequences[J].Zoo Sci,1998,15(1):289-294
[5]Briolay J,Galtier N,Brito RM,et al.Molecular phylogeny ofcyprinidae inferred from cytochrome b DNA sequences[J].Mol Phylogenet,1998,9(1):100-108
[7]张民照.总DNA的抽提及其PCR分析条件[J].动物学研究,2001,22(1):20-26
[8]何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404
[9]曾涛,宋国际.“正交设计助手”软件在银镜反应实验中的应用[J].化学教学,2005,5(5):50-51
