电解−强化微电解耦合法处理含铜废水
2013-12-18徐晓军杨津津高琨阳管堂珍王凯瑞
王 刚 ,徐晓军,杨津津,高琨阳,聂 蕊,李 鑫,管堂珍,王凯瑞
(1.昆明理工大学 环境科学与工程学院,昆明 650500;2.云南省城乡规划设计研究院,昆明 650228;3.云南瑞升烟草技术(集团)有限公司,昆明 650106)
随着我国经济的快速发展,重金属污染形势日趋严峻,如2010年,我国就发生了14起重大重金属污染事件;2011年,又频繁发生诸如铜、铬、镉等重金属污染事件。重金属废水主要产生于冶金、矿山、电镀、化工、制革等行业[1],废水的直接排放一方面造成资源浪费,另一方面带来环境的持久性污染、危害性极大、严重影响饮用水安全[2−3],故对含重金属废水处理净化意义重大。含铜废水作为一种典型的含重金属废水,产生行业广泛,产量巨大,且铜回收价值较高[4],日益受到学者的关注,含铜废水的处理已成为一个新的研究热点。目前,含铜等重金属废水的处理技术主要有化学沉淀法、离子交换法、吸附法、电化学法等[5−6],而电化学法中的电解法和微电解法由于具有处理废水和回收资源双重功效备受学者关注[7]。如TIAN 等[8]采用电解法研究 Cu2+离子在不锈钢电极上的还原特性,ZHANG等[9]采用循环伏安法研究酸性环境中Cu2+离子的电沉积动力学行为,陈昊等[10]利用流化床电极处理低浓度硫酸铜废水,使出水达到了排放标准的要求,但电解法由于受金属电沉积还原电位和传质过程的影响,在处理含铜等重金属废水时,存在处理效率较低、处理时间较长、能耗较高等缺点,限制了其推广应用。微电解法自20世纪70年代前苏联科学家提出处理印染废水以来,该技术得到了广泛应用,RUAN等[11]采用微电解技术处理印染废水并研究其脱色机理,FAN等[12]利用铁炭微电解−生物法组合工艺处理了难生物降解的制药废水。近年来,微电解法又被应用于含铜等重金属废水的处理,金属离子在微电解颗粒阴极表面获得电子还原成单质,同时,反应产生的Fe2+和Fe3+可作为絮凝剂进行后絮凝沉淀反应,深度去除废水中残留的金属离子[13],JU等采用微电解−吸附共沉淀法处理含铜酸性废水,Cu2+去除率达99.1%[14],处理EDTA螯合铜离子废水时Cu2+去除率达98.2%[15],罗发生等[16]采用微电解法处理铜冶炼废水,Cu2+、Pb2+、Zn2+的去除率分别达到 95.6%、91.8%、70.9%。虽然微电解法处理含重金属废水时效果较好,但由于该法仅利用其自身腐蚀原电池电位来催化铜等金属离子阴极还原电沉积,催化能力有限,使得废水处理时间较长、处理效率偏低、金属还原率较低。而电场能促进溶质迁移扩散,改变溶质反应活性,降低反应活化能[17],故本文作者率先提出一种强化微电解法处理含重金属废水,并获得了国家专利[18−19]。该法的原理是通过引入直流电场作用于微电解填料上,降低金属还原反应活化能和反应过电位,进而提高微电解法的处理能力与效率。本论文以单一含铜模拟废水为研究对象,研究电解−强化微电解耦合法处理含铜废水的可行性,探讨外电场存在对铜离子还原行为影响,为进一步研究电解−强化微电解耦合法处理其它重金属废水提供理论依据与基础数据。
1 实验
1.1 实验材料
实验所用化学药剂硫酸铜、硫酸钠、硫酸、氢氧化钠等均为分析纯,购自国药集团化学试剂有限公司,其他实验材料为0.85~2 mm颗粒活性炭和1 mm厚石墨电极(国药集团化学试剂有限公司生产),铸铁屑(昆工金工实习基地生产)等。
实验所用仪器设备包括自制电解−强化微电解耦合装置、蠕动泵、真空泵、直流电源、CHI660D电化学工作站、AA240FS原子吸收光谱仪、S3400N扫描电子影微镜等。
1.2 实验装置
电解−强化微电解耦合法实验装置和工艺流程见图1,包括进水槽、蠕动泵、自制电解−强化微电解装置、出水槽和直流电源。其中自制电解−强化微电解装置是将填充微电解填料的内网槽置于外槽体中央,内网槽两侧设置石墨电极,石墨电极通直流电产生电场作用于电极中间的微电解填料,外槽体长、宽、高分别为10 cm、5 cm、12 cm(内部尺寸),内网槽长、宽、高为10 cm、2 cm、12 cm(外部尺寸)。

图1 电解−强化微电解耦合法工艺流程图Fig.1 Schematic diagram of electrolysis-microelectrolysis coupled method∶ 1— Flume; 2— Peristaltic pump; 3—Electrolysis-enhanced microelectrolysis equipment; 4—Flume;5—DC power supply
1.3 实验方法
铁屑先用20%热NaOH溶液浸泡24 h,去除表面油污,再用10%H2SO4浸泡1 h,去除表面氧化物,以活化铁屑;活性炭用模拟废水浸泡5 d以上,浸泡液每天更换1次,使活性炭吸附饱和,以消除其对水样的吸附作用;模拟废水采用分析纯硫酸铜配制成 100 mg/L的溶液,并添加0.1 mol/L的硫酸钠作为电解质。
进水槽中的模拟废水通过蠕动泵以特定的流量给入自制的电解−强化微电解耦合装置,废水在流动过程中经过电解和强化微电解作用后铜离子被还原成金属单质电沉积于阴极表面,处理出水自动进入出水槽,出水立即过滤加酸酸化,再借助原子吸收分光光度计测定残留铜离子浓度。
本实验采用模拟废水(ρ(Cu2+)=100 mg/L,c(Na2SO4)=0.1 mol/L,pH=4)作为沉积液,借助CHI660D电化学工作站采用循环伏安法研究不同外电场作用对 Cu2+电沉积还原电位的影响;借助 SEM观察有/无外电场作用活性炭表面沉积铜单质的形貌特征。
2 结果与分析
2.1 不同电压对Cu2+残留浓度的影响

图2 铁炭质量比为1∶1时模拟废水中不同电压对Cu2+残留浓度的影响Fig.2 Effect of voltage in simulated waste water on residual Cu2+ concentration at mass ratio of Fe to C of 1∶1
考察模拟废水(ρ(Cu2+)=100 mg/L,c(Na2SO4)=0.1 mol/L,pH=3)在铁炭质量比为1∶1的条件下不同电解电压对出水Cu2+残留浓度的影响,实验结果见图2。由图2可知,不同电压下Cu2+残留浓度随着反应时间的延长先快速下降,随后缓慢降低,最终趋于平缓。同时,在相同反应时间内,Cu2+残留浓度随着电压的升高而减低,当电压升至12 V时,残留浓度下降最快,浓度也最低,继续升高电压残留浓度反而升高。之所以随电压呈现上述变化规律,是由于电压的升高一方面促进了负电极上Cu2+的还原电沉积,另一方面增加的外电场使得微电解电沉积强化作用增强,更有利于Cu2+在阴极表面获得电子而被还原,而在13 V电压条件下,Cu2+的残留浓度反而上升是由于过高的电压加速了负电极的还原析氢反应,在负电极表面形成一层氢气薄膜从而阻碍了Cu2+在负极表面的得电子过程,进而导致Cu2+残留浓度的升高,故确定最佳反应电解电压为12 V。
2.2 不同pH对Cu2+残留浓度的影响
考察模拟废水(ρ(Cu2+)=100 mg/L,c(Na2SO4)=0.1 mol/L)在铁炭质量比为1∶1、电解电压为10 V条件下不同初始 pH对出水Cu2+残留浓度的影响,见图3。由图3可知,出水Cu2+残留浓度随着pH的升高迅速减低,当pH为4时,残留浓度最低,继续升高pH残留浓度则快速上升。之所以随pH呈现上述变化规律,是由于 pH过低时负电极和阴极上析氢反应严重,阻碍了Cu2+的阴极得电子还原过程,适当升高pH有利于铜单质的还原析出,而当pH升高到5时,Cu2+在偏中性的环境中形成稳定得铜离子水合物,铜离子水合物难以得到电子而被还原,同时过高的 pH降低了腐蚀原电池反应发生的剧烈程度,减少了电子的生成量,最终抑制了Cu2+还原反应的进行。故确定废水最佳pH为4。
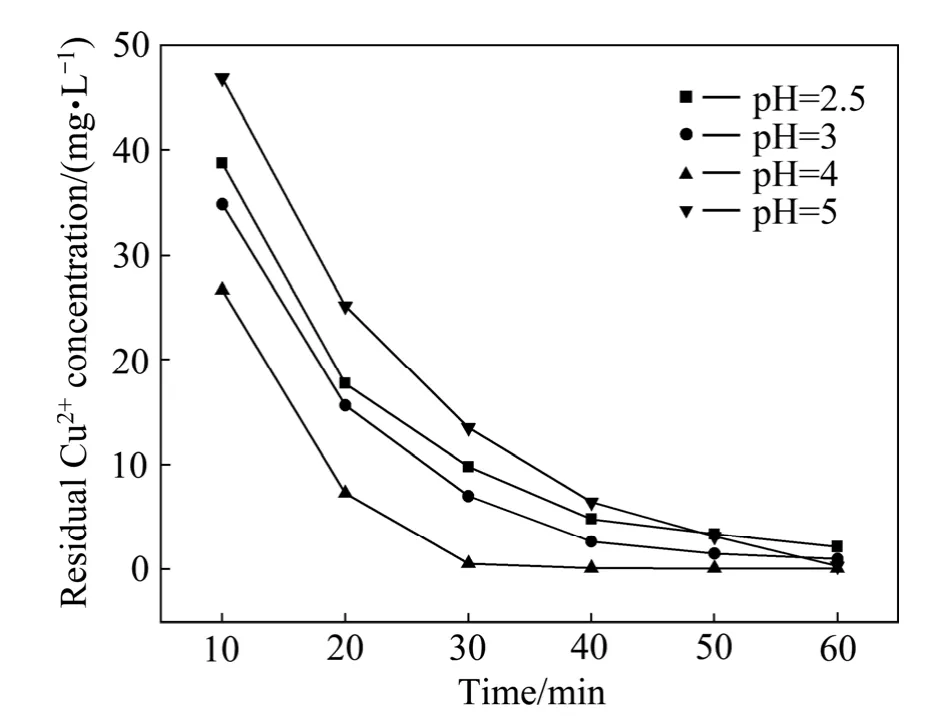
图3 铁炭质量比为1∶1、电解电压为10 V时模拟废水中不同pH值对Cu2+残留浓度的影响Fig.3 Effect of pH value in simulated cupric waste water on residual Cu2+ concentration at mass ratio of Fe to C of 1∶1 and electrolysis voltage of 10 V
2.3 不同铁炭比对Cu2+残留浓度的影响
考察模拟废水(ρ(Cu2+)=100 mg/L,c(Na2SO4)=0.1 mol/L,pH=4)在电解电压为10 V条件下不同铁炭质量比对出水Cu2+残留浓度的影响,实验结果见图4。由图4可知,出水Cu2+残留浓度随铁炭比的升高迅速减低,铁炭比越高残留浓度下降速度越快,当铁炭质量比为 3∶1时,反应时间仅 5 min,出水 Cu2+即达到 6 mg/L;反应时间10 min时,出水Cu2+仅0.18 mg/L。Cu2+残留浓度之所以随铁炭比呈现上述变化规律,是由于铸铁本身含碳量较高,自身即能构成微观原电池反应,增加原电池反应数量,在外电场的强化作用下,能腐蚀产生更多的电子以供Cu2+还原,故确定最佳铁炭质量比为 3∶1。

图4 电解电压为 10 V时模拟废水中不同铁炭质量比对Cu2+残留浓度的影响Fig.4 Effect of mass ratio of Fe to C in simulated wastewater on residual Cu2+ concentration at electrolysis voltage of 10 V
2.4 对比实验
在上述确定的最佳条件下处理模拟废水中(ρ(Cu2+)=100 mg/L,c(Na2SO4)=0.1 mol/L)电解−强化微电解耦合法、单独电解法、单独微电解法处理后出水Cu2+的残留浓度的对比如图5所示。由图5可知,在相同的反应时间内,电解−强化微电解耦合法相比单独电解法、单独微电解法Cu2+去除速率更快,出水残留浓度更低;反应达平衡时,单独电解法、单独微电解法Cu2+浓度分别为14.12 mg/L、4.195 mg/L,而电解−强化微电解耦合法Cu2+浓度仅为4 μg/L,远远低于两种传统工艺,故电解−强化微电解耦合法优于两种传统工艺,是一种金属离子高效还原去除的方法。
2.5 表面特征分析

图5 最佳实验条件下模拟废水中电解−强化微电解、单独电解和单独微电解Cu2+残留浓度的对比Fig.5 Comparison of electrolysis-enhanced microelectrolysis, electrolysis and microelectrolysis residual Cu2+concentration in simulated waste water under optimum experimental conditions
借助SEM观察电解−强化微电解耦合法和单独微电解法反应后活性炭表面铜晶体的形貌特征(见图6)。由图6可知,电镜放大在500倍时,电解−强化微电解耦合法活性炭表面铜晶体含量远高于单独微电解法,说明耦合法更有利于Cu2+在阴极活性炭表面获得电子而沉积;继续增加放大倍数到5 000倍和10 000倍时,对比两种方法发现,单独微电解所形成的晶体主要为大尺寸的块状晶体和棱锥晶体,大小可从几十微米到几百微米,而电解−强化微电解耦合法所形成的晶体更细小,以小颗粒晶体和小尺寸枝晶为主,枝晶大小在10 μm左右而小颗粒晶体属于纳米级别,铜晶体的细化是由于外电场的强化作用能提高微电解腐蚀原电池电位,使得反应生成了一个比标准原电池电位更大的过电位,过电位越大,越有利于晶体细化。
2.6 电化学性质分析
采用循环伏安法研究不同外电场强度对Cu2+电沉积还原电位的影响(见图7)。由图7可知,Cu2+阴极还原峰位随着外电场强度的增加而正移,外电场强度为0、2、4、6 V时,对应的Cu2+阴极还原峰(分别对应图中峰位 1、2、3、4)分别为 0.1、0.11、0.23和 0.54 V,当外电场强度较小时(0~2 V),峰位移动较小,继续增加外电场,强度峰位正移增加;当外电场强度为6 V时,还原峰峰位正移至0.54 V。金属还原峰正移表明,阴极上还原反应所需的过电位降低,且正移得越多,所需过电位越低,还原反应进行得越快越彻底,故实验中增加电解电压能获得更高的Cu2+还原反应速率与去除率。

图6 活性炭表面铜晶体的形貌Fig.6 Morphologies of copper crystal on surface of activated carbon∶ (a1), (a2), (a3)Electrolysis-enhanced microelectrolysis method; (b1), (b2), (b3)Microelectrolysis method

图7 不同外电场对还原电位的影响(扫描速度0.01 V/S)Fig.7 Effect of external electric field on reduction potential(scanning speed 0.01 V/S)
3 结论
1)电解−强化微电解耦合法处理含铜废水最佳工艺条件为:电解电压12 V,pH =4,铁炭质量比3∶1,该法相比单独微电解、单独电解能获得更高的铜离子去除速率和去除率,出水水质远优于两种传统方法单独使用的,说明电解−强化微电解耦合法是处理含铜离子废水的有效方法,有望进一步研究后在含重金属废水处理中得到广泛的应用。
2)外电场作用于微电解填料能强化腐蚀原电池反应的进行,使反应产生一个较大的过电位,促使铜结晶体细化,由粗大的块状、棱锥状晶体细化为枝晶和小颗粒晶体。
3)外电场作用于微电解填料能推动铜电沉积还原峰向正方向移动,削减反应所需活化能,降低反应过电位,最终加快反应进行。
[1]王云燕, 柴立元, 王庆伟, 舒余德.重金属离子(Zn2+, Cu2+,Cd2+, Pb2+)−水系羟合配离子配位平衡研究[J].中国有色金属学报, 2008, 18(1)∶ 183−191.WANG Yun-yan, CHAI Li-yuan, WANG Qing-wei, SHU Yu-de.Thermodynamic equilibrium of hydroxyl complex ions in heavy metals (Zn2+, Cu2+, Cd2+, Pb2+)-H2O system[J].The Chinese Journal of Nonferrous Metals, 2008, 18(1)∶ 183−191.
[2]STOICA A I.Analytical studies on the pollution of Arges river[J].Critical Reviews in Analytical Chemistry, 1999, 29(3)∶ 243−247.[3]COTMAN M, SLOVENIAZ K J, DROLC A.Study of impacts of treated wastewater to Krka river[J].Water Science and Technology, 200l, 44(6)∶ 47−54.
[4]EVINA K, SIMOS M, KATHERINE J H.Industrial wastewater pre-treatment for heavy metal reduction by employing a sorbent-assisted ultrafiltration system[J].Chemosphere, 2011,82(4)∶ 557−564.
[5]刘振海, 王 鹏, 姜洪泉, 陈志传.铜镍电镀退镀废液资源化处理工艺[J].环境科学, 2002, 23(2)∶ 113−116.LIU Zhen-hai, WANG Peng, JIANG Hong-quan, CHEN Zhi-chuan.Recovery process of nitric acid, copper and nickel in deplating wastewater[J].Environmental Science, 2002, 23(2)∶113−116.
[6]郑雅杰, 彭映林, 李长虹.二段中和法处理酸性矿山废水[J].中南大学学报∶ 自然科学版, 2011, 42(5)∶ 1215−1219.ZHENG Ya-jie, PENG Ying-lin, LI Chang-hong.Treatment of acid mine drainage by two-step neutralization[J].Journal of Central South University∶ Science and Technology, 2011, 42(5)∶1215−1219.
[7]MICHALIS K, ATHANASIOS K, CONSTANTINI S.Occurrence and fate of heavy metals in the wastewater treatment process[J].Chemosphere, 2003, 53∶ 1201−1210.
[8]TIAN Ying, LI Zhe-qi, XUA Hong-feng, YANG Feng-lin.Comparison on electro-reduction of Cu(Ⅱ)using polypyrrole and stainless steel electrodes[J].Separation and Purification Technology, 2008, 63∶ 334−340.
[9]ZHANG Qi-bo, HUA Yi-xin, WANG Yi-tao, LIU Hong-jue,ZHANG Xi-yu.Effects of ionic liquid additive [BMIM]HSO4on copper electro-deposition from acidic sulfate electrolyte[J].Hydrometallurgy, 2009, 98∶ 291−297.
[10]陈 昊, 王 亮, 周 勇, 朱家骅.流化床电极处理低浓度硫酸铜废水研究[J].化工设计, 2006, 16(5)∶ 13−16.CHEN Hao, WANG Liang, ZHOU Yong, ZHU Jia-hua.Studies on disposal diluent solution of sulphate of copper in a fluidized bed electrode[J].Chemical Engineering Design, 2006, 16(5)∶13−16.
[11]RUAN Xin-chao, LIU Ming-yue, ZENG Qing-fu, DING Yan-hua.Degradation and decolorization of reactive red X-3B aqueous solution by ozoneintegrated with internal micro-electrolysis[J].Separation and Purification Technology,2010, 74∶ 195−201.
[12]FAN Li, NI Jin-ren, WU Yan-jun, ZHANG Yong-yong.Treatment of bromoamine acid wastewater using combined process of micro-electrolysis and biological aerobic filter[J].Journal of Hazardous Materials, 2009, 162(2/3)∶ 1204−1210.
[13]WANG Yu-ping, WANG Lian-jun, PENG Pan-ying, LU Tian-hong.Treatment of naphthalene derivatives with iron-carbon micro-electrolysis[J].Transactions of Nonferrous Metals Society of China, 2006, 16∶ 1442−1447.
[14]JU Feng, HU Yong-you, CHEN Jian-hua.Removal of chelated Cu(Ⅱ)from aqueous solution by adsorption–coprecipitation with iron hydroxides prepared from microelectrolysis process[J].Desalination, 2011, 274∶ 130−135.
[15]JU Feng, HU Yong-you.Removal of EDTA-chelated copper from aqueous solution by interior microelectrolysis[J].Separation and Purification Technology, 2011, 78∶ 33−41.
[16]罗发生, 徐晓军, 李新征, 邱 敏, 王 盼, 陈 宁.微电解法处理铜冶炼废水中重金属离子研究[J].水处理技术, 2011,37(3)∶ 100−104.LUO Fa-sheng, XU Xiao-jun, LI Xin-zheng, QIU Min, WANG Pan, CHEN Ning.Micro-electrolysis treatment of copper smelting of heavy metals in wastewater[J].Technology of Water Treatment, 2011, 37(3)∶ 100−104.
[17]肖祖峰, 陈明东, 韩光泽.电磁场作用下的强化传质研究进展[J].化工进展,2008, 27(12)∶ 1911−1916.XIAO Zu-feng, CHEN Ming-dong, HAN Guang-ze.Research progress of mass transfer enhancement by electromagnetic field[J].Chemical Industry and Engineering Progress,2008,27(12)∶ 1911−1916.
[18]徐晓军, 王 刚, 范领东, 杨津津, 韩振宇.一种用于回收废水中重金属的板式复合电化学装置∶ 中国, 201020156829[P].2011−01−19.XU Xiao-jun, WANG Gang, FAN Ling-dong, YANG Jin-jin,HAN Zhen-yu.Recovery of heavy metals from wastewater by a plate electrochemical equipment∶ China, 201020156829[P].2011−01−19.
[19]徐晓军, 王 刚, 杨津津, 范领东, 韩振宇.一种用于回收废水中重金属的筒式复合电化学装置∶ 中国, 201020613517[P].2011−06−15.XU Xiao-jun, WANG Gang, YANG Jin-jin, FAN Ling-dong,HAN Zhen-yu.Recovery of heavy metals from wastewater by a drum type electrochemical equipment∶ China, 201020613517[P].2011−06−15.
