低覆盖度行带式固沙林对土壤及植被的修复效应
2013-12-16姜丽娜杨文斌姚云峰蔺瑞岚
姜丽娜,杨文斌,* ,卢 琦,姚云峰,蔺瑞岚
(1.中国林业科学研究院荒漠化研究所,北京 100091;2.内蒙古农业大学生态环境学院,呼和浩特 010019;3.国家林业局西北林业规划设计院,西安 710048)
营造防风固沙林是长远地从根本上改造和利用沙地的重要途径,也是控制和固定流沙,防止风沙危害和有效改良沙地性质,变沙漠为农林牧业生产基地的经济而有效的措施[1]。固沙植被的建设模式决定其防风固沙与生态恢复效果,沙漠地区干旱环境限制了固沙林密度和覆盖度。因此,如何控制防风固沙林栽植密度与配置格局变得至关重要[2-4]。在我国干旱、半干旱地区由于水分条件的制约,经过漫长的自然演替过程,逐步发育形成了广泛分布的低覆盖度植被,其覆盖度低于40%,这些低覆盖度植被类型中存在大量的天然乔木疏林或稀疏灌丛,地表处于半流动状态,而配置成行带式后,即使覆盖度降低到20%时,能够完全固定流沙[5],并且不同配置模式下的土壤与植被自然恢复程度不同。低覆盖度行带式固沙林在有限密度、覆盖度下,在维持了林地水分平衡的同时,实现有效生态防护与生态恢复作用,是一项成功的固沙植被建设技术[5-6],研究低覆盖度行带式固沙林对土壤与自然植被的恢复作用,对进一步推动低覆盖度行带式治沙模式具有一定理论和实践指导意义。
低覆盖度行带式固沙林是指人工营造一行或者多行乔灌木,带是指多行乔灌木之间的空间土地或者叫植被修复带。行带式实际上是形成了由窄林带(占地面积15%—25%)与宽的自然植被修复带(占地面积75%—85%)相间组合的一种复合植被模式。这种模式与国外研究中的“虎斑”结构[7]或二相镶嵌[8]的天然植被景观模式相似,国外研究大多数侧重于带状植被的重要结构参数——带间距与带宽之比,及其与降水量间相关性的研究[9-10]。本文是在符合干旱,半干旱地区水分原理基础上[11],研究低覆盖度行带式固沙林对土壤与自然植被的恢复的作用,进而摸清其促进带间土壤、植被修复的过程与机理。以往的生态恢复研究中,通常集中在植物演替变化及土壤质量变化,而对微生物群落在土壤生态恢复与重建中的作用关注较少,缺乏综合而简单实用的评价方法。本研究以低覆盖度行带式固沙林模式为前提,系统综合的判断出不同固沙林土壤及植被修复程度,直观准确的判断出不同带宽行带式固沙林恢复水平,为我国实现长效固沙与保护促进天然修复植被有机衔接,合理规划和配置行带式造林密度最大限度提高生态恢复效益提供科学依据。
1 材料与方法
1.1 研究区概况
研究区域设在科尔沁沙地南部,地理坐标为北纬 41°42′—43°01′,东经 119°32′—120°54′;是典型的半干旱地区,气候属温带半干旱大陆性季风气候区,年降水350mm左右,年蒸发量2400—2600mm,是降水量的6—8倍,年均温4.9—7.5℃,风沙、干旱是主要气候特点。该区行政区划属内蒙古赤峰市敖汉旗,由浅山、丘陵、沙坨及河川平原等地貌单元组成。地势由西南向东北倾斜,海拔高度在350—800m之间。主要地貌类型有沙丘、甸子以及少数剥蚀残山,地带性土壤以栗钙土和碳酸盐褐土为主,地带性植被以原生草原为主。依次为浅山丘陵森林草原,位于南部努鲁尔儿虎山地,该区人工植被以水土保持林为主,主要造林树种为杨树。中南部为黄土覆盖的广大丘陵区,以旱生草本植物为主,植被稀疏,原生植被较少,只有低矮丛生小灌木及杂草,主要为胡枝子(Lespedeza davurica)、甘草(Glycyrrhiza uralensis)、黄花蒿(Artemisia annua)及1年生禾本科杂草。北部为广大覆沙地和流动、半流动的沙丘,地处西辽河平原的西端,是科尔沁沙地中段向南延伸的边缘部分,以沙生植物为主,主要为黄柳(Salix gordejevii)、沙蒿(Artemisia halodendron)、柠条(Caragana korshinskili)等,原生植被以旱生草本植物为主。本研究利用林地均为采伐迹地或荒坡、荒沙地,地表植被稀疏,主要为甘草(Glycyrrhiza uralensis)、达乌里胡枝子(Lespedeza davurica)、针茅(Stipa capillata)及其他杂草。
1.2 样地设置
在植被、土壤和地形条件相对一致的沙地造林地段,选取造林年限相同或相近并且造林一定时间的低覆盖度行带式固沙林,其带间植被是没有受到干扰或是已经退耕后在完全自然恢复条件下恢复的草本植被,沙地完全被固定,以确保带间植被在一定时间内发生变化。选取造林年限相近的3种带宽的两行一带杨树固沙林样地,林带为南北走向,另外再选取1个流动沙丘样地和1个旷野对照样地CK(选取当地地带性植被类型,地带性植被优势种为狗尾草Setaria viridis、白草Pennisetum centrasiaticum等。)进行对比,共5个样地,分别为20m样地、15m样地、10m样地、流动沙丘样地和CK样地。由于研究区不同配置的行带式杨树固沙林在营造初期均采用带间间作抚育措施,因此带间植被恢复年限为退耕后未开垦年限,不同样地固沙林基本特征见表1。
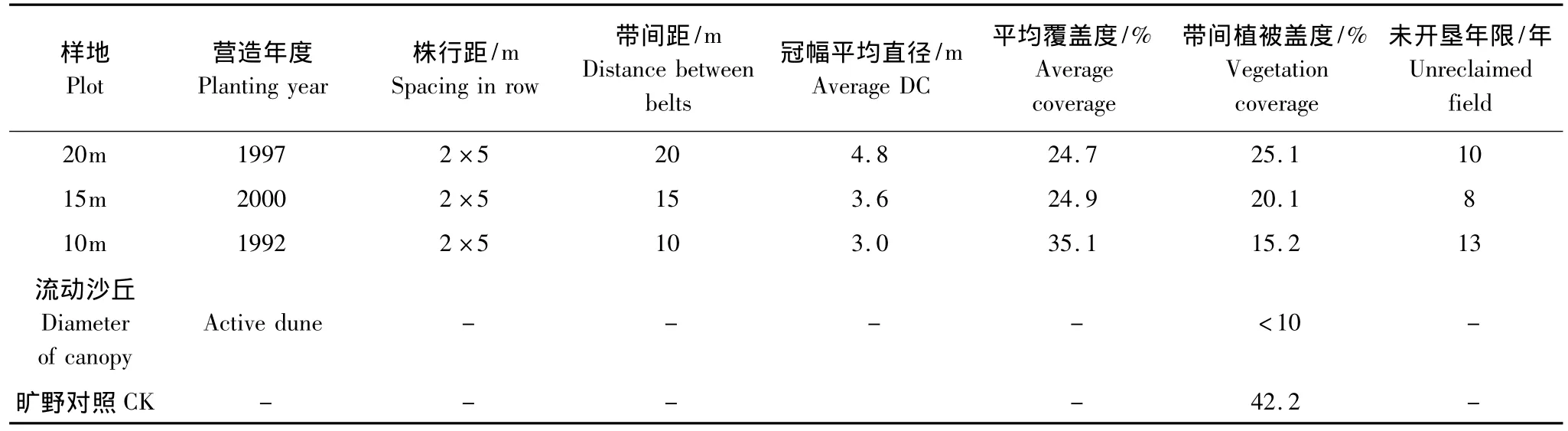
表1 研究区群落基本特征描述Table 1 Community essential characteristics of experimental region

图1 取样示意图Fig.1 Sampling scheme
1.3 样品采集与分析
研究区样地调查与样品采集于2010年6月底进行,土壤与植被调查同步。在已设研究区中选取具有代表性的“两行一带式”杨树防风固沙林地,按照不同带间宽度选取样地进行调查。调查造林地立地类型、造林年限、林分密度、树高、胸径;各样地面积大于200m×100m,在每块样地面积内随机选择3个带间进行土壤和带间植被的调查,同一林带间沿垂直于林带走向每间隔10m设置1条平行的样线,共设3条,从林带的一端林下(0m处)开始,每隔2m设1样方进行植被调查。该取样方法采用系统取样法,取样的样品可以用于统计分析。对照样地与流动沙丘研究区取样面积为25m×25m,所设面积内随机抽取5个植被样方进行调查,流动沙丘则进行土壤取样调查。共计225个样方。在所有研究区中均用1m×1m的样方对带间植被进行调查。其中带间植被生物量调查采用全部收获法,将采集的样品置于通风干燥箱内,在85℃恒温下烘干至恒重,称重记录。植物根系调查采用挖掘法,由于带间植被还处于植被恢复阶段,大多数为1、2年生草本植被,根系较集中0—20cm层,为了配合土壤养分变化的研究,因此,在每个林带间随机设置5个50cm×50cm的小样方,分为0—5cm、5—20cm两个土层采集的所有带间植被根系样品,不考虑杨树根系,应用系统WinRHIZO对所采集的植被根系进行测定分析,扫描后的根系样品置入80℃烘箱中,烘干至恒质量,再分别称量并记录。
土壤样品采集采用剖面法,分两层取样,分别为0—5cm,5—20cm,取样点与草本样方调查点相同,同一样地将所有相同土层混匀混合后,最后取3个重复,土壤样品带回实验室内后分3份。1份土样风干过筛,用于测定土壤基本理化性质[12],其中硝态氮和铵态氮采用2molKCI浸提流动注射分析仪(FIAstar 5000)测定法,1份鲜样在10h之内放入冰箱冷藏,用于测定微生物数量,并尽快进行分析。最后1份在-20℃冰箱保存备用。微生物数量测定采用平板活菌计数法(CFU)[13]。其中细菌培养基为牛肉膏蛋白胨培养基,固氮菌基础培养基采用改良的阿须贝(Ashby)无氮琼脂培养基,真菌培养基为马丁氏孟加拉红琼脂培养基,放线菌培养基为高氏1号培养基,先接种,后倒平板,统计在平皿上长出的菌落数后,计算求出每克土壤的活菌数。
1.4 数据统计与分析
图表和基本数据处理采用Excel,主成分和典型相关分析均采用SPSS 16.0软件进行。
选择表征群落物种多样性、均匀度、丰富度和优势度的4种物种多样性测定指数,以多度为测度指标进行计算。选取的多样性指数有Simpson多样性指数、Shannon-Wiener物种多样性指数;均匀度指数为Pielou均匀度指数;丰富度指数为Margalef指数。

式中,S为群落中的总种数;nj为第j种的个体数量占总个体数量的比例;N为观察到的总个体数。
5)模糊综合评价计算方法
采用模糊综合评价方法来评价不同带宽行带式固沙林土壤植被修复程度。模糊综合评价方法通常建立模糊矩阵,确定各指标的权重,计算综合评价值进行综合判别[14]。本研究采用模糊综合评价方法计算差异性系数,利用模糊综合评价方法所得到的差异性系数称为指示度。


计算最后评判指标di(指示度)做出评价。其中,对照样地为稳定草地,d=1;各个恢复程度评价的系数在0—1之间,系数越接近1,该样地越接近稳定状态。
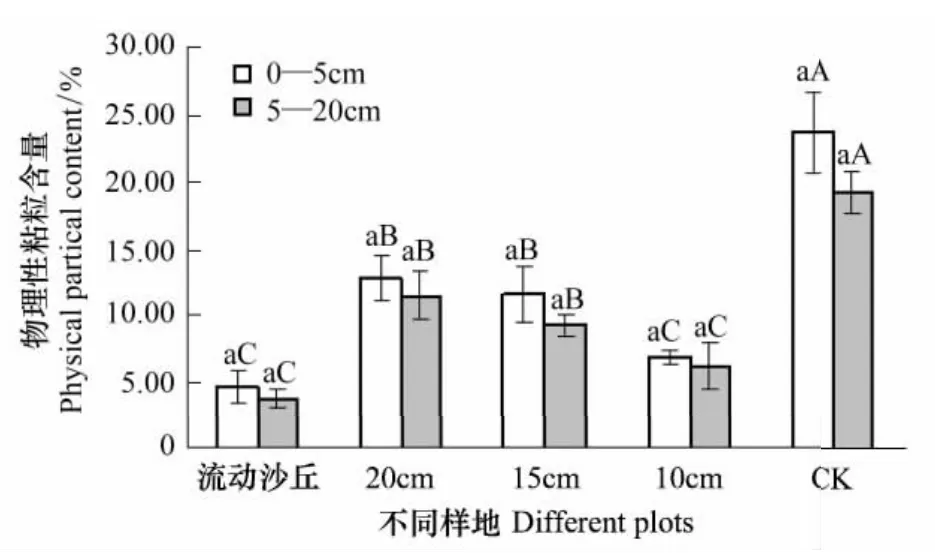
图2 研究区土壤物理性粘粒(<0.01mm)含量对比Fig.2 Comparison of physical particle(<0.01mm)content of experimental region
2 结果与分析
2.1 土壤修复效应
2.1.1 土壤物理性状变化
不同样地0—20cm的土壤物理性粘粒的垂直分布变化见图2。土壤表层物理性粘粒高于下层,0—5cm土层物理性粘粒流动沙丘与10m杨树固沙林差异不显著,20m和15m杨树固沙林都与10m杨树固沙林差异显著;5—20cm土层物理性粘粒为20m杨树固沙林与10m杨树固沙林差异显著;各土层物理性粘粒含量变化均表现为对照样地>20m杨树固沙林>15m杨树固沙林>10m杨树固沙林>流动沙丘,说明行带式固沙林群落还处于植被恢复阶段,随着带宽的增加,土壤物理性粘粒含量有增加趋势。
在不同样地的0—20cm土层中,土壤容重变化表现为流动沙丘>20m杨树固沙林>15m杨树固沙林>10m杨树固沙林>对照样地(表2),从变异系数可以看出,带间距为20m杨树固沙林变异幅度最大,说明该样地改良土壤作用最明显。对照样地土壤0—20cm土层的平均容重为1.34,而行带式固沙林的平均容重均高于对照。这是因为行带式固沙林土壤结构较沙土致密稳固,土体发育上层相对较下层好,而对照土壤生态系统基本处于稳定而良性循环状态,根系量大且密集,因此土壤容重最小。0—5cm土层土壤容重为20m杨树固沙林与15m杨树固沙林差异不显著,但与10m杨树固沙林差异显著;5—20cm土层土壤容重为20m杨树固沙林与15m杨树固沙林和10m杨树固沙林差异均显著,但与对照样地差异不显著(P<0.05)。
不同样地土壤水分含量变化表明(表2);在采样深度范围内,均表现为表层含水量低于下层,这是表层与大气环境接触,水分受温度、地表风速等影响而交换活跃,蒸散较快,故含水量在表层低,从变异系数可以看出,带间距为20m杨树固沙林土壤含水量的变幅最小且含水量较高,显著的高于带间距为15m和10m杨树固沙林含水量。随着带宽的增加土壤含水量有增高的趋势。

表2 研究区土壤容重及水分含量的描述性统计Table 2 The descriptive statistics of soil bulk density and water content of experimental region
2.1.2 土壤化学性质变化
当退化土地转变为固沙林后,随着行带式固沙林带间宽度的变化,不同样地土壤化学性质也发生了显著的变化(表3)。营造固沙林后土壤pH随着带宽的增加明显降低,并且与流动沙丘和对照样地差异均显著(P<0.05);土壤有机碳、全氮、硝态氮、铵态氮和速效钾含量随带宽的增加增大,速效磷含量变化不大。20m杨树固沙林速钾含量高于15m和10m杨树固沙林。行带式固沙林有机碳含量与流动沙丘和对照样地差异均显著,说明行带式固沙林明显增大了有机碳含量,并且20m杨树固沙林效果最明显。同一土层不同行带式固沙林土壤速效磷含量变化差异不显著(P<0.05)。
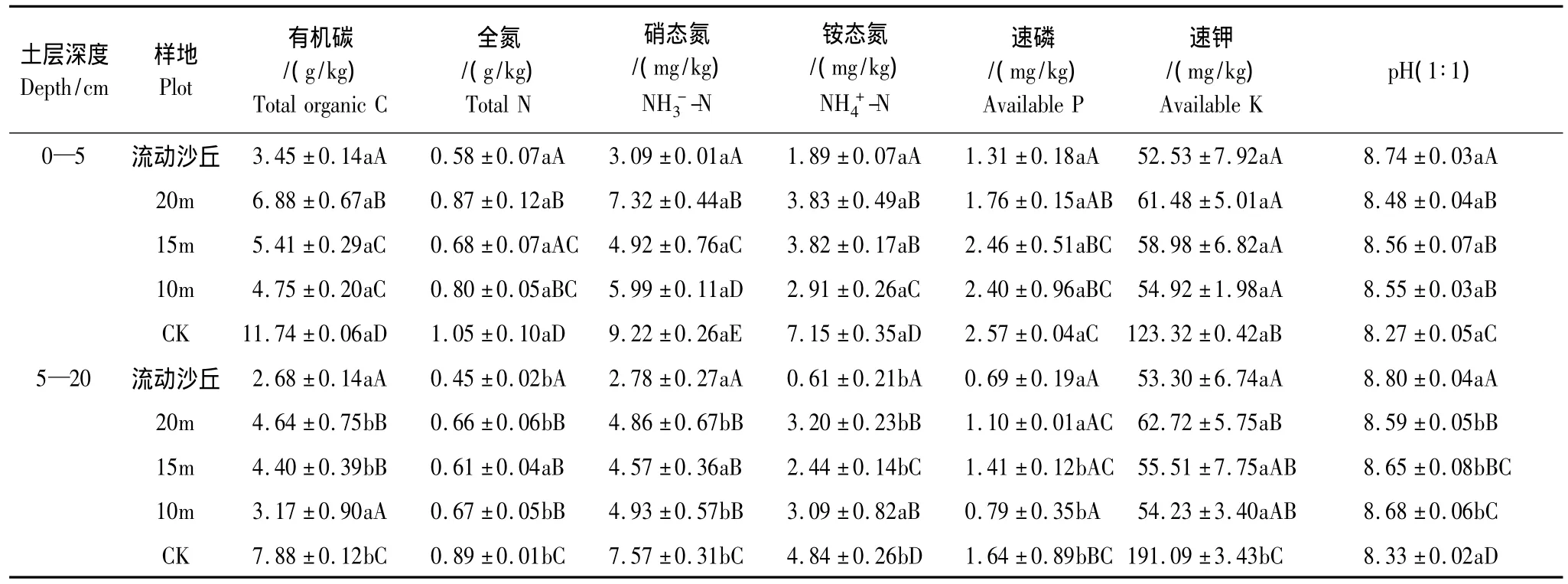
表3 研究区不同样地土壤养分含量及其变化Table 3 The changes of soil nutrient content of experimental region
2.1.3 土壤微生物数量分布特征
微生物是反映土壤质量变化重要的敏感性生物学指标。研究微生物变化有助于揭示研究区土壤微生物的潜在活性强度、作用方向以及土壤养分转化和释放机制[17]。不同样地的土壤微生物数量变化显著(图3),其中细菌(106)数量占优势,其次是放线菌(106)和固氮菌(106),真菌含量最少(103),与邓旺秋、闵红、毕江涛等[18-20]试验结果一致。研究区不同样地土壤微生物的变异幅度整体比较大,微生物总量大小依次顺序为:对照样地>行带式固沙林>流动沙丘,其中行带式固沙林中则为15m杨树固沙林与10m杨树固沙林相近但都小于20m杨树固沙林。随着土壤深度的增加,土壤中的细菌、放线菌、固氮菌、真菌数量表现为上层大于下层,而且微生物总数均表现为上层大于下层。
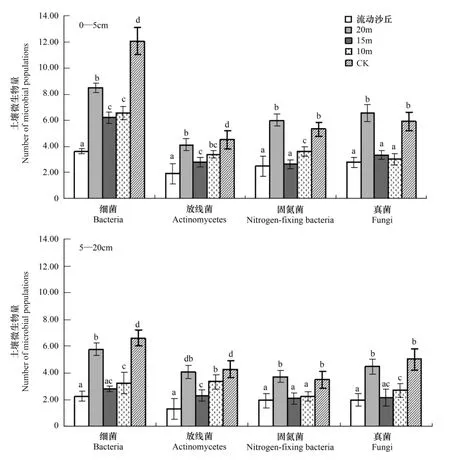
图3 研究区土壤微生物数量对比Fig.3 Comparison of soil microbial populations of experimental region
2.2 植被修复效应
2.2.1 不同样地植被多样性变化
在大量营造人工固沙林中,造林密度对固沙林的稳定性和防风固沙效果起着决定性的因素,行带式防风固沙林林带不仅起到防止风蚀的作用,而且大大降低了固沙林的覆盖度,使得覆盖度仅为20%的行带式配置格局的固沙林能够完全地固定流沙,且带状配置格局的边行优势明显,生物多样性和生产力较高[21-22]。由图4可见,在调查的3种不同带宽的行带式固沙林中,带间植被的物种多样性呈增加趋势,但不同带宽对带间植被物种多样性的增加影响大,其中20m带宽更加有利于带间植被的物种多样性的增加,其增加的速度为20m>15m>10m;但是,3个样地带间植被的物种多样性均小于对照样地,这也说明10a左右的行带式固沙林带间植被的修复还处于植被恢复初期,仍需要一个较长时间的修复才能接近或者达到地带性植被。在3种行带式固沙林中,20m杨树固沙林最为接近对照样地,说明其植被恢复效果优于15m和10m杨树固沙林。随着其林下植被的自然恢复过程,带间距越宽其多样性指数越大,也就是说,密度虽然减小了,但是多样性指数增大了,并且稳定性增强。

图4 研究区不同固沙林样地物种多样性变化Fig.4 Biodiversity variety variation of sand fixing forest experimental region
2.2.2 不同样地植被生物量变化
从研究区杨树固沙林的不同配置格局来看(图5),20m杨树固沙林生物量与对照样地最为接近,且都大于15m和10m杨树固沙林,10m杨树固沙林多样性指数最小,正是由于10m杨树固沙林竞争激烈,植物侵入种数较少,并且生长量不高造成的。而20m杨树固沙林可以为更多物种的侵入提供栖息地,生物生产力也高。因此,杨树行带式造林不宜太窄和盖度太大,会影响带间植被群落生物生产力的大小。15m杨树固沙林和10m杨树固沙林植被盖度相差大,生物量也高于10m杨树固沙林,这是因为10m杨树固沙林仍旧不稳定造成的。不同带间距带间植被生物量有随着带宽增加而显著变大的趋势,但都小于对照样地。

图5 研究区不同固沙林样地物种生物量变化Fig.5 Herbage biomass variety of the community of different sample areas
2.2.3 不同样地植被根系变化
研究区带间距不同的固沙林带间植被根系生物量、根系总长度和根系表面积分布变化总体趋势变现为,对照样地>20m杨树固沙林>15m杨树固沙林>10m杨树固沙林(图6)。0—5cm土层,除根系总长不同样地根系变化差异显著;5—20cm土层,20m杨树固沙林与15m杨树固沙林根系生物量差异不显著,但与10m杨树固沙林和对照样地差异显著。根系总长与根系表面积不同样地变化差异均显著(P<0.05)。以上结果说明行带式造林密度大,带间距离窄时会影响带间植被根系的生长,从而影响植被对水分和营养的吸收,不利于植被的生长和繁衍。
3.3 模糊综合评价
3.3.1 主成分分析
为了研究低覆盖度杨树固沙林在不同配置格局下植被因子与土壤因子之间的相互影响和选择判断不同杨树林恢复程度指标体系,本文对不同带间距杨树固沙林(20m、15m、10m)和对照样地应用“典型相关分析(CCA)”方法,分析植被因子与土壤因子之间的相关性。将植被因子与土壤因子相关性最大的指标用来构建模糊矩阵,进行综合评价不同配置行带式固沙林的土壤植被修复程度,其中土壤指标全部为(0—5cm)土层的指标。
首先对杨树固沙林在不同配置格局下植被因子指标和土壤指标构成的变量组进行PCA分析,在不同配置格局下植物指标PCA分析结果表明(表4),在前三维主成分上累计贡献率分别达到0.8906(20m)、前两维主成分上累计贡献率分别达到0.7489(15m)、0.8104(10m)。各变量在前几维主成分上的因子负荷量最大者分别是:20m杨树固沙林:群落地上生物量、Simpson多样性指数、Shannon-Wiener多样性指数、Pielou均匀度指数、根系总长、根系表面积。15m杨树固沙林:群落盖度、群落地上生物量、Simpson多样性指数、Shannon-Wiener多样性指数、Margelef丰富度指数、根系总长。10m杨树固沙林:群落盖度、群落地上生物量、Shannon-Wiener多样性指数、Pielou均匀度指数、根系生物量、根系总长。

图6 研究区不同样地根系变化Fig.6 Root comparison of different plots of experimental region

表4 研究区不同样地植被变量主成分分析Table 4 PCA of plant variabe under different plot of experimental region
在不同配置格局下土壤指标PCA分析结果表明(表5),在前两维主成分上累计贡献率分别达到0.8247(20m)、0.8194(15m)、0.8598(10m)、0.8976(对照样地)。各变量在前2维主成分上的因子负荷量最大者分别是:20m杨树固沙林:有机碳、硝态氮、速效磷、细菌数量、放线菌数量、固氮菌数量;15m杨树固沙林:土壤水分含量、全氮、铵态氮、速效钾、放线菌数量、固氮菌数量。10m杨树固沙林:土壤粘粒含量、有机碳、铵态氮、速效钾、细菌数量、固氮菌数量。
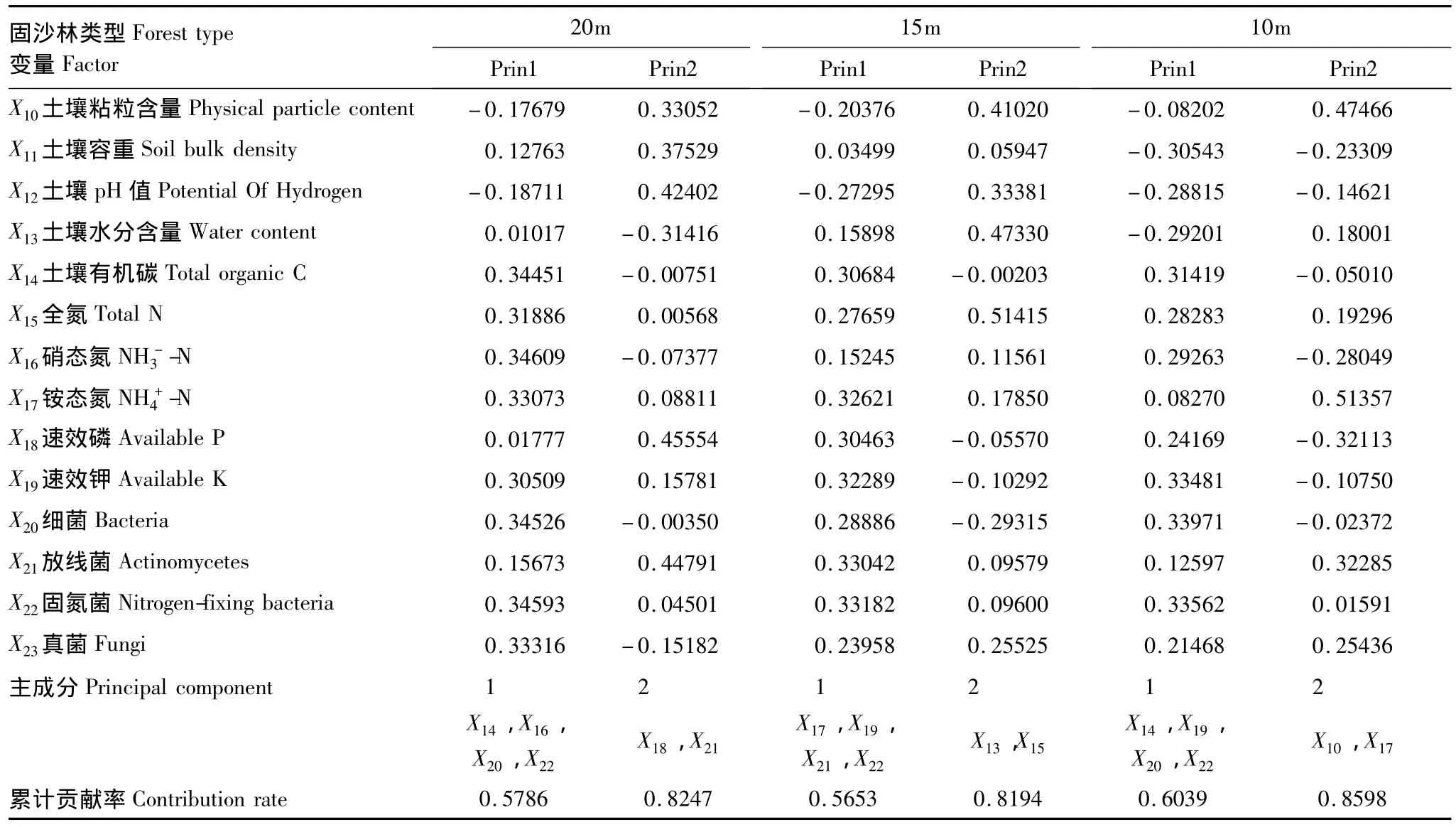
表5 研究区不同样地土壤变量主成分分析Table 5 PCA of soil variabe under different sample areas
3.1.2 典型相关分析
根据以上主成分分析结果,对不同样地植被因子指标与土壤因子指标典型相关分析。结果表明,研究区不同样地第一、第二和第三和第四典型相关累积方差贡献率均超过80%以上,其中20m杨树固沙林89.86%、15m杨树固沙林90.08%、10m杨树固沙林87.51%、对照样地72.92%,说明第一、第二、第三和第四典型相关变量能够代表植被和土壤两组变量组整体的80%以上的信息量。多变量的多种统计检验也均达到极显著水平,20m杨树固沙林第一、二、三典型相关、15m杨树固沙林第一、二、三典型相关、10m杨树固沙林第一、二典型相关达到极显著差异(P<0.01)。因此,不同样地植被指标与土壤指标之间的相互关系可得到如下表达式:


由表达式(1)可知,20m杨树固沙林植被变量的第一、第二和第三典型变量主要由X1(群落盖度)、X3(Simpson多样性指数)、X4(Shannon-Wiener多样性指数)、X5(Pielou均匀度指数)和X9(根系表面积)决定。土壤变量的第一、第二和第三典型变量主要由X14(全氮)、X16(硝态氮)、X19(速效钾)和X20(细菌)决定。由表达式(2)可知,15m杨树固沙林植被变量的第一、第二和第三典型变量主要由X1(群落盖度)、X3(Simpson多样性指数)、X4(Shannon-Wiener多样性指数)、X6(Margelef丰富度指数)决定。土壤变量的第一、第二和第三典型变量主要由X15(全氮)、X17(铵态氮)、X19(速效钾)和X21(放线菌)决定。由表达式(3)可知,10m杨树固沙林植被变量的第一、第二典型变量主要由X1(群落盖度)、X4(Shannon-Wiener多样性指数)、X5(Pielou均匀度指数)和X7(根系生物量)决定。土壤变量的第一、第二典型变量主要由X10(土壤粘粒含量)、X14(有机碳)、X19(速效钾)和X20(细菌)决定。
以经过上述分析得出的土壤及植被指标为因素集,不同恢复程度为处理集,分别以土壤指标、植被指标及土壤植被综合对敖汉研究区不同杨树固沙林恢复程度进行模糊综合评价结果显示(表6),20m杨树固沙林土壤发育程度的指示度为0.6696,即20m杨树固沙林土壤发育程度为对照样地土壤的66.96%;植被已恢复到当前对照样地的75.48%;以植被与土壤特征指标为体系的模糊综合评价的结果看,20m杨树固沙林植被和土壤因子是当前对照样地的68.63%。15m杨树固沙林土壤发育程度为对照样地土壤的56.52%;植被已恢复到当前对照样地的59.40%;以植被与土壤特征指标为体系的模糊综合评价的结果看,15m杨树固沙林土壤和植被因子是当前对照样地的55.01%。10m杨树固沙林土壤发育程度为对照样地土壤的41.94%;植被已恢复到当前对照样地的43.54%;以植被与土壤特征指标为体系的模糊综合评价的结果看,10m杨树固沙林植被和土壤因子是当前对照样地的42.04%。

表6 研究区不同样地土壤与植被恢复程度Table 6 Recovery degree of soil and vegetation under different plots
4 讨论
营造行带式固沙林后随着固沙林的生长,土壤有机碳、全氮、硝态氮、铵态氮和速效钾含量随带宽的增加增大。这是由于造林后,林带间地表覆盖发生显著的变化,随着地表覆盖物的增加,土壤微环境逐渐变为湿润,土壤的淋溶作用变强,导致土壤pH值降低,同时由于植被的增加,土壤中CO2的含量增加,根据岩溶动力系统[23],则土壤中H+含量也增加,导致土壤pH值的降低;随着地表覆盖物的增多,枯枝落叶残体的增加,土壤有机质的分解速度减慢,从而导致土壤有机质含量的增加,而有机质含量的增加是土壤全氮的主要来源,随着有机质含量的增加,土壤全氮、硝态氮和铵态氮含量随之增加;随着土壤 pH值的降低,土壤的固钾能力降低[24],造成土壤速钾含量的增加只能是与造林初期带间间作旱地普遍使用钾肥相关,宽行带式固沙林带间土壤施肥面积大速钾含量高。另外,行带式固沙林全氮含量变化显示10m杨树固沙林全氮含量较高,但不代表10m杨树固沙林恢复效果最好,这可能与10m杨树固沙林恢复年限长,氮元素的累积量大有关,在实际调查中发现10m杨树固沙林带间植被非常稀疏,带间距小于10m不利于植被生长。
土壤微生物的变化与枯枝落叶有密切关系,在地表聚积大量枯枝落叶,有充分的营养源,水热和通气状况较好,利于微生物的生长和繁殖。微生物主要以植物残体为营养源,植物的质和量的差异必然导致土壤微生物在各植物固沙林中分布的不均一性。带间距为20m杨树固沙林与对照样地的草本植被盖度较大,土壤微生物大量集中在浅表层根系区域,物质和养分能够得到及时补充,有利的微环境导致土壤微生物数量高。而带间距为15m和10m杨树固沙林则由于带间植被盖度低,植被物种单一不稳定而导致微生物数量都很低。虽然15m杨树固沙林植被盖度大于10m杨树固沙林,但其微生物数量却小于10m杨树固沙林,这是由于杨树的落叶为土壤微生物的提供了充足的养分库,因为在实际调查中,其地表植被稀疏,盖度很低枯落物几乎都为杨树落叶,而且10m杨树固沙林带间温度要高于15m杨树固沙林带间有利于微生物繁殖。以上表明同一树种以不同的配置方式营造在很大程度上影响着草本植物的恢复能力、土壤质量变化及微生物数量变化。
行带式固沙林实际上是在起到沙障作用的同时确保自然植物能够定居;促进了带间自然植被快速修复和土壤的形成过程。虽然杨树不适于干旱地区,但适宜栽植密度的杨树林带对沙地土壤-植被系统自然修复具有明显促进作用。行带式固沙林造林以后,在短短的十几年内对土壤性状具有明显的改善作用;同时,随着土壤的变化,导致植物种类组成的更替。植被的生长又为林带提供了养分和水分补给带,达到林草复合植被优势互补,相互衔接持续发育,具有重要的促进生态系统恢复功能。而行带式固沙林正是通过带宽的变化来影响和调节这种植物与土壤的之间相互作用,窄带间距固沙林土壤与植被的相互作用则由于造林密度大而受到抑制。
5 结论
在干旱、半干旱区,由于水分条件的制约,天然的存在着低覆盖度(20%—30%)的疏林(或者是稀树灌丛),沙地仍处于半固定、半流动状态,多年来研究得出以相同覆盖度的行带式配置格局的固沙林能够完全固定沙地,同时也发现,不同覆盖度导致固沙林的土壤和植被自然恢复的程度是不同的,通过上述的实验资料分析,对于行带式固沙林土壤和植被自然恢复有了进一步的认识:
(1)行带式杨树固沙林能够明显的影响土壤的理化性质,随着带宽的增加土壤容重减小,水分含量和养分含量有增加的趋势,微生物数量增加,表明当固沙林配置格局合理时,降低栽植密度同样可以达到促进土壤修复的目标。行带式固沙林随带宽的增加这种促进作用增强。20m杨树固沙林对土壤修复的促进作用最明显,是较好的配置模式。
(2)带间距为20m杨树固沙林对植被的恢复促进作用优于15m和10m杨树固沙林。宽行带式固沙林虽然栽植密度减小了,但是多样性指数增大了,对植被恢复的促进作用也增强了,并且宽带间距有利于带间草本植被生物量的积累和根系的生长,当带间距不足够宽时则会不利于植被生长。
(3)不同带宽行带式固沙林带间植被因子与土壤因子之间相关不一致,模糊综合评估结果表明不同带宽的行带式固沙林,虽然恢复年限相近,但因栽植密度不同导致指示度不同,即恢复程度不同;土壤修复程度明显落后于植被,宽带间距可以明显加快土壤及植被修复的速度,从而缩短土壤及植被修复的时间,宽带间距固沙林缩短土壤及植被修复时间的效果更明显。
[1] Gao S W.Control Desertification and Silvics.Beijing:Chinese Forestry Press,1984.
[2] Yang W B,Ding G D,Wang J Y,Yao J C,Dong Z,Yang H Y.Windbreak effects of belt scheme caragana korshinskili kom plantation for sandfixation.Acta Ecologica Sinica,2006,26(12):4106-4112.
[3] Yang W B,Yang H Y,Lu Q,Wu B,Zhao A G,Le L,Yao J C,Wang J Y,Hu X L.Wind tunnel experiment on sand fixation effects of sparse shrub communities varying in spatial arrangement.Acta Ecologica Sinica,2008,28(7):2998-3007.
[4] Jiang L N,Yang W B,Yao Y F,Lu Q,Du M,Wang L L.Vegetation recovery in mongolian pine sand-fixing belts in response to boundary effect of forest-grassland.Journal of desert research,2011,31(2):372-378.
[5] Yang W B,Dong H L,Lu Q,Wang J Y,Liang H R,Jiang L N,Zhao A G.Pattern of low-covered sand-fixing woodland and its windbreak effect.Acta Ecologica Sinica,2011,31(17):5000-5008.
[6] Jiang L N.The promoting effect of soil and vegetation recovery between low coverage sand-fixing forest belts.Inner Mongolia Agricultural University,2011.
[7] C.Valentin J M.d′Herbès.Niger tiger bush as a natural water harvesting system.Catena,1999,37:231-256.
[8] BarkerT.Vegetation pattern in the Nigerien tiger bush.Department of Geography,Coventry Polytehnic,B.S.dissertation,1992.
[9] Thiéry J M,Valentin C,d′Herbès J M.A model simulating the genesis of banding patterns in Niger.Ecol,1995,83,497-507.
[10] Galle S,Peugeot C.Soil water spatial distribution of tiger bush in Niger.AGU meeting,SanFancisc,1998,12:6-10.
[11] Yang W B,Wang J Y.Characteristics of water utilization in border row and optimum disposition structure in plantation in arid and semi-arid region.Scientia Silvae Sinicae,2004,40(5):3-9.
[12] Bao S D.Agriculture Chemical Analysis of Soil.Beijing:Chinese Agriculture Press,2000.
[13] Ceng S M,Lin H P,Zhang L Q.Introduction to Microbiai Ecology,Beijing:Higher Education Press,2007.
[14] Li B N.Applications of Fuzzy Math.Anhui:Hefei Univerisity of Technology Press,2007.
[15] Gao A S.Ecosystem Health Assessment on Grazing Land of Leymus chinensis Steppe.Hohhot:Inner Mongolia Agricultural University,2005.
[16] Sala O E,Oesterheld M,Leon R J C and Soriano A.Grazing effects upon plant community structure in subhumid grasslands of Argentina.Vegetatio,1996,67:27-32.
[17] Xu Y C,Shen Q R,Ran W.Effects of zero-tillage and application of manure on soil microbial biomass C,N,and P after sixteen years of cropping.Acta Pedologica Sinica,2002,39(1):89-95.
[18] Deng W Q,Pan C M,Li T H,Kong G H,Xia H P.Bcology of soil microorganisms in shale wastes dumping area during rehabilitation through forestation.Chinses Journal of Applied and Environmental Biology,2003,9(5):522-524.
[19] Bi J T,He D H,Huang Z Y,Yang L,Ma Q R.Response of soil microbial community activity to vegetation restoration in degraded ecological system.Journal of Soil and Water Conservation,2008,22(4)195-200.
[20] Min H,He W X,Li X M,Liu G B,Yang X.Evaluative feature of soil microbial population under plant restored process in loess regions.Acta Botanica Boreali-Occidentalia Sinica,2007,27(3):0588-0593.
[21] Yang W B,Lu Q,Wu B,Wang J Y,Wang X J,Liu S H,Li X Y.Relations of poplar density and planting composition to its growth in Horqin sandy land.Scientia Silvae Sinicae,2007,43(8),54-59.
[22] Yang W B,Wang J Y,Wang X J,Liu L C,Wei Y X.Relation between growth of high-yield poplar and density and planting composition in Keerqin sandy land.Journal of Beijing Forestry University,2005,27(4):33-38.
[23] Yuan D X.Carbon cycle and global karst.Quaternary Sciences,1993,(1):1-6.
[24] Zhao J G.Red soil of material circulation and its regulation.Beijing:Science Publishing House,2002.
参考文献:
[1] 高尚武.治沙造林学.北京:中国林业出版社,1984.
[2] 杨文斌,丁国栋,王晶莹,姚建成,董智,杨红艳.行带式柠条固沙林防风效果.生态学报,2006,26(12):4106-4112.
[3] 杨文斌,杨红艳,卢琦,吴波,赵爱国,乐林,姚建成,王晶莹,胡小龙.低覆盖度灌木群丛的水平配置格局与固沙效果的风洞试验.生态学报,2008,28(7):2998-3007.
[4] 姜丽娜,杨文斌,姚云峰,卢琦,杜敏,王琳琳.樟子松固沙林带间植被恢复及其对林草界面作用的响应.中国沙漠,2011,31(2):372-378.
[5] 杨文斌,董慧龙,卢琦,王晶莹,梁海荣,姜丽娜,赵爱国.低覆盖度固沙林的乔木分布格局与防风效果.生态学报,2011,31(17):5000-5008.
[6] 姜丽娜.低覆盖度行带式固沙林促进带间土壤、植被修复效应的研究.内蒙古农业大学,2011.
[11] 杨文斌,王晶莹.干旱、半干旱区人工林边行水分利用特征与优化配置结构研究.林业科学,2004,40(5):3-9.
[12] 鲍士旦.土壤农化分析.北京:中国农业出版社,2000.
[13] 陈声明,林海萍,张立钦.微生物生态学导论.北京:高等教育出版社,2007.
[14] 李柏年.模糊数学及其应用.合肥工业大学出版社,2007
[15] 高安社.羊草草原放牧草地生态系统健康评价.内蒙古农业大学,2005.
[17] 徐阳春,沈其荣,冉炜.长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响.土壤学报,2002,39(1):89-95
[18] 邓旺秋,潘超美,李泰辉,孔国辉,夏汉平.油页岩废渣场植林修复过程中的土壤微生物生态.应用与环境生物学报,2003,9(5):522-524.
[19] 毕江涛,贺达汉,黄泽勇,杨磊,马巧荣.退化生态系统植被恢复过程中土壤微生物群落活性响应.水土保持学报,2008,22(4)195-200.
[20] 闵红,何文祥,李晓明,刘国斌,杨祥.黄土丘陵区植被恢复过程中土壤微生物数量演变特征.西北植物学报,2007,27(3):588-593.
[21] 杨文斌,卢琦,吴波,王晶莹,王晓江,刘士和,李显玉.杨树固沙林密度、配置与林木生长的关系.林业科学,2007,43(8),54-59.
[22] 杨文斌,王晶莹,王晓江,刘立城,魏永新.科尔沁沙地杨树固沙林密度、配置与林分生长过程初步研究.北京林业大学学报,2005,27(4):33-38.
[23] 袁道先.碳循环与全球岩溶.第四纪研究,1993,(1):1-6
[24] 赵其国.红壤物质循环及其调控.北京:科学出版社,2002.
