青藏高原高寒草甸植被特征与温度、水分因子关系
2013-12-16徐满厚
徐满厚,薛 娴
(中国科学院寒区旱区环境与工程研究所,沙漠与沙漠化重点实验室,兰州 730000)
植被特征与环境因子的关系一直是生态学研究的热点[1-3]。植被生物量分配主要受气候因素影响,植物通过改变对不同器官的生物量分配来达到在变化环境中最大限度提高获取各种资源的能力,从而增加生长速率[4]。Mokany等[5]利用全球R/S(地下-地上生物量比)数据分析得到,草地生态系统的 R/S与年均温、年降水呈显著负相关。王亮等[4]和Yang等[6]分别从植物个体水平和群落水平对中国草地R/S的研究却发现,R/S随年均温、年降水未呈明显的变化趋势。杨元合等[7]和马文红等[8]对中国草地物种丰富度的研究表明,物种丰富度与生长季降水、温暖指数及地上生物量呈显著正相关,但受空间尺度影响。可见,环境因子异质性对植被盖度、生物量结构以及群落物种组成、物种多样性等产生重要影响[9-11],并发展形成了重要的生态学代谢理论。该理论基于生物个体大小和环境温度对个体新陈代谢过程的影响,使用尺度推移法解释多种生态学格局和过程[12]。Brown等[13]用这一理论解释物种多样性的大尺度格局,从机制上解释了物种多样性与环境温度的关系。然而,生态学代谢理论自提出就饱受争议,虽经过了正反两方面经验数据的检验,但目前仍未达成一致结论。
青藏高原属于气候变化的敏感区和生态脆弱带,在全球气候变化背景下呈现出暖化趋势,促使冻土活动层厚度和土壤等发生显著变化[14-15]。作为青藏高原较为典型的植被类型,高寒草甸是适应高原隆起和长期低温环境形成的特殊产物[16],是典型的高原地带性和山地垂直地带性植被[17],也是牧民的主要牧草来源。但其生态系统极其脆弱,对人类干扰和由温室气体增加引起的全球气候变化极为敏感,一旦遭受破坏很难在短期内得到恢复,并可能导致草地退化和沙漠化发生,影响牧民经济生活。随着青藏高原气候暖化,高寒草甸植被的物候和生长、光合特征、生物量生产和分配,以及群落的演替和碳氮含量等都会随之发生改变[15-20]。虽然针对上述问题已开展了很多工作,但以往的研究往往注重生态系统对环境变化的响应特征,对青藏高原高寒草甸植被特征与环境因子间的复杂关系还需进一步探讨。野外自然条件下的生态系统增温实验,是研究全球变暖与陆地生态系统关系的一种主要方法,其研究结果有助于解释生态系统响应和适应全球气候变化的内在机制,可为模型预测和验证提供关键的参数估计[18-19]。因此,本研究基于在青藏高原高寒草甸区进行的增温实验(已增温1a),采用除趋势对应分析(DCA)、冗余分析 (RDA)、逐步回归和通径分析法探讨了高寒草甸植被特征与温度、水分因子的关系,并试图论证高寒草甸植被是否符合生物多样性代谢理论。
1 研究区概况
研究区位于中国科学院冻土工程国家重点实验室青藏高原研究基地(简称北麓河试验站),地理坐标为34°49′33.98″—34°49′36.58″N,92°55′57.19″—92°56′06.32″E,平均海拔 4630 m。该地属青藏高原干寒气候区,年均气温为-5.9℃,年均降水量267.6 mm,年均潜在蒸发量1316.9 mm,年均风速4.1 m/s,冻结期为9月—翌年4月[17]。实验期间风速较小,4 m高度处平均风速为3.4 m/s。风向以西风为主,有时为西南偏西风。植被属高寒草甸类型,以高山嵩草(Kobresia pygmaea)为建群种,伴生有矮火绒草(Leontopodium nanum)、美丽风毛菊(Saussurea pulchra)、藏嵩草(Kobresia tibetica)、青藏苔草(Carex moorcroftii)、细小棘豆(Oxytropis pusilla)等,以莎草科和菊科的植物为主,蓼科的珠芽蓼 (Polygonum viviparum)也较为常见,植被盖度达83%。动物主要是高原鼠兔(Ochotona curzoniae),营群居生活,筑巢掘出土壤在地面堆积形成“小土丘”。土壤为高山草甸土,以沙土居多,剖面发育具有薄层性、粗骨性特点;表层具有5—15 cm厚草皮层,土层一般仅为4—6 cm,有机质含量达8—25 g/kg;表层以下常夹带多量砾石,呈As-A1-C/D结构,B层发育不明显[17]。
2 研究方法
2.1 样地设置
实验样地设在距北麓河试验站约300 m的典型高寒草甸地段,植被分布均匀,地势较为平坦,未受放牧、鼠兔啃食等干扰。增温采用红外线辐射器,设置3个能量梯度:0 W/m2(对照,T0)、130 W/m2(使地面增温约1℃,T1)和150 W/m2(增温约3℃,T2),每种梯度5次重复。增温样地面积2 m×2 m,分布位置见图1。增温样地正上方距地面1.5 m高度处架设红外线辐射器,其中T0处理只设灯架,用于消除各增温处理中灯架遮阴对植被的影响;距地面1 m高度处架设SI-111红外地表温度传感器,测定下垫面温度;距地面20 cm高度处架设HMP45C温湿度探头,测定20 cm高度空气温度、空气相对湿度和空气水汽压;土壤中布设109SS-L温度探头测定20、40、60、100 cm 深度土壤温度,布设 FDR(Envior SMART)水分探头测定10、20、40、60、100 cm 深度土壤水分。采用CR1000数采仪进行数据采集,频度为10 min采集1次。为减弱强风对增温实验影响,根据研究区主风向(西风),在距增温样地中心位置1.5 m处设置两块高度为1.5 m的挡风板,分别位于增温样地的北面和西面。由于每个增温样地均设有挡风板,各增温处理中挡风板遮阴对植被的影响也可消除(同灯架设置)。在增温样地外部空旷处架设一小型生态气象观测站,观测常规气象数据。增温样地(图2a)和小型生态气象观测站(图2b)均用铁丝网围拦。实验样地于2010年6月完成设置。

图1 实验样地分布示意图Fig.1 Distribution schematic diagram of experimental plots
2.2 调查方法
(1)为避免长期采样对样地的破坏,在其外围2 m左右处选取与增温样地植被相似的地段作为非实验样地,根据其植被覆盖情况设置大小为20 cm×20 cm或30 cm×30 cm的样方,测其植被高度、盖度和地上-地下生物量,测定时间为2010年6、8月和2011年6、7、8、10月,每月调查10个样方。为保证测定时间的一致性,于2011年6、7、8月测定增温样地植被的高度、盖度和物种丰富度。由于非实验样地是在增温样地周围近距离处选取,二者生境相同,且植被高度和盖度与增温样地植被较为一致,故可通过建立非实验样地植被地上-地下生物量与高度、盖度的多元回归方程间接推导出增温样地不同时期的植被地上-地下生物量。

图2 增温样地(a)与小型生态气象观测站(b)Fig.2 Experimental warming plot(a)and small ecological meteorology station(b)
(2)植被指标测定 高度用特制直尺(割除零刻度线至边缘的空白部分)按对角线测定,增温样地每条对角线随机测定20个,共测40个值;非实验样地每条对角线随机测定5个,共测10个值。盖度借助27 cm×27 cm的样方框测定,根据样方框大小特制一个网格尺寸为2.5 cm×2.5 cm的硬铁丝网(网格数为100个),将其平铺在样方框内,计数被植被覆盖的小方格;测定时将增温样地平分为4个部分,测定每一部分的盖度值,取其平均值作为该样地的盖度,非实验样地直接测定样方中的盖度值。统计增温样地物种种类数,计算物种丰富度指数。地上生物量采用齐地刈割法,刈割样方为20 cm×20 cm或30 cm×30 cm,刈割完毕用毛刷将未收集的地上部分扫在一起,去除附着的土块后重新收集到样品袋中。地下生物量采用挖土块法,将刈割样方0—30 cm深度的土壤全部挖出,在北麓河试验站立即放进网孔为1 mm×1 mm的筛网中冲洗、晒干,根据根的颜色和柔韧性去除死根后,将根系放进75℃的烘箱中烘干并称重。
2.3 数据分析
用SPSS17.0软件构建非实验样地植被地上-地下生物量与高度、盖度的多元回归方程:AB=72.739C+30.257H-29.95(R2=0.322,P <0.01),BB=14187.995C-340.281H-2249.69(R2=0.604,P <0.01),式中,H为高度/cm、C为盖度、AB为地上生物量/(g/m2)、BB为地下生物量/(g/m2)。对2011年8月增温样地的植被物种丰富度(S)取自然对数(lnS),各温度因子转换成绝对温度(T)后乘以波尔兹曼(Boltzmann)常数(K0=8.62×10-5)再取倒数(1/K0T),用Origin8.1软件对lnS和1/K0T进行回归分析。用Canoco4.5软件和SPSS17.0软件对植被指标与温度、水分因子的关系进行排序、逐步回归和通径分析。指标间的显著性检验由SPSS17.0软件进行方差分析,多重比较由Duncan检验完成;分析图的绘制由Origin8.1软件完成。
3 结果和分析
3.1 植被物种多样性与温度的关系
以2011年8月增温样地的植被特征和温度因子为研究对象,探讨高寒草甸植被物种多样性与温度的关系。如图3所示,lnS与各温度因子1/K0T的线性关系均达到显著水平,其中20 cm高度空气温度、红外地表温度、20 cm和100 cm深度土壤温度的1/K0T与lnS达到极显著水平,40 cm和60 cm深度土壤温度的1/K0T与lnS达到显著水平,说明高寒草甸植被物种多样性的对数与绝对温度的倒数呈显著线性递减关系,即在一定温度范围内植被物种多样性随温度升高而显著增加。空气-地表-浅层土壤(0—20 cm)温度对植被物种多样性影响较大 (R2>0.6,P<0.01),深层土壤 (40—60 cm)温度对植被物种多样性影响较小 (R2<0.5,P<0.05)。100 cm深度土壤温度对植被物种多样性也产生极显著影响,这可能与增温后冻土融化改变了土壤温度、土壤水分等有关。在研究中发现,增温后深层土壤水分有增加趋势,并在100 cm深度处的T0和T2之间出现显著差异(图4)。冻土融化吸收周围热量,致使该层土壤温度降低,对植被产生一定影响。从方程的斜率上看,不同温度因子1/K0T与lnS的斜率存在差异,其变化范围为 -1.85—-0.998,换算成植被新陈代谢过程中的平均活化能则为0.998—1.85 eV,高于生物多样性代谢理论预测值0.6—0.7 eV,这是高寒草甸植被对长期低温环境适应进化的结果。
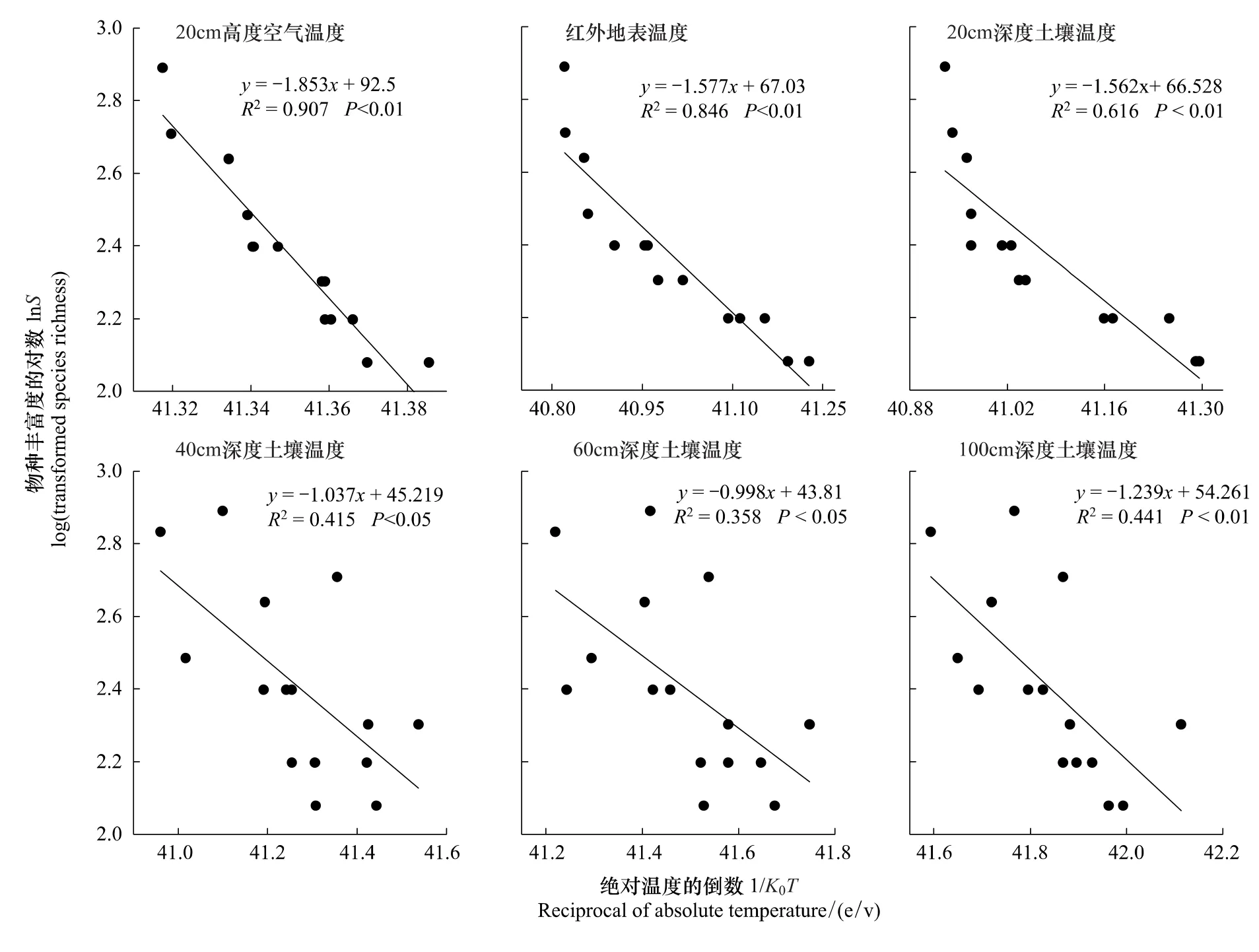
图3 物种丰富度对数与绝对温度倒数的回归分析Fig.3 Regression analysis between log-transformed species richness and reciprocal of absolute temperature

图4 增温样地不同处理下土壤水分的变化趋势Fig.4 Soil moisture changes at different depths in different treatments of experimental warming plots
3.2 植被特征与温度、水分因子的关系
采用DCA、RDA排序分析对植被特征与温度、水分因子的关系进行研究。为确定排序所采用的模型,对植被数据进行DCA排序,得到4个排序轴的梯度长度(轴1为0.124,轴2—4为0.117),其中最大值为0.124<3,说明线性模型较为适合。选择RDA进行排序,得到排序轴的特征值和累积解释量 (表1)。第1轴为约束性排序轴,对植被的解释比率达到64.1%,对植被-环境关系的解释比例达到99.9%;第2轴为非约束性排序轴,对植被(0.1%)和植被-环境关系 (0.1%)的解释量远小于第1轴。第1轴和第2轴可以解释植被-环境关系的全部信息。

表1 RDA排序的特征值及累积解释量Table 1 Eigenvalues and cumulative percentage variances of RDA ordination
第1轴为10、20、40、60 cm深度土壤水分变化轴 (表2),与轴呈负相关,相关系数绝对值平均为0.499;与植被盖度、总生物量和地下生物量均存在极显著正相关性(表3),相关系数在0.419—0.664之间,平均为0.524,反映土壤水分对植被产生影响。第2轴为20 cm高度空气温度、20 cm高度空气相对湿度和100 cm深度土壤温度变化轴(表2),除20 cm高度空气相对湿度与轴呈负相关外,其余因子与轴呈正相关,相关系数绝对值平均为0.497;与植被高度、地上生物量和根冠比的相关性也均达到极显著水平(表3),相关系数绝对值在0.382—0.506之间,平均为0.432,反映空气-土壤温度对植被产生影响。图5显示,温度对植被地上部分影响较大,土壤水分对植被地上-地下部分影响均较大,且温度和土壤水分对植被产生极显著正效应 (表3),说明在一定范围内温度升高和土壤水分增加均可极显著促进高寒草甸植被生长。蒙特卡罗置换检验(Monte Carlo permutation test)表明,第一排序轴的F=55.408,P=0.002;所有排序轴的F=4.268,P=0.002,说明RDA排序达到了极显著水平。

表2 环境因子与排序轴的相关系数Table 2 Correlation coefficients between environmental factors and ordination axes of RDA

表3 排序轴植被指标与环境因子的相关分析Table 3 Correlation analysis between vegetation indexes and environmental factors in ordination axes of RDA
3.3 温度、水分因子对植被的直接影响和间接影响
为建立植被特征与温度、水分因子关系的最优模型,对其进行逐步回归分析:

回归方程的决定系数均较高,显著性检验均达到极显著水平,各自变量偏回归系数的显著性检验也均达到显著水平,说明所建模型成立。除根冠比只由100 cm深度土壤温度影响外,其余植被特征均由2—3个环境因子影响,其中高度和地上生物量由20 cm高度空气相对湿度和40 cm深度土壤水分影响,决定系数为0.562和0.59;总生物量和地下生物量由60 cm深度土壤水分、40 cm深度土壤温度以及红外地表温度影响,决定系数为0.511和0.507;盖度由60 cm深度土壤水分和40 cm深度土壤温度影响,决定系数为0.492。可见,在增温处理下冻土融化使40、60 cm深度土壤水分和40 cm深度土壤温度对植被产生了一定影响。为进一步分析环境因子对植被的直接影响和间接影响,对有2—3个自变量的回归方程进行通径分析。

图5 植被特征 (实线)与温度、水分因子 (虚线)的RDA排序图Fig.5 RDA ordination diagram among vegetation characteristics(solid line),temperatures,and moistures(dotted line)

表4 各回归方程相关系数的分解Table 4 Decomposition on correlation coefficients of regression equations
在表4中,对高度而言,40 cm深度土壤水分的通径系数略大于20 cm高度空气相对湿度,20 cm高度空气相对湿度的间接通径系数略大于40 cm深度土壤水分,各自变量的通径系数大于间接通径系数,说明40 cm深度土壤水分对植被高度产生直接影响,20 cm高度空气相对湿度通过40 cm深度土壤水分对植被高度产生间接影响。对盖度而言,60 cm深度土壤水分的通径系数大于40 cm深度土壤温度,且大于自身的间接通径系数;40 cm深度土壤温度的间接通径系数略大于60 cm深度土壤水分,但小于自身的通径系数,说明60 cm深度土壤水分对植被盖度产生直接影响,40 cm深度土壤温度主要通过60 cm深度土壤水分对植被盖度产生间接影响。同理,对地上生物量而言,40 cm深度土壤水分对其产生直接影响,20 cm高度空气相对湿度主要通过40 cm深度土壤水分对其产生间接影响。在对总生物量和地下生物量的直接影响中,40 cm深度土壤温度的直接作用最大,60 cm深度土壤水分和红外地表温度次之,且二者相差不大;在对二者的间接影响中,红外地表温度的间接作用最大,其次是40 cm深度土壤温度,60 cm深度土壤水分最小。40 cm深度土壤温度和60 cm深度土壤水分的通径系数大于间接通径系数,红外地表温度的通径系数小于间接通径系数,说明40 cm深度土壤温度和60 cm深度土壤水分对植被总生物量和地下生物量产生直接影响,红外地表温度通过40 cm深度土壤温度对植被总生物量和地下生物量产生间接影响。综上所述,40、60 cm深度土壤水分对植被地上部分产生直接影响,20 cm高度空气相对湿度和40 cm深度土壤温度对其产生间接影响;40 cm深度土壤温度和60 cm深度土壤水分对植被地下部分产生直接影响,红外地表温度对其产生间接影响。
4 讨论
4.1 生物多样性与环境温度的关系
Stegen等[21]基于物种个体新陈代谢过程提出了生态学上具有重要意义的“生物多样性代谢理论”,给出了物种丰富度与环境温度的两个预测关系:(1)物种丰富度的对数和绝对温度的倒数呈线性函数关系;(2)该线性关系的斜率在-0.7— -0.6之间,换算成物种新陈代谢过程中的活化能为0.6—0.7 eV。生物多样性代谢理论不仅明确了物种丰富度与环境温度的关系,也赋予了二者斜率的生物学意义,但该理论仍具有不确定性,不同学者对其争议很大。在本研究中,各温度因子1/K0T与lnS的线性递减关系均达到显著水平,说明高寒草甸植被物种多样性的对数与绝对温度的倒数呈显著线性函数关系,符合代谢理论的第一个预测;将方程斜率换算成植被新陈代谢过程中的平均活化能则为0.998—1.85 eV,高于代谢理论预测值0.6—0.7 eV,表明高寒植被在低温、干旱、疾风等恶劣环境下生存,其活化能较高。因此,青藏高原高寒草甸植被符合生物多样性代谢理论的第一个预测,但不符合第2个预测。Wang等[22]对中国树木多样性分布格局的分析也表明,物种多样性的对数与绝对温度的倒数呈显著线性关系,符合代谢理论的第1个预测,但方程的斜率显著大于预测值,和本研究结论相一致。Hawkins等[23]也得到和本研究相似的结论,他们借助全球46个物种数据库对生物多样性代谢理论进行了细致检验,结果表明有一半的数据符合理论中的多样性对数与绝对温度倒数呈线性关系,但方程的斜率只有2个数据满足预测值。而Allen等[24]和Brown等[13]对该理论的验证表明,不同地区各个类群物种多样性的对数与绝对温度的倒数均呈显著线性关系,方程的斜率也均在预测范围之内。Algar等[25]却认为,物种多样性的对数与绝对温度的倒数不呈线性关系,二者的斜率在不同地区具有很大差异,而非理论所预测的介于 -0.7和 -0.6之间。
在生物多样性代谢理论中结论具有较大差异,可能与该理论的检验有关。以往常用第二类回归和最小二乘回归法分析物种多样性对数与绝对温度倒数之间的关系,这两类回归方法得到的同一方程的斜率却不尽相同:第二类回归得到的方程斜率比最小二乘回归更为陡峭[23]。生物多样性代谢理论是预测某一地理空间内能量对全部物种多样性的影响,而非预测能量对该空间某一特定分类群物种多样性的影响[24]。由于每个科属物种都具有自身最适的温度范围,而且大多数类群物种的温度响应曲线近似钟型,因此不能满足生物多样性代谢理论的基本预测[22]。王志恒等[12]认为,在检验生物多样性代谢理论时只选择某一特定分类群是不合适的。可见,类群的选择可能是造成生物多样性代谢理论检验结果具有较大差异的主要原因之一[26]。
4.2 温度、水分对草地/草甸植被特征的影响
草地是陆地生态系统中分布最为广泛的类型之一,在气候调节和全球碳循环中扮演着十分重要的角色[27]。我国草地地上生物量受降水影响较为显著[28]。相关研究显示,在中国北方草地降水是其地上生物量最主要的制约因子[29]。马文红等[30]对内蒙古温带草地的研究表明,草地植被地上-地下生物量随年降水增加显著增加,随温度升高显著降低;当降水和温度对生物量的影响被控制后,地上生物量受土壤质地和草地类型的影响反而较弱。本研究对青藏高原高寒草甸植被特征与温度、水分因子关系进行的RDA排序分析表明,温度对草甸植被地上部分影响较大,土壤水分对草甸植被地上-地下部分影响均较大,且温度和土壤水分对草甸植被的影响呈极显著正效应,说明在一定范围内温度升高和土壤水分增加均可极显著促进高寒草甸植被生长。在温度方面得到与马文红等[30]不一致的结论,可能与研究区地理位置、植被类型及实验方法有关。可见,温度和水分对草地/草甸不同植被特征产生不同且主要的影响,但草地/草甸地下生物量及其在土壤中的垂直分布格局对环境因子的响应机制并不清楚,需要加深这方面研究。
温度控制着生态系统中许多生物化学反应速率,且几乎影响所有生物学过程[20]。温度升高在一定程度上可以满足植物正常生长所需的热量供应,但同时也改变了植物群落的小气候环境,从而通过多种途径直接或间接影响植物的生长发育及生物量生产[31]。本研究对青藏高原高寒草甸植被特征与温度、水分因子关系进行的通径分析表明,40、60 cm深度土壤水分对植被地上部分产生直接影响,20 cm高度空气相对湿度和40 cm深度土壤温度对其产生间接影响;40 cm深度土壤温度和60 cm深度土壤水分对植被地下部分产生直接影响,红外地表温度对其产生间接影响。可见,土壤水分对高寒草甸植被生物量产生较大影响。增温可通过降低土壤水分减少植被生物量。Boeck等[32]研究表明,增温导致土壤含水量下降,使植被地上、|地下生量分别降低了18%和23%。李英年等[16]研究显示,气候暖干化导致高寒草甸植被总生物量和牧草产量降低。石福孙等[15]研究认为,增温使地下0—30 cm根系生物量出现了不同程度的减少,这主要与增温后土壤相对含水量明显下降有关。增温造成表层土壤干化,使植物根系生长受限或死亡,限制根系生物量。Dubrovsky等[33]研究显示,增温后表层土壤缺水干旱,严重限制根系在表层的生长。Edwards等[34]研究认为,土壤温度升高会增加根系死亡率,降低根系数量和根的聚集程度。因此,植被地上-地下生物量与土壤水分密切相关。高寒草甸地下生物量主要分布在土壤表层,增温会使其向深层转移。李娜等[35]研究发现,受温度升高及土壤含水量减少影响,增温2a后,高寒草甸的生物量分配格局向深层转移,但不明显。本研究也发现,增温1a后,土壤水分有在表层减少、深层增加趋势(图4),这可能与增温导致冻土融化有关。
5 结论
青藏高原高寒草甸植被符合生物多样性代谢理论的第1个假设,但不符合第2个假设。植被物种丰富度的对数与绝对温度的倒数呈显著线性递减关系,即在一定温度范围内植被物种多样性随温度升高而显著增加,且空气-地表-浅层土壤(0—20 cm)温度较深层土壤(40—100 cm)温度对植被物种多样性影响大。该线性关系斜率的变化范围为-1.85— -0.998,换算成植被新陈代谢过程中的平均活化能则为0.998—1.85 eV,高于生物多样性代谢理论预测值0.6—0.7 eV,这是高寒草甸植被对长期低温环境适应进化的结果。
青藏高原高寒草甸植被特征与温度、水分因子关系中,温度对植被地上部分影响较大,而土壤水分对全株影响均较大,适当的增温与降水均可极显著促进高寒草甸植被生长。在所有温度、水分因子中,40 cm、60 cm深度土壤水分和40 cm深度土壤温度对植被影响较大,即40 cm、60 cm深度土壤水分对植被地上部分产生直接影响,20 cm高度空气相对湿度和40 cm深度土壤温度对其产生间接影响;40 cm深度土壤温度和60 cm深度土壤水分对植被地下部分产生直接影响,红外地表温度对其产生间接影响。
本研究发现深层土壤温度和水分对高寒草甸植被具有影响作用,这可能与增温后冻土融化改变了土壤温度、土壤水分及其他因素有关。但由于增温实验时间只有1a,现有的数据还不足以解释这种现象的机理,对于冻土融化如何影响草甸植被生长有待今后深入研究。
致谢:周旭辉教授、于飞海教授、关文彬教授和邵锋副教授对本文的修改和写作给予帮助;顾梦鹤、彭飞、尤全刚、陈勇在实验过程和数据处理中给予帮助,特此致谢。
[1] Brooker R W.Plant-plant interactions and environmental change.New Phytologist,2006,171(2):271-284.
[2] Danby R K,Hik D S.Responses of white spruce(Picea glauca)to experimental warming at a subarctic alpine treeline.Global Change Biology,2007,13(2):437-451.
[3] Bajguz A,Hayat S.Effects of brassinosteroids on the plant responses to environmental stresses.Plant Physiology and Biochemistry,2009,47(1):1-8.
[4] Wang L,Niu K C,Yang Y H,Zhou P.Patterns of above-and belowground biomass allocation in China′s grasslands:evidence from individual-level observations.Science in China Series C:Life Sciences,2010,53(7):851-857.
[5] Mokany K,Raison R J,Prokushkin A S.Critical analysis of root:shoot ratios in terrestrial biomes.Global Change Biology,2006,12(1):84-96.
[6] Yang Y H,Fang J Y,Ma W H,Guo D L,Mohammat A.Large-scale pattern of biomass partitioning across China′s grasslands.Global Ecology and Biogeography,2010,19(2):268-277.
[7] Yang Y H,Rao S,Hu H F,Chen A P,Ji C J,Zhu B,Zuo W Y,Li X R,Shen H H,Wang Z H,Tang Y H,Fang J Y.Plant species richness of alpine grasslands in relation to environmental factors and biomass on the Tibetan Plateau.Chinese Biodiversity,2004,12(1):200-205.
[8] Ma W H,Fang J Y.The relationship between species richness and productivity in four typical grasslands of northern China.Chinese Biodiversity,2006,14(1):21-28.
[9] Yuan Z Y,Chen H Y H.Fine root biomass,production,turnover rates,and nutrient contents in boreal forest ecosystems in relation to species,climate,fertility,and stand age:literature review and meta-analyses.Critical Reviews in Plant Sciences,2010,29(4):204-221.
[10] Hollingsworth T N,Schuur E A G,Chapin F S,Walker M D.Plant community composition as a predictor of regional soil carbon storage in Alaskan boreal black spruce ecosystems.Ecosystems,2008,11(4):629-642.
[11] Kokfelt U,Rosen P,Schoning K,Christensen T R,Forster J,Karlsson J,Reuss N,Rundgren M,Callaghan T V,Jonasson C,Hammarlund D.Ecosystem responses to increased precipitation and permafrost decay in subarctic Sweden inferred from peat and lake sediments.Global Change Biology,2009,15(7):1652-1663.
[12] Wang Z H,Tang Z Y,Fang J Y.Metabolic theory of ecology:an explanation for species richness patterns based on the metabolic processes of organisms.Biodiversity Science,2009,17(6):625-634.
[13] Brown J H,Allen A P,Gillooly J F.Heat and biodiversity.Science,2003,299(5606):512-513.
[14] Wu Q B,Li X,Li W J.The prediction of permafrost change along the Qinghai-Tibet Highway,China.Permafrost and Periglacial Processes,2000,11(4):371-376.
[15] Shi F S,Wu N,Luo P.Effect of temperature enhancement on community structure and biomass of subalpine meadow in Northwestern Sichuan.Acta Ecologica Sinica,2008,28(11):5286-5293.
[16] Li Y N,Zhao L,Zhao Q X,Zhou H K.Effects of a 5-years mimic Temperature Increase to the structure and productivity of kobresia humilis meadow.Acta Agrestia Sinica,2004,12(3):236-239.
[17] Zhao X Q.Alpine Meadow Ecosystem and Global Climate Change.Beijing:Science Press,2009:1-32.
[18] Qi W W,Niu H S,Wang S P,Liu Y J,Zhang L R.Simulation of effects of warming on carbon budget in alpine meadow ecosystem on the Tibetan Plateau.Acta Ecologica Sinica,2012,32(6):1713-1722.
[19] Xu Z F,Yin H J,Zhao C Z,Cao G,Wan M L,Liu Q.A review of responses of litter decomposition in terrestrial ecosystems to global warming.Chinese Journal of Plant Ecology,2009,33(6):1208-1219.
[20] Xu Z F,Hu T X,Zhang L,Zhang Y B,Xian J R,Wang K Y.Short-term gas exchange responses of Betula utilis to simulated global warming in a timber-line ecotone,eastern Tibetan Plateau,China.Chinese Journal of Plant Ecology,2010,34(3):263-270.
[21] Stegen J C,Enquist B J,Ferriere R.Advancing the metabolic theory of biodiversity.Ecology Letters,2009,12(10):1001-1015.
[22] Wang Z H,Brown J H,Tang Z Y,Fang J Y.Temperature dependence,spatial scale,and tree species diversity in eastern Asia and North America.Proceedings of the National Academy of Sciences of the United States of America,2009,106(32):13388-13392.
[23] Hawkins B A,Albuquerque F S,Araújo M B,Beck J,Bini L M,Cabrero-Sanúdo F J,Castro-Parga I,Diniz-Filho J A F,Ferrer-Castán D,Field R,Gómez J,Hortal J,Kerr J T,Kitching I J,León-Cortés J L,Lobo J M,Montoya D,Moreno J C,Olalla-Tárraga M,Pausas J G,Qian H,Rahbek C,Rodríguez M A,Sanders N J,Williams P.A global evaluation of metabolic theory as an explanation for terrestrial species richness gradients.Ecology,2007,88(8):1877-1888.
[24] Allen A P,Brown J H,Gillooly J F.Global biodiversity,biochemical kinetics,and the energetic-equivalence rule.Science,2002,297(5586):1545-1548.
[25] Algar A C,Kerr J T,Currie D J.A test of metabolic theory as the mechanism underlying broad-scale species-richness gradients.Global Ecology and Biogeography,2007,16(2):170-178.
[26] Gillooly J F,Allen A P.Linking global patterns in biodiversity to evolutionary dynamics using metabolic theory.Ecology,2007,88(8):1890-1894.
[27] Scurlock J M O,Johnson K,Olson R J.Estimating net primary productivity from grassland biomass dynamics measurements.Global Change Biology,2002,8(8):736-753.
[28] Bai Y F,Han X G,Wu J G,Chen Z Z,Li L H.Ecosystem stability and compensatory effects in the Inner Mongolia grassland.Nature,2004,431(9):181-184.
[29] Bai Y F,Wu J G,Pan Q M,Huang J H,Wang Q B,Li F S,Alexander B,Han X G.Positive linear relationship between productivity and diversity:evidence from the Eurasian steppe.Journal of Applied Ecology,2007,44(5):1023-1034.
[30] Ma W H,Yang Y H,He J S,Zeng H,Fang J Y.Above-and belowground biomass in relation to environmental factors in temperate grasslands,Inner Mongolia.Science in China Series C:Life Sciences,2008,51(3):263-270.
[31] Aerts R,Cornelissen J H C,Dorrepaal E.Plant performance in a warmer world:general responses of plants from cold,northern biomes and the importance of winter and spring events.Plant Ecology,2006,182(1/2):65-77.
[32] Boeck H J,Lemmens C M H M,Gielen B,Bossuyt H,Malchair S,Carnol M,Merckx R,Ceulemans R,Nijs I.Combined effects of climate warming and plant diversity loss on above-and below-ground grassland productivity.Environmental and Experimental Botany,2006,60(1):95-104.
[33] Dubrovsky J G,North G B,Nobel P S.Root growth,developmental changes in the apex,and hydraulic conductivity for Opuntia ficus-indica during drought.New Phytologist,1998,138(1):75-82.
[34] Edwards E J,Benham D G,Marland L A,Fitter A H.Root production is determined by radiation flux in a temperate grass land community.Global Change Biology,2004,10(2):209-227.
[35] Li N,Wang G X,Yang Y,Gao Y H,Liu L A,Liu G S.Short-term effects of temperature enhancement on community structure and biomass of alpine meadow in the Qinghai-Tibet Plateau.Acta Ecologica Sinica,2011,31(4):895-905.
参考文献:
[4] 王亮,牛克昌,杨元合,周鹏.中国草地生物量地上—地下分配格局:基于个体水平的研究.中国科学:生命科学,2010,40(7):642-649.
[7] 杨元合,饶胜,胡会峰,陈安平,吉成均,朱彪,左闻韵,李轩然,沈海花,王志恒,唐艳鸿,方精云.青藏高原高寒草地植物物种丰富度及其与环境因子和生物量的关系.生物多样性,2004,12(1):200-205.
[8] 马文红,方精云.中国北方典型草地物种丰富度与生产力的关系.生物多样性,2006,14(1):21-28.
[12] 王志恒,唐志尧,方精云.生态学代谢理论:基于个体新陈代谢过程解释物种多样性的地理格局.生物多样性,2009,17(6):625-634.
[15] 石福孙,吴宁,罗鹏.川西北亚高山草甸植物群落结构及生物量对温度升高的响应.生态学报,2008,28(11):5286-5293.
[16] 李英年,赵亮,赵新全,周华坤.5年模拟增温后矮嵩草草甸群落结构及生产量的变化.草地学报,2004,12(3):236-239.
[17] 赵新全.高寒草甸生态系统与全球变化.北京:科学出版社,2009:1-32.
[18] 亓伟伟,牛海山,汪诗平,刘艳杰,张立荣.增温对青藏高原高寒草甸生态系统固碳通量影响的模拟研究.生态学报,2012,32(6):1713-1722.
[19] 徐振锋,尹华军,赵春章,曹刚,万名利,刘庆.陆地生态系统凋落物分解对全球气候变暖的响应.植物生态学报,2009,33(6):1208-1219.
[20] 徐振锋,胡庭兴,张力,张远彬,鲜骏仁,王开运.青藏高原东缘林线交错带糙皮桦幼苗光合特性对模拟增温的短期响应.植物生态学报,2010,34(3):263-270.
[35] 李娜,王根绪,杨燕,高永恒,柳林安,刘光生.短期增温对青藏高原高寒草甸植物群落结构和生物量的影响.生态学报,2011,31(4):895-905.
