黄脊雷蓖蝗越冬卵的滞育发育特性
2013-12-16朱道弘陈艳艳
朱道弘,陈艳艳,赵 琴
(1.中南林业科技大学昆虫行为与进化生态学实验室,长沙 410004;2.湖南第一师范学院动物学实验室,长沙 410205;3.贺州市林业局,贺州 542800)
黄脊雷蓖蝗Rammeacris kiangsu Tsai属直翅目(Orthoptera)网翅蝗科(Arcypteridae)竹蝗亚科(Ceracrinae)雷蓖蝗属Rammeacris Willemse,该属仅已知2种,分布于我国和缅甸[1]。Tsai曾将黄脊雷蓖蝗归为竹蝗属,并命名为黄脊竹蝗 Ceravris Kiangsu Tsai[2]。Willemse根据形态特征,认为应将其归入雷蓖蝗属Rammeacris Willemse[3]。郑哲民和夏凯龄将其移至该属,并更名为黄脊雷蓖蝗Rammeacris kiangsu Tsai[1]。黄脊雷蓖蝗分布于江苏、浙江、安徽、四川、重庆、湖北、湖南、江西、广东、广西、福建、云南等省,主要危害毛竹Phyllostachys pubescens、青皮竹Bambusa textilis等,是我国的重要森林害虫,给竹业生产造成严重的危害[1,4-5]。
滞育是昆虫应对环境条件季节性变化的一种“时间逃避”的适应策略,在昆虫生活史中具有重要的进化意义。一些昆虫进行兼性滞育,在适宜的条件下可连续发育一至数代,而在不宜的条件下进入滞育;也有一些昆虫对周期性变化的环境形成了高度的适应,完全失去了季节节律调控的可塑性,每一世代的特定虫期均进入滞育,为专性滞育[6-10]。滞育可发生在卵期、幼虫期、蛹期或成虫期,卵滞育表现为卵产下后在胚胎期的某个发育阶段的发育停滞,而进入延期发育阶段,或称为滞育发育阶段,这种发育停滞通常是昆虫对母代成虫期或卵期环境条件的反应[11-13]。虽然也有一些分布于温带和亚热带的蝗虫种类以滞育成虫越冬,如Nomadacris succincta 和 Nomadacris japonica[14],长角直斑腿蝗 Stenocatantops splendens[15],但多数种类以滞育卵越冬,如中华稻蝗 Oxya chinensis[16-17],飞蝗 Locusta migratoria[18]。
黄脊雷蓖蝗在其分布区域均1a发生1代,以卵在1—2 cm深的土表下越冬[4-5]。在湖南黄脊雷蓖蝗一般成虫于8—9月产卵,翌年5—6月若虫孵化,卵期长达8个月以上[4]。虽然其生物学及防治技术等已有大量的研究,但尚未见有关其胚胎发育及卵滞育特性的报道。本文调查了黄脊雷蓖蝗卵期温度及低温处理对其卵孵化的影响,检测了恒温条件下胚胎的发育进度及卵粒含水量、过冷却点的变化,以期弄清其卵滞育发育特性。
1 材料与方法
1.1 实验昆虫与饲养方法
黄脊雷蓖蝗的卵块于2005年3月采自湖南桃江(28.5°N,112.1°E),其孵化若虫置于养虫笼(长×宽×高:30 cm×22 cm×30 cm)内(60头/笼),于温度为(25±1)℃、光周期为LD 16:8 h的人工气候室(宁波江南仪器厂,GX-HE302-300)饲养,以栽培的扁穗雀麦Bromus catharticus Vahl.和毛竹的叶片饲养。扁穗雀麦和毛竹枝条插入盛水的广口瓶(100 mL),隔日更换1次。成虫羽化后于相同条件下集团饲养(20—30对/笼),并于养虫笼内放置盛有消毒后河沙的塑料盒(直经16 cm,高9 cm)供成虫产卵。更换饲料时收集所产卵块,获得的卵块作为后续实验的虫源。
1.2 不同温度条件下黄脊雷蓖蝗卵的孵化及低温对其孵化的影响
将黄脊雷蓖蝗45卵块分为3组,产卵当日以卵块为单位转移至垫放有脱脂棉和滤纸的培养皿(直径9 cm)内,分别置于20、25℃和30℃的光照培养箱(韶关科力实验仪器厂,PYX2250G2C)内,定期用洗瓶加水,以保持卵块的湿度。每日检查1次卵的孵化情况,直至产卵后210 d,获得不同温度条件下的孵化曲线。
为调查低温对黄脊雷蓖蝗卵孵化的影响,获得的卵块于25℃保存30 d后,转移至8℃的培养箱内,低温处理30、60、90 d,然后,再转移至25℃。每日检查孵化情况,观察周期为转移至25℃后100 d。
1.3 母代光周期和温度对黄脊雷蓖蝗卵滞育的影响
将黄脊雷蓖蝗的若虫和成虫置于(1)温度为25℃,光周期为LD 16∶8 h或LD 12∶12 h;(2)光周期为LD 12∶12 h,温度为25℃或30℃的条件下按1.1的方法饲养,收集成虫所产卵块。将获得的卵块置于25℃的温度条件下,每日检查卵的孵化情况,调查母代光周期和温度对其卵滞育的影响。
1.4 黄脊雷蓖蝗胚胎的发育进度
产卵当日将卵块置于25℃的温度条件下,每隔5日从不同卵块随机剥离卵粒20粒,以沸腾的Bouin液固定24 h后,以50%的C2H5OH洗涤3次,于70%的C2H5OH中保存。取固定好的卵粒于脱壳液(80%的C2H5OH 10 mL,KOH 2 g,30%的H2O23 mL)内浸泡3—4 min,再以80%的C2H5OH洗涤,于体视显微镜(Olympus,Japan,SZX-7)下用解剖针仔细去除卵壳和细胞基质,获得的胚胎以酒精硼砂洋红染色。取染色后的胚胎于体视显微镜下分别测量胚胎的头幅(两复眼间距离)、触角长度及胚胎体长。
1.5 黄脊雷蓖蝗卵鲜质量和相对含水量的测定
每隔5 d自产卵后保存于25℃的不同的卵块随机选取卵粒60粒,室温风干卵粒表面的水分后,以10粒卵为一组用电子天平(Mettler-Toledo Group,Switzerland,0.1 mg)称其鲜质量。然后,将卵粒放入塑料离心管(1.5 mL)中,以数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂,GZX-9240MBE)95℃烘干12 h。待干燥箱内温度降至室温后,取出卵粒用电子天平称其干质量,计算相对含水量,相对含水量 =[(鲜质量-干质量)/鲜质量]×100%。每组6个重复。
1.6 黄脊雷蓖蝗卵过冷却点的测定
卵块产下后置于25℃的温度条件下,每隔10 d自不同的卵块中取出卵粒30粒,利用热敏电阻测温探头(江苏森意经济发展有限公司,E型)测定卵粒的过冷却点。测定方法:将单个卵粒固定于热敏测温探头上,置于低温冰箱((-28±0.5)℃)内,冰箱内温度以约1℃/min的速度下降,卵粒温度的变化导致探头电阻值随之变化,而获得变化的电压降,经过冷却点测定仪采集数据,计算机自动记录卵粒的温度变化,获得其过冷却点数据。
1.7 数据的统计分析
对各处理孵化前期的数据分析采用t检验(Student's t Test);对胚胎头幅、触角长度和体长,卵粒含水量和鲜质量,卵粒的过冷却点的数据采用StatView 6.0软件分别进行Tukey-Kramer多重比较。
2 结果与分析
黄脊雷蓖蝗的卵块于产卵当日置于不同的温度条件下,温度为20℃时于产卵后156 d开始出现若虫孵化,其后若虫孵化断断续续,在210 d的观察周期内孵化率为77.9%;温度为25℃时,产卵后97 d开始孵化,孵化缓慢且不整齐,至173 d孵化率为92.5%,其后未见若虫孵化;在30℃的温度条件下,产卵后72 d开始孵化,至93 d孵化率为66.0%,未孵化的卵粒经解剖均已死亡(图1)。在3个温度条件下,特别是20℃和25℃的温度下,卵的孵化前期长,且若虫孵化不整齐,孵化期间长,可以认为黄脊雷蓖蝗存在卵滞育现象。
为了检测低温对黄脊雷蓖蝗卵孵化的影响,将其卵块于25℃保存30 d后,转移至8℃低温处理30、60或90 d,再于25℃加温,其孵化率如图2所示。低温处理30 d时,转移至25℃后48 d开始孵化,其后若虫孵化虽然断断续续,但至转移后85 d孵化率达92.5%;低温处理60 d时,转移后29 d开始孵化,至95 d孵化率为79.5%;低温处理90 d时,转移后27 d开始孵化,若虫孵化快速而集中,至39 d孵化率即达83.8%(图2)。低温处理30、60、90 d,卵的孵化前期分别为(70.7 ±7.2),(53.9 ±17.2)和(31.9 ±2.7)d(平均 ±SD),即使包含低温处理前的25℃预处理的30 d,其孵化卵的孵化前期亦显著短于图1中25℃下的孵化前期(1 24.0±20.4)(t-test,各自P<0.001)(图1,图2)。可见低温处理可显著促进黄脊雷蓖蝗卵的孵化,更清晰地证实了其存在卵滞育现象;8℃处理30 d即可明显降低其卵滞育强度,低温处理的时间越长滞育解除的效果越明显,8℃处理90 d可基本解除其滞育。

图1 20℃、25℃和30℃温度条件下黄脊雷蓖蝗卵的孵化Fig.1 Egg hatching at 20℃,25℃,and 30℃ in Rammeacris kiangsu

图2 黄脊雷蓖蝗卵低温处理(8℃)处理30 d(圆圈)、60 d(三角)和90 d(菱形)后25℃温度下的孵化率Fig.2 Egg hatching of Rammeacris kiangsu incubated at 25 ℃after chilling at 8℃ for 30 days(circles),60 days(triangles),and 90 days(diamonds)
2.2 母代光周期和温度对黄脊雷蓖蝗卵滞育的影响
若虫和成虫于温度为25℃,光周期为LD 16∶8 h或LD 12∶12 h的条件下饲养,其所产卵的孵化如图3所示。在长日条件(LD 16∶8 h)和短日条件(LD 12∶12 h)下,分别于产卵后98 d和97 d开始孵化,在150 d的观察周期内其孵化率分别为81.8%和79.4%,孵化卵粒的孵化前期分别为(118.4±10.9)和(116.4±9.5)d,不存在显著差异(t-test,P>0.05)。由于母代光周期不影响黄脊雷蓖蝗子代卵滞育的发生,进而将若虫和成虫于光周期为LD 12∶12 h,温度为25℃或30℃的条件下饲养,调查了母代温度对其子代卵滞育的影响。在25℃和30℃的条件下,所产卵在150 d的观察周期内的孵化率分别为79.1%和79.4%,其产卵前期也无显著差异(t-test,P>0.05)(图3)。说明母代光周期和温度不影响黄脊雷蓖蝗子代的卵滞育发生。
2.3 黄脊雷蓖蝗产卵后胚胎头幅、触角长度及其体长的变化
将黄脊雷蓖蝗的卵块置于25℃的条件下,其胚胎头幅、触角长度及体长的变化如图4所示。产卵后25 d在体视显微镜下能清晰观察到胚胎,此时胚胎头幅为(0.56±0.03)mm(N=6),其后持续增长,至40 d时胚胎头幅达(1.14±0.11)mm(N=15),显著大于25 d时的头幅(Tukey's-test,P<0.05)。此后头幅的增长有一明显的停滞期,产卵后40—75 d的头幅无显著变化(Tukey's-test,P>0.05),至产卵80 d之后头幅再度开始增长。胚胎发育早期未能观察到其触角的分化,产卵后30 d时胚胎的触角长度为(0.25±0.10)mm(N=10),在75 d之前触角长度增长缓慢。产卵80 d之后触角长度恢复增长,至85 d时达(1.84±0.73)mm(N=12),显著长于此前各观察时点的触角长度(Tukey's-test,P<0.05)。与胚胎头幅和触角长度的变化类似,胚胎体长在产卵后75 d之前增长缓慢,有明显的停滞期,80 d之后胚胎长度的增长显著加快(Tukey's-test,P<0.05)(图4)。
2.4 黄脊雷蓖蝗产卵后卵的含水量及鲜质量的变化
在25℃的温度条件下,黄脊雷蓖蝗产卵后10 d内卵粒的含水量稳定在43%左右,无明显的变化(Tukey's-test,P>0.05)。此后其卵粒有一快速的吸水阶段,至产卵后25 d卵粒的含水量达(64.1±2.3)%,含水量显著提高(Tukey's-test,P<0.05)。尔后,卵粒的含水量缓慢提高(图5)。黄脊雷蓖蝗产卵后卵粒的鲜质量变化与含水量类似,产卵后10 d内卵粒的鲜质量为10 mg/卵粒左右,其后与卵粒吸水量快速增加相对应,卵粒的鲜质量亦快速增加,至产卵后25 d达(14.8±1.3)mg。此后,卵粒的鲜质量增加缓慢而不明显(图5)。

图3 母代光周期和温度对黄脊雷蓖蝗卵滞育的影响Fig.3 The effects of maternal photoperiods and temperatures on egg diapause in Rammeacris kiangsu
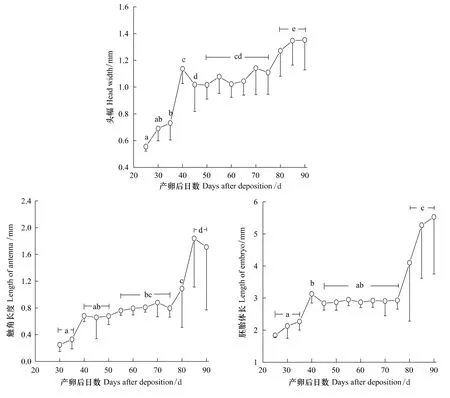
图4 25℃的温度条件下黄脊雷蓖蝗的胚胎发育Fig.4 The embryo development in Rammeacris kiangsu at 25 ℃
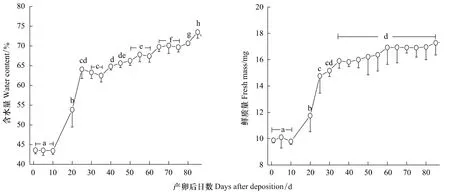
图5 25℃的温度条件下黄脊雷蓖蝗胚胎含水量和鲜质量的变化Fig.5 The changes of embryonic water content and fresh mass in Rammeacris kiangsu at 25 ℃
2.5 黄脊雷蓖蝗产卵后卵粒过冷却点的变化
将黄脊雷蓖蝗的卵于产下当日置于25℃的温度条件下,其过冷却点的变化情况如图6所示。产卵次日和产卵后5 d卵粒的过冷却点分别为(-20.7±5.1)℃(N=27)和(-20.0 ±5.0)℃(N=24),二者间无显著差异(Tukey's-test,P>0.05)。产卵后10—60 d卵粒的过冷却点介于-22.8℃和-24.8℃之间,较产卵初期显著降低(Tukey's-test,P<0.05)。然而,产卵后70 d卵粒的过冷却点较10—60 d显著提高(Tukey's-test,P <0.05),达(-19.5 ±2.9)℃,与产卵初期无显著差异(Tukey's-test,P>0.05)。产卵后第80天卵粒的过冷却点进一步提高,为(-17.3±3.6)℃。

图6 黄脊雷蓖蝗卵期的过冷却点Fig.6 The supercooling pionts of egg stages in Rammeacris kiangsu
3 讨论
黄脊雷蓖蝗在其分布区域均为1a发生1代,以卵越冬[4-5]。本研究的结果显示,产卵后置于不同的温度条件下,黄脊雷蓖蝗卵的孵化前期均较长,且孵化不整齐、孵化期间长。如25℃的温度条件下,其孵化前期达124 d,卵开始孵化至孵化92%需经70 d以上(图1)。昆虫进入滞育到滞育解除的过程,通常称为滞育发育,许多昆虫种类的滞育发育与温度有关,低于发育起点以下的温度有利于滞育发育的快速进行[11]。将黄脊雷蓖蝗的卵块进行30、60或90 d的低温处理可显著促进其卵的孵化(图2)。可见黄脊雷蓖蝗的卵存在滞育现象,低温能明显降低其卵滞育强度,低温处理的时间越长滞育解除的效果越明显。此外,其滞育发生不受母代光周期和温度的影响(图3),显然作为一化性的昆虫种类,黄脊雷蓖蝗的卵滞育属于专性滞育。
将黄脊雷蓖蝗的卵置于25℃的温度条件下,产卵后100 d前后开始孵化。滞育卵长时间地置于不同于自然越冬条件的较高的温度条件下(如25℃),其滞育强度会逐渐降低,而恢复发育,如中华稻蝗[17],飞蝗[19]。对保存于25℃的卵粒进行解剖,其胚胎头幅、触角长度及体长的测量结果显示,产卵后40 d前胚胎持续发育,其后有一明显的发育停滞期,至产卵后80 d胚胎再度开始发育(图4),与相同温度条件下卵的孵化情况基本吻合。因此,25℃温度条件下的黄脊雷蓖蝗胚胎发育可划分为3个阶段,即前期的持续发育阶段、中期的发育停滞阶段和后期的发育恢复阶段。在前期的发育阶段,其卵尚未进入滞育期(即胚胎仍处于发育阶段);产卵后40 d左右进入滞育,40—75 d的发育停滞阶段可视为卵的深度滞育期;产卵后80 d左右开始恢复发育,但卵粒间的胚胎发育程度差异较大,发育极不整齐,此时可称为后滞育期。许多产卵于土壤中的昆虫种类在胚胎发育过程中,卵粒需要吸收外界的水分。发生滞育的卵粒吸水可划分为3种类型:(1)卵粒本身含充足的水分进行胚胎发育,不需吸水,如家蚕Bombyx mori;(2)于进入滞育前,吸收后滞育发育必要的大部分水分,如澳洲黑蟋蟀Teleogryllus commodus;(3)滞育解除后吸水,如豆长刺萤叶甲Atrachya menetriesi[20]。黄脊雷蓖蝗的卵粒产下后水分含量较低,约为43%,在25℃的温度条件下于产卵后25 d前后有一快速的吸水阶段,其后卵粒的含水量增加缓慢(图4)。很显然,黄脊雷蓖蝗卵粒的吸水发生在进入滞育之前。
滞育的作用之一是提高昆虫耐受极端环境条件的能力,但在不同的昆虫种类中滞育和耐寒性的关联性存在差异[11,21-22]。一些种类的耐寒性与滞育不存在相关性,二者为独立或部分独立进化的特征,如Achaearanea tepidariorum[23]和Calliphora vicina[24]。一些种类耐寒性的提高与滞育发生密切相关,如Graphosoma lineatum滞育阶段的耐寒性显著提高[25],而滞育是Pyrrhocoris apterus过冷却点降低的必备条件[26]。在25℃的温度条件下,黄脊雷蓖蝗卵粒过冷却点的变化亦包含3个阶段,即胚胎发育初期的较高阶段、中期持续而稳定的较低阶段、后期的提升阶段(图6),与其滞育的发生基本吻合。因此,可以认为黄脊雷蓖蝗越冬卵耐寒性的提高与其滞育的发生密切相关。
[1] Zheng Z M,Xia K L.Fauna Sinica:Insecta,Volume 10(Orthoptera:Acridoidea).Beijing:Science Press,1998:238-239.
[2] Tsai P H.Descriptions of three new species of Acridids from China,with a list of the species hither to recorded.Journal of the College of Agriculture,Imperial University of Tokyo,1929,10(2):139-149.
[3] Willemse C.Synopsis of the Acridoidea of the indo-malayan and adjacent regions(Insecta,Orthoptera)part 1.Fam.Acridae,subfam.Acridinae.Publicaties van het Natuurhistorisch Genootschap in Limburg,1951,4:41-114.
[4] Lian Y M,Zhong W H,Liu X W,Wen J H,Hu Q H.An observation on fecundity of Ceracris kiangsu Tsai at Taojiang County in Hunan.Hunan Forestry Science and Technology,2009,36(4):37-39.
[5] Cheng J,Pan Y Z,Shu J P.The research and development of the Ceracris kiangsu Tsai.Journal of Shandong Forestry Science and Technology,2010,(2):116-119.
[6] Roff D.Optimizing development time in a seasonal environment-the ups and downs of clinal variation.Oecologia,1980,45(2):202-208.
[7] Tauber M J,Tauber C A,Obrycki J J,Gollands B,Wrught R J.Geographical variation in response to photoperiod and temperature by Leotinotarsa decemlineata during and after dormancy.Annals of the Entomological Society of America,1988,81(5):764-773.
[8] Hunter M D,McNeil J N.Geographic and parental influences on diapause by a polyphagous insect herbivore.Agricultural and Forest Entomology,2000,2(1):49-55.
[9] Schmidt P S,Matzkin L,Ippolito M,Eanes W F.Geographic variation in diapause incidence,life-history traits and climatic adaptation in Drosophila melanogaster.Evolution,2005,59(8):1721-1732.
[10] Nation J L.Insect Physiology and Biochemistry,2nd ed.Boca Raton:CRC Press,2008.
[11] Tauber M J,Tauber C A,Masaki S.Seasonal Adaptations of Insects.New York:Oxford University Press,1986.
[12] Danks H V.Insect dormancy:an ecological perspective//Biological Survey of Canada Monograph Series No.2,Biological Survey of Canada(Terrestrial Arthropods).Ottawa,1987.
[13] Olvido A E,Busby S,Mousseau T A.Oviposition and incubation environmental effects on embryonic diapause in a ground cricket.Animal Behavior,1998,55(2):331-336.
[14] Tanaka S,Okuda T.Life cycles,diapause and developmental characteristics in subtropical locusts,Nomadacris succincta and N.japonica(Orthoptera:Acrididae).Japanese Journal of Entomology,1996,64(1):189-201.
[15] Zhu D H,Cui S S,Fan Y S,Liu Z W.Adaptive strategies of overwintering adults:Reproductive diapause and mating behavior in a grasshopper,Stenocatantops splendens(Orthoptera:Catantopidae).Insect Science,2012,doi:10.1111/j.1744-7917.2011.01493.x.
[16] Zhao Q,Zhu D H,Yang Y P,Tan R H.Variation of embryonic diapause intensity and life-cycle pattern in five geographic populations of the Chinese rice grasshopper,Oxya chinensis(Orthoptera:Acridoidea:Catantopidae)from China.Acta Entomologica Sinica,2009,52(2):183-190.
[17] Zhu D H,Yang Y P,Liu Z W.Reversible change in embryonic diapause intensity by mild temperature in the Chinese rice grasshopper,Oxya Chinensis Thunberg(Orthopetera:Catantopidae).Entomologia Experimentalis et Applicata,2009,133(1):1-8.
[18] Tanaka S,Zhu D H.Geographic variation in embryonic diapause,cold-hardiness and life cycles in the migratory locust,Locusta migratoria,(Orthoptera:Acrididae)in China.Entomological Science,2008,11(3):327-339.
[19] Ando Y.Thermal response and reversibility of diapause in the eggs of Locusta migratoria.Physiological Entomology,1993,18(1):1-6.
[20] Ando Y.Egg diapause and water absorption in the false melon beetle,Atrachya menetriesi Faldermann(Coleoptera:Chrysomelidae).Applied Entomology and Zoology,1972,7(3):142-154.
[21] Denlinger D L.Relationship between cold hardiness and diapause//Lee R E,Denlinger D L,eds.Insects at Low Temperature.New York:Chapman and Hall,1991:174-198.
[22] Hodkova M,Hodek I.Photoperiod,diapause and cold-hardiness.European Journal of Entomology,2004,101(3):445-458.
[23] Tanaka K.Evolutionary relationship between diapause and cold hardiness in the house spider,Achaearanea tepidariorum(Araneae:Theridiidae).Journal of Insect Physiology,1997,43(3):271-274.
[24] Hayward S A,Saunders D S.Geographical and diapause-related cold tolerance in the blow fly,Calliphora vicina.Journal of Insect Physiology,1998,44(7/8):541-551.
[25] Šlachta M,Vambera J,Zahradnǐ cˇková H,Košt'ál V.Entering diapause is a prerequisite for successful cold-acclimation in adult Graphosoma lineatum(Heteroptera:Pentatomidae).Journal of Insect Physiology,2002,48(11):1031-1039.
[26] Hodkova M,Hodek I.Temperature regulation of supercooling and gut nucleation in relation to diapause of Pyrrhocoris apterus(L.)(Heteroptera).Cryobiology,1997,34(1):70-79.
参考文献:
[1] 郑哲民,夏凯龄.中国动物志:昆虫纲第十卷直翅目蝗总科.北京:科学出版社,1998:238-239.
[4] 练佑明,钟武洪,刘湘斌,文介华,胡庆华.湖南桃江黄脊竹蝗产卵量观察与研究.湖南林业科技,2009,36(4):37-39.
[5] 程佳,潘涌智,舒金平.黄脊竹蝗研究现状及进展.山东林业科技,2010,(2):116-119.
[16] 赵琴,朱道弘,阳艳萍,谭荣鹤.中华稻蝗五地理种群的卵滞育强度及生活史模式变异.昆虫学报,2009,52(2):183-190.
