光照和生长阶段对菖蒲根系泌氧的影响
2013-12-16王文林王国祥万寅婧唐晓燕
王文林,王国祥,万寅婧,夏 劲,唐晓燕,陈 昕,梁 斌,庄 巍
(1.南京师范大学地理科学学院/江苏省环境演变与生态建设重点实验室,南京 210023;2.环境保护部南京环境科学研究所,南京 210042;3.江苏省环境工程咨询中心,南京 210029)
湿地植物根系泌氧具有十分重要的意义,一方面形成根际氧化、还原异质环境,有利于污染物的吸收降解[1-3],另一方面使根系附近还原性物质得到氧化[4],促进湿地植物在根表形成铁锰氧化物膜[5],有利于保护根部渗透性膜系统及其功能的发挥[6]。光照被认为是影响湿地植物根系泌氧的重要因素[7-8],其研究也日益得到关注。Emmal[7]和 Water[9]分别发现光照能提高芦苇(Phragmites communis)和水稻(Oryza sativa L.)的根系泌氧能力,Tomomi[10]则发现光照能显著提高香蒲(Typha orientalis)的根系泌氧能力,对狭叶香蒲(Typha angustifolia L.)则没有影响。但以上研究均集中于光照对植物某一生长阶段根系某一部位的根系泌氧能力的影响,而湿地植物生长阶段的差异、根系不同部位的组织结构、生物功能等特性均可能会影响泌氧效果[11],目前关于光照及生长阶段对湿地植物根系不同部位的泌氧影响研究鲜见报道。
根际微界面氧化层厚度往往只有数毫米[12-13],其内部环境因子定量测定比较困难,因而上述相关研究均采用圆筒状金属铂电极技术、柠檬酸钛比色、蒽醌自由基负离子法等异位测定技术[7,9-10],往往不能反映湿地植物根际在沉积物中的泌氧效应真实状况。溶氧微电极技术的发展能够原位测定湿地植物根际微界面溶氧的微时空分布,真实反映微界面溶氧特征,使进而探讨根系泌氧作用及其对污染物的影响成为可能。
本实验以自然湖泊沉积物为研究基质,利用微型电机控制溶氧微电极实现纵向精确微位移,在照光与遮光条件下,对典型湿地植物菖蒲幼苗、成株根系微界面径向溶氧变化进行原位精确测定,真实反映光照及植物生长阶段对根系-沉积物微界面溶氧特征的影响,揭示根系径向泌氧变化规律,为富营养化水体植物生态修复及污染控制提供理论依据。
1 材料与方法
1.1 实验植株培养
选用典型湿地植物菖蒲(Acorus calamus),一种多年生湿生草本植物,广泛分布于温带、亚热带地区,我国各地均有分布,生长于池沼、河岸、河溪边等季节性和非周期性水位埋深变化较大的浅水区域[14]。2012年6月,在南京师范大学水环境生态修复平台玻璃温室中,将越冬的菖蒲块茎置于沉积物(沉积物取自南京城东一小型富营养化湖泊(32°06'10.36″N,118°54'13.75″E)表层底泥)中培养,平均培养温度 29.5℃,最后根据实验需求选择萌发水平一致的菖蒲作为实验用植物。
1.2 实验设计
2012年6月29日,从已萌发的菖蒲中选择株高12cm左右的菖蒲3株(3个重复),小心剥离根系沉积物后种植于1个0.5×0.5m实验盆中,沉积物使用培养菖蒲块茎时所用沉积物,覆泥深度12cm,定期加蒸馏水使其刚好覆盖沉积物,最后将实验盆置于光照培养箱中培养,培养箱外蒙上遮光布,培养条件为6:00—18:00 3000lx光照强度,18:00—翌日6:00停止照光,培养温度25℃,实验开始后定期测定菖蒲株高、叶宽。
7月3日,在菖蒲平均株高约15cm时(作为幼苗处理),在3株待测菖蒲中各选择1个根(根长约6cm)作为测定根,在照光(光强强度3000lx(Light))及遮光(Dark)条件下,测定离根基部1.5cm处(根1/4)、3.0cm处(根1/2)、4.5cm处(根3/4)和根尖处(根1)根系微界面径向溶氧浓度的变化;7月27日,在菖蒲平均株高约60cm时(作为成株处理),在照光及遮光条件下,再次测定幼苗时期选定的3个测定根(根长约11cm)离根基部2.7cm处(根1/4)、5.5cm处(根1/2)、8.2cm处(根3/4)和根尖处(根1)根系微界面径向溶氧浓度的变化。每次测定时,照光处理组测定时间为12:00,遮光处理组测定时间为24:00。此外,还同时测定根长及不同部位根直径等生长指标,以上指标取3个测定根平均值作比较,测定在光照培养箱中进行。
1.3 溶氧微电极测定
菖蒲测定根不同部位表面径向溶氧浓度变化由氧气微电极测定(clark-type O2-electrode,直径25μm,Unisense,Germany)。每次测定前,小心取出菖蒲待测根,拉直后固定在小型支架上,然后操纵装置将溶氧微电极定位到根测定部位表面处,再将实验盆内表层沉积物小心覆盖测定根,覆盖厚度1cm,稳定30min[13],然后操纵溶氧微电极反向位移,记录位移距离(程序自动记录),操纵溶氧微电极反向位移20μm/次,测定根际表面以上径向溶氧浓度,待溶氧浓度为零时停止测定,此时反向位移距离即为根系氧扩散层厚度。
1.4 试验用的沉积物特性
菖蒲幼苗、成株测定时(7月3日、27日)用于覆盖测定根的沉积物均为实验盆内表层底泥,在进行理化性质分析后得知,两者基本无差异(表1)。
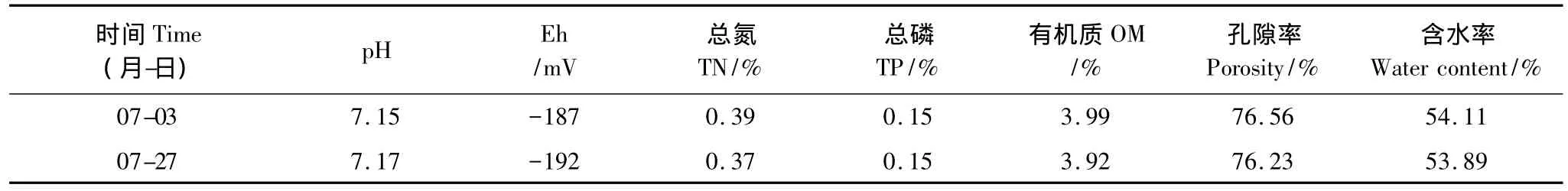
表1 沉积物理化性质比较Table 1 The comparison of sediment physical and chemical properties
1.5 菖蒲叶片叶绿素光化荧光参数的测定
7月3日、7月27日7:00,使用水下饱和脉冲荧光仪DIVING PAM(德国WALZ公司)和数据采集软件wincontrol原位测定菖蒲叶片叶绿素光化荧光参数,每一重复处理随机选择1片叶片的中上部位测定叶绿素荧光参数值,取3个重复的平均值作比较。叶片使用叶夹遮光处理(暗适应)5min后,打开叶夹,然后开启光强度为30 μmol光子m-2s-1的光化光,照射叶片10s后,再开启饱和脉冲光(饱和脉冲光强度4000μmol光子m-2s-1,持续时间0.8s)测得光化荧光参数Yield[15]。Yield表示在照光下PSⅡ的实际光化学效率,反映吸收的光子供给PSⅡ反应中心的效率,在低光强下,实际光化学效率的高低直接决定叶片光合速率的高低[16]。
1.6 统计分析
采用SPSS 13.0统计软件对实验数据进行处理和分析。菖蒲幼苗、成株的生长指标,根系每个测定点在菖蒲不同生长阶段、不同光照条件下以及各个测定点之间的氧饱和度、氧扩散层厚度差异采用单因素方差分析(one way ANOVA)和Tukey多重比较的统计方法,极显著水平设置为α=0.01、显著性水平设置为α=0.05。采用Microsoft Excel软件制作图表。
2 结果与分析
2.1 菖蒲幼苗、成株长势及光合作用能力比较
菖蒲幼苗、成株长势见表2,菖蒲成株株高、叶宽、平均根长、根直径均显著高于菖蒲幼苗(P<0.01);从根系发育上看(图1),菖蒲幼苗根系不同部位根直径差异较小,具体表现为根1/4≈根1/2>根3/4≈根1(P<0.05,P>0.05),而菖蒲成株则差异较大,表现为根 1/4>根 1/2>根3/4>根1(P<0.05);由表2 还可知,菖蒲幼苗、成株叶片yield值无显著差异(P>0.05),表明二者叶片光合速率无显著差异。
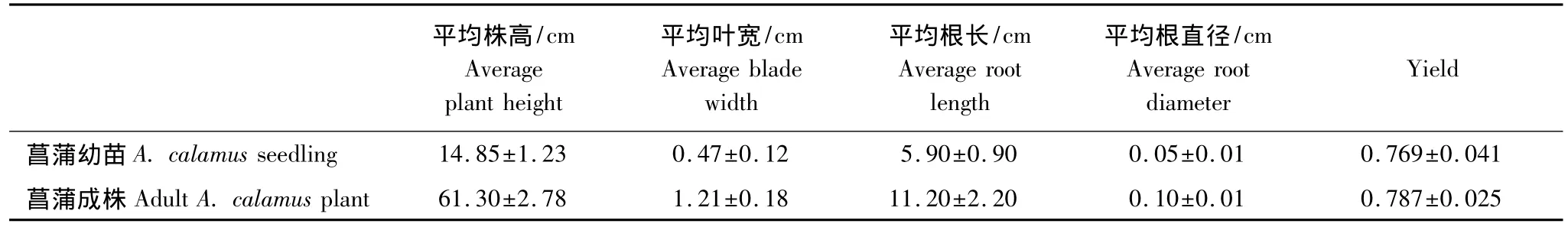
表2 菖蒲幼苗和成株长势及光合作用能力Table 2 Plant growth and chlorophyll fluorescence parameters of A.calamus seedling and adult A.calamus plant

图1 菖蒲幼苗、成株根不同部位直径Fig.1 The diameter of different root parts of A.calamus seedling and adult A.calamus plant
2.2 生长阶段对菖蒲根系泌氧影响
如图2,无论有无光照,除根1/4处外,其余根不同部位氧扩散能力菖蒲成株较幼苗均显著增强(P<0.01),遮光处理组增强幅度弱于照光处理组。遮光处理时,幼苗根1/2、根3/4、根1处氧扩散层厚度、最大氧饱和度由 0.3、0.28、0.24mm 和 3.5%、4.0%、3.1% 增加到成株的 0.38、0.34、0.36mm 和 21.5%、12.5%、11.6%,照光处理时,幼苗根1/2、根3/4、根1处氧扩散层厚度、最大氧饱和度由 0.4、0.32、0.26mm 和 6.4%、3.6%、4.1% 增加到 0.68、0.52、0.46mm 和 42.9%、22.5%、10.2%。而在照光、遮光处理时,菖蒲幼苗根1/4处氧扩散层厚度、最大氧饱和度与菖蒲成株相比无显著差异(P>0.05)。
2.3 光照对菖蒲幼苗根系泌氧影响
氧扩散层厚度及氧饱和梯度可直接反映根系泌氧能力[17],如图2,无论有无光照,菖蒲幼苗根系不同部位均存在从根表面至沉积物氧饱和度由高到低的氧扩散层,照光条件下氧扩散层厚度为0.26—0.40mm,最大氧饱和度为6.4%;遮光条件下氧扩散层厚度为0.24—0.30mm,最大氧饱和度为4.1%。
如图2、图3,光照对菖蒲幼苗根系不同部位氧扩散能力的影响存在差异,照光处理根1/2处氧扩散能力显著强于遮光处理(P<0.01),氧扩散层厚度及最大氧饱和度分别为0.40mm和6.4%,为遮光处理的1.18倍和1.83倍;而菖蒲幼苗根1/4、根3/4、根1处,照光处理与遮光处理相比,氧扩散能力则无显著性差异(P>0.05)。
从根系泌氧空间差异上看(图2,图3,表3),照光处理时,菖蒲幼苗具体表现为根1/2>根3/4≈根1≈根1/4(P<0.01,P>0.05),而遮光处理时,菖蒲幼苗根系不同部位氧扩散能力则无显著性差异(P>0.05)。
2.4 光照对菖蒲成株根系泌氧影响
如图2,无论有无光照,菖蒲成株根系不同部位均存在从根表面至沉积物氧饱和度由高到低的氧扩散层,照光条件下氧扩散层厚度为0.18—0.68mm、最大氧饱和度为42.9%,遮光条件下氧扩散层厚度为0.22—0.38mm、最大氧饱和度为 21.5%。

图2 光照对菖蒲幼苗、成株根不同部位氧扩散能力的影响Fig.2 The influence of light on oxygen diffusion capacity in different root part of A.calamus seedling and adult A.calamus plant
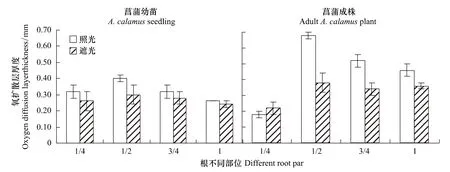
图3 光照对菖蒲幼苗、成株根不同部位氧扩散层厚度的影响Fig.3 The influence of light on oxygen diffusion layer thickness in different root part of A.calamus seedling and adult A.calamus plant

表3 光照对菖蒲幼苗、成株根不同部位氧扩散能力差异性影响Table 3 The influence of light on significant differences of oxygen diffusion capacity in different root part of A.calamus seedling and adult A.calamus plant
如图2、图3,光照对菖蒲成株根系不同部位氧扩散能力影响存在差异,照光处理根1/2、根3/4处氧扩散能力显著强于遮光处理(P<0.01),根1/2处氧扩散层厚度及最大氧饱和度分别为0.68mm和42.9%,为遮光处理的1.79倍和2倍,根3/4处氧扩散层厚度及最大氧饱和度分别为0.52mm和22.5%,为遮光处理的1.53倍和1.8倍;根1/4、根1处,照光处理与遮光处理相比氧扩散能力则无显著性差异(P>0.05)。
从根系泌氧空间差异上看(图2,图3,表3),照光处理时,菖蒲成株氧扩散能力具体表现为根1/2>根3/4>根1>根1/4(P<0.01),氧扩散层厚度及最大氧饱和度分别为 0.68、0.52、0.46、0.18mm 和 42.9%、22.5%、10.2%、6.4%;遮光处理时,菖蒲成株氧扩散能力具体表现为根 1/2>根 3/4≈根 1>根 1/4(P<0.01,P>0.05),氧扩散层厚度及最大氧饱和度分别为 0.38、0.34、0.36、0.22mm 和 21.5%、12.5%、10.6%、5.3%。
3 讨论
已有研究表明,在白天,湿地植物茎叶的光合作用放氧是植物体内氧的最重要的供给机制,茎叶生物量及光合作用效率决定植株的光合产氧量及通气量[3],植株光合作用产生的氧气,一部分直接释放到空气或水中,一部分供自身呼吸作用消耗,还有一部分通过植物的通气组织向下输送到根系,并经由根系向底泥中释放,而在夜间光合作用无法进行时,植物茎叶的气体交换作用则能将大气中的氧气通过植物叶表面、茎杆等的孔隙进入植物体内,供植株呼吸或输送释放到底泥以维持根区的氧化状态[18-20],这也与实验中,无论有无光照,菖蒲幼苗、成株根系不同部位均存在从根表面至沉积物氧饱和度由高到低的氧扩散层的结果相一致。
实验结果发现,在菖蒲幼苗、成株叶片光合速率无显著差异的情况下,无论有无光照,除根1/4处外,其余根不同部位氧扩散能力菖蒲成株较幼苗均显著增强(P<0.01),这主要与茎叶光合作用、通气作用面积显著增加有关,菖蒲成株株高、叶宽均显著高于菖蒲幼苗(P<0.01)(表2),此外,根系泌氧还与根系生物量密切相关[21],菖蒲成株平均根长、根直径均显著高于菖蒲幼苗(P<0.01)(表2),根系泌氧面积显著增加。而菖蒲幼苗根1/4处氧扩散层厚度、最大氧饱和度与菖蒲成株相比无显著差异(P>0.05)则可能与根基产生泌氧屏障(ROL barrier)有关,湿地植物在缺氧的底质环境中,植物为了保证氧气能够扩散到根尖区域,在根基区产生泌氧屏障[1],通常在根表和皮层之间存在若干层厚壁细胞,避免大量的氧气在运输过程中通过根轴向沉积物扩散,并有利于抑制沉积物中过量的有毒物质通过根被植物吸收,起到脱毒作用,根系表现出根基部泌氧较根其它部位明显减少,且趋于稳定[22]。
光照增强了植物的光合作用和蒸腾作用[23-24],蒸腾作用增强了植物内部的高湿度,同时加大了湿度诱导的压强梯度和加快了气体从大气中进入植物体内。植物体内温度升高,提高了热力学诱导渗透作用,加快了气体对流速度,而这些均可以增加根系泌氧量[24],实验结果也发现,菖蒲幼苗根1/2处、菖蒲成株根1/2、根3/4处氧扩散能力照光处理显著高于遮光处理(P<0.01),但照光对菖蒲幼苗、成株根其它部位氧扩散能力则无显著性影响(P>0.05),根基(根1/4处)泌氧屏障能有效减弱光照对其泌氧影响,而根尖(根1处)照光处理与遮光处理氧扩散能力无显著差异则可能与植物的夜间生长机制有关,有研究表明植物在夜间依然能保持较高的生长速率[25],为此植株夜间可能通过给根尖供氧,保持适宜的氧饱和度促进细胞分裂伸长、保持呼吸作用和代谢速率。照光对菖蒲幼苗根3/4处泌氧无影响则可能与菖蒲幼苗根系尚在发育阶段、根3/4处具有根尖(根1处)的相关功能有关,实验结果也表明其根直径(0.04cm)与根1处(0.03cm)相比无显著差异(图1)。
从根系泌氧空间差异上看,照光条件下菖蒲幼苗、成株分别表现为根1/2>根3/4≈根1≈根1/4(P<0.01,P>0.05)和根1/2>根3/4>根1>根1/4(P<0.01),遮光条件下菖蒲幼苗、成株分别表现为根1/2≈根 3/4≈根 1≈根1/4(P>0.05)和根1/2>根3/4≈根1>根1/4(P<0.01,P>0.05)。除根1/4 处泌氧能力最小主要与其产生泌氧屏障相关外,根其它部分空间差异可能与根系生物量差异有关,通过对不同部位根系直径发育情况分析发现(图1),作为根茎型植物的菖蒲,其根系靠近基部部分直径显著高于靠近根尖部分,菖蒲成株根1/2、3/4、根1的直径为根1/4的86.7%、53.3%、26.7%(图1),导致靠近根尖处根系泌氧面积显著下降,进而影响根系泌氧扩散范围,通过对菖蒲幼苗、成株在照光、遮光条件下根1/2、根3/4、根1处最大氧饱和度与根直径进行相关性分析后发现(图4),菖蒲成株在照光、遮光条件下均呈显著正相关,而菖蒲幼苗在照光条件下呈正相关,遮光条件下不相关,表明根系泌氧能力越强,根系泌氧空间差异受根系生物量差异影响就越显著,相反,根系生物量差异将不会导致根系泌氧空间差异,如菖蒲幼苗在遮光条件下根系不同部位氧扩散能力无显著性差异(P>0.05)。
4 结论
无论有无光照,菖蒲幼苗、成株根系不同部位均存在从根表面至沉积物氧饱和度由高到低的氧扩散层,氧扩散层厚度在0.18—0.68mm间变化;根1/2、3/4、1处氧扩散能力菖蒲成株较幼苗显著增强(P<0.01),根1/4处二者则无显著差异(P>0.05);光照对菖蒲幼苗、成株根系不同部位氧扩散能力的影响存在差异,光照对菖蒲幼苗根1/2及菖蒲成株根1/2、根3/4处影响显著(照光组显著高于遮光组,P<0.01),而对菖蒲幼苗根1/4、根3/4、根1及菖蒲成株根1/4、根1处无显著影响(P>0.05);从根系泌氧空间差异上看,照光条件下菖蒲幼苗、成株分别表现为根1/2>根3/4≈根1≈根1/4(P<0.01,P>0.05)和根 1/2>根 3/4>根 1>根 1/4(P<0.01),遮光条件下菖蒲幼苗、成株分别表现为根1/2≈根3/4≈根1≈根1/4(P>0.05)和根1/2>根3/4≈根1>根1/4(P<0.01,P>0.05)。
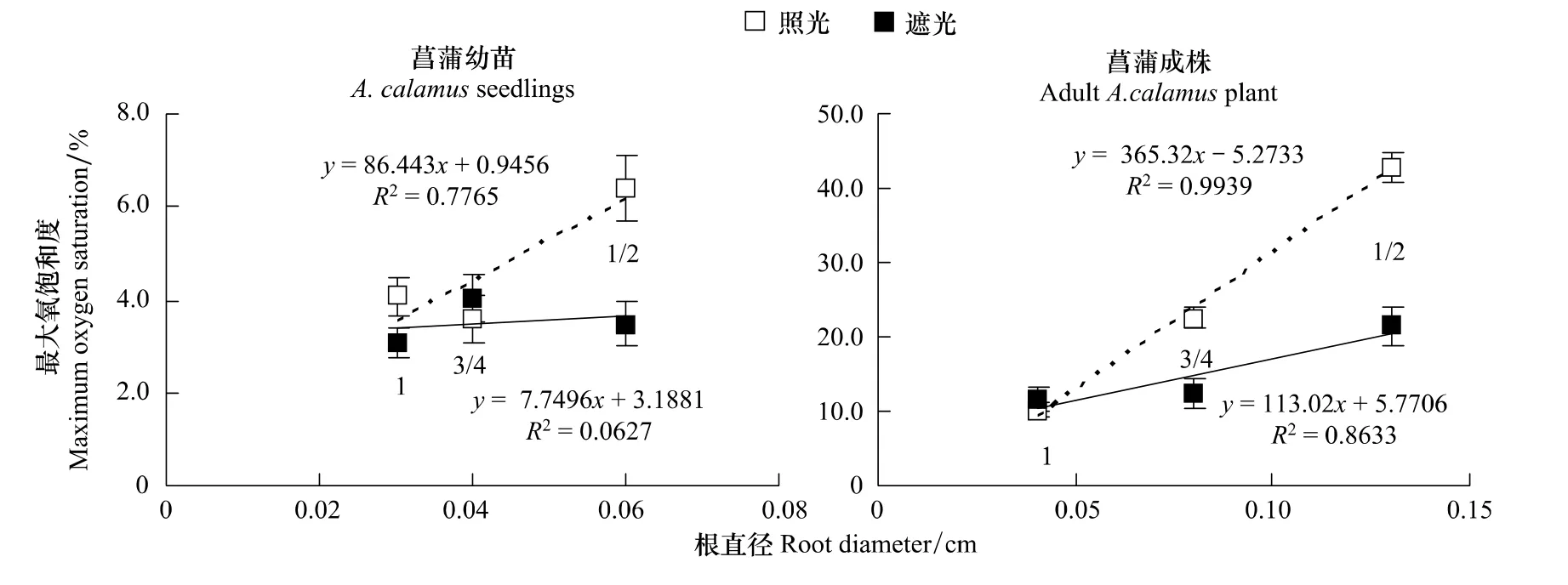
图4 菖蒲幼苗、成株在照光、遮光条件下根1/2、根3/4、根1处最大氧饱和度与根直径的相关性Fig.4 Correlation between maximum oxygen saturation and root diameter in root 1/2,3/4,1 of A.calamus seedling and adult A.calamus plant under light or dark condition
[1] Armstrong W.Aeration in higher plants.Advances in Botanical Research,1979(7):225-332.
[2] Gilbert B,Fenzel P.Rice roots and methane oxidation:the activity of bacteria,their distribution and the microenvironment.Soil Biology and Biochemistry,1998,30:1903-1916.
[3] Visser E J W,Comler T D,Blom C P W M,et al.Changes in growth,porosity,and radial oxygen loss from adventious roots of selected mono-and dicotyledonous wetland species with contrasting types of aerenchyma.Plant,Cell and Environment,2000,23:1237-1245.
[4] Mendelssohn I A,Kleiss B A,Wakeleyj S.Factors controlling the formation of oxidized root channels:a review.Wetlands,1995,15:37-46.
[5] Hansel C M,Fendorf S,Sutton S.Characterization of Fe plaque and associated metals on the roots of Mine-waste impacted aquatic plants.Environmental Science and Technology,2001,35:3863-3868.
[6] Armstrong J,Armsrtong W,Beckeet P M.Phramites australlis:Venturi-and humidity-induced convections enhance rhizome aeration and rhizosphere oxidation.New Phytologist,1992,120:197-207.
[7] Connell E L,Colmer T D,Walker D I.Radial oxygen loss from intact roots of Halophila ovalis as a function of distance behind the root tip and shoot illumination.Aquatic Botany,1999,63(3):219-228.
[8] Flessa H.Plant-induced changes in the redox potential of the rhizosphere of the submerged vascular macrophytes Myriophyllum verticillatum L.and Ranunculus circinatus.Aquatic Botany,1994,47:119-129.
[9] Waters I,Armstrong W,Thompson C J.Diurnal changes in radial oxygen loss and ethanol metabolism in roots of submerged and non-submerged rice seedlings.New Phytologist,1989,113(4):439-451.
[10] Inoue T M,Tsuchiya T.Interspecific differences in radial oxygen loss from the roots of three Typha species.Limnology,2008,9(3):207-211.
[11] Deng H,Ye Z H,Huang M H.Characteristics of radial oxygen loss from root of wetland plants.Journal of East China Normal University(Natural Science),2007,6:69-76.
[12] Sand-Jensen K,Revsbech N P,Barker Jørgensen B.Microprofiles of oxygen in epiphyte communities on submerged macrophytes.Marine Biology,1985,89(1):55-62.
[13] Laskov C,Horn O,Hupfer M.Environmental factors regulating the radial oxygen loss from roots of Myriophyllum spicatum and Potamogeton crispus.Aquatic Botany,2006,84(4):333-340.
[14] Lu D M.Hydrophytic Biology of Freshwater.Suzhou:Suzhou University Press,2002.46.
[15] Bilger W,BjÊrkman O.Role of the xanthophyll cycle in photoprotection elucidated by measurements of light induced absorbance changes,fluorescence and photosynthesis in leaves of Hedera canariensis.Photosynth Res,1990,25:173-185.
[16] Schreiber U,Bilger W,Neubauer C.Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis.Ecol Studies,1994,100:49-70.
[17] Colmer T D.Long-distance transport of gases in plants:aperspective on internal aeration and radial oxygen loss from roots.Plant Cell and Environment,2003,26(1):17-36.
[18] Woolhouse H W W.Advances in Botanical Research,Vol.7 London:Academic Press 1979,225-332.
[19] Grosse W,Buchel H B,Tiebel H.Pressurized ventilation in wetland plants.Aquatic Botany,1991,39:89-98.
[20] Brix H,Sorrell B K,Orr P T.Internal pressurization and convective gas flow in some emergent freshwater macrophytes.Limnol.Oceanogr,1992,37:1420-1433.
[21] Cheng S P,Wu Z B,Xia Y C.Review on gas exchange and transportation in macrophytes.Acta Hydrobiologica Sinica,2003,(4):413-417.
[22] Armstrong J,Armstrong W.Rice and Phragmites:Effects of organic acids on growth root permeability and radial oxygen loss to the rhizosphere.American Journal of Botany,2001,88:1359-1370.
[23] Caffrey J M,Kemp W M.Seasonal and spatial patterns of oxygen production,respiration and root rhizome release in potamogeton-perfoliatus I and zostera-marina L.Aquatic Botany,1991,40(2):109-128.
[24] Frenzel P,Rothfuss F,Conrad R.Oxygen profiles and methane turnover in a flooded rice microcosm.Biology and Fertility of Soils,1992,14(2):84-89.
[25] Shimizu H,Heins R D.Computer-vision-based system for plant growth analysis.Transactions of the ASAE,1995,38(3):959-964.
参考文献:
[11] 邓泓,叶志鸿,黄铭洪.湿地植物根系泌氧的特征.华东师范大学学报(自然科学版),2007,6:69-76.
[14] 卢德敏.淡水生物学.苏州:苏州大学出版社,2002.46
[21] 成水平,吴振斌,夏宜埠.水生植物的气体交换与输导代谢.水生生物学报,2003,(4):413-417.
