碱性介质中二过碘酸合铜(Ⅲ)配离子氧化氨基乙酸的反应动力学
2013-12-13李兴强河北东华冀衡化工有限公司053400
李兴强(河北东华冀衡化工有限公司053400)
随着过渡金属元素不断失去电子, 它们的高氧化态存在形式也会变得越来越不稳定, 但是目前关于其反应动力规律尚不明确,且鲜有报道。 而电离势增加却可以很好地解决和说明这一问题和热力学数据。 通常铜氧化态多为正1 价和正2 价,但是在多数研究中,他们的氧化物都是作为不明确的化合物而被描述,而近30 年来,随着研究工作的深入开展,已经有研究证实这一类的化学元素有着属于他们自己的特性, 为了进一步发掘他们的研究价值,明确其反应机理,在这里采用光分度法对其反应动力学展开研究,现报告如下:
1、资料与方法
1.1 实验试剂 KIO4、CuSO4·5H2O、K2S2O8、AB 等均为AR级试剂,在配制溶液时,均采用二次蒸馏水进行配制。 另外,在配制DPC 溶液时根据文献报道的方法进行配制,并给予标定。实验过程中,PH 值主要采用KOH、KNO3 等进行调节和处理。
1.2 实验方法 实验主要用到的仪器有恒温箱(型号501,精度范围0.1 度, 上海仪器制造厂生产)、 分光光度计 (型号UV1900,配有跟踪反应进程和恒温池架)。
1.3 研究方法 采用光分度法对碱性介质中二过碘酸合铜(Ⅲ)配离子氧化氨基乙酸的反应机理和反应动力学进行研究。
1.4 动力学方法 在一级反应条件以及一定温度, 选定一定浓度的DPC 溶液,配制2 份2ml 还原剂溶液,分别入于反应器的支管中,待达到恒温时,迅速混合,并且立即转移到石英池,然后在415nm 条件下, 将反应液吸光度记录下来, 包括反应记录时间,并且绘制时间变化曲线,最终将获得所需要的动力学反应信息。
2、结果
2.1、反应规律
Kobs 受离子强度、OH-、IO4-离子等的变化而不断化, 随着OH-浓度的增加,Kobs 增大, 随着IO4-离子浓度减少而增大,且通过实验得到不同温度下活化参数和速率常数,同时,确定最佳的反应条件,不同条件下所表现出的不同反应级数如表1 所示:2.5*10-2mol/L
2.2、OH-对Kobs影响
在恒定的DPC 下,随着OH-的增大,呈现先减少后增大的趋势,且在0.05mol/L 时出现此时反应速率达到最低,具体如图1所示:

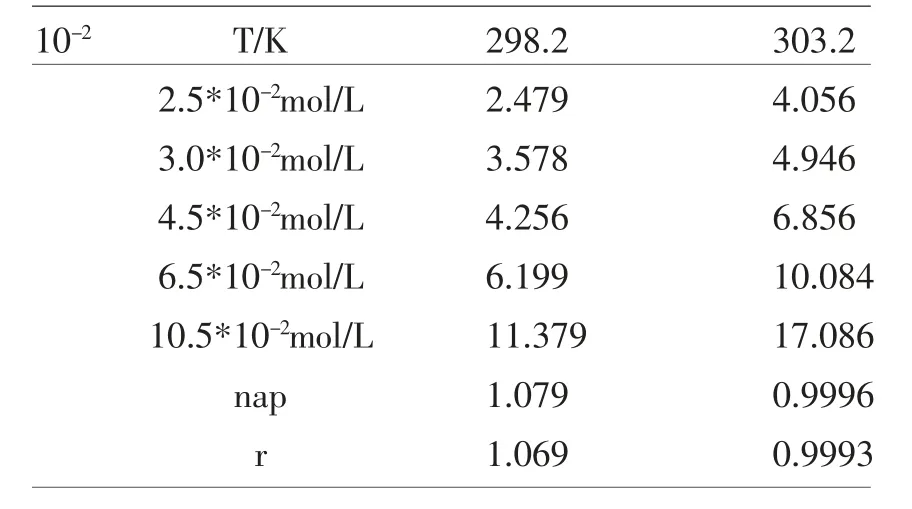
表1 不同条件下所表现出的不同反应级数
2.3、IO4-对Kobs的影响
在恒定的DPC 下,随着IO4-的增大,呈现不断减少的趋势。
3、讨论
近年来, 过渡金属超常氧化物已经被广泛应用于反应动力学研究中, 为正确的生产条件控制和合成路线的选择提供了有价值的理论依据。 一般而言,随着过渡金属元素不断失去电子,它们的高氧化态存在形式也会变得越来越不稳定, 而电离势增加却可以很好地解决和说明这一问题和热力学数据。 随着研究工作的深入开展, 已经有研究证实这一类的化学元素有着属于他们自己的特性。 尤其是近年来大量新仪器和新科学的发展,使得过渡金属超常氧化态的反应机理研究更进一步, 如本组研究结果显示:Kobs 受离子强度、OH-、IO4-离子等的变化而不断化,随着OH-浓度的增加,Kobs 增大, 随着IO4-离子浓度减少而增大,且通过实验得到不同温度下活化参数和速率常数,具体的反应机理如下:

基于上面反应机理和研究结果, 发现二过碘酸合铜配离子的主要存在形式为[Cu(OH)2(H2IO6)]6-,为此根据物料平衡原理,采用稳态处理方法,可以得到如下方程:
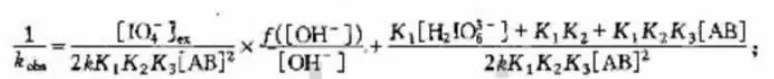
总而言之,需要进一步发掘其研究价值,能够充分解释实验的反应机理,对配位化学理论发展提供参考。
[1]单金缓,韩冲,霍树营,范立. 碱性介质中二过碘酸合铜(Ⅲ)配离子氧化2-氨基-1-丁醇的反应动力学及机理[J]. 河北大学学报(自然科学版),2008,01∶46-51.
[2]王立平,单金缓,孙汉文. 碱性介质中分光光度法研究二过碘酸合铜(III)氧化1,2-丙二胺反应动力学及机理[J]. 安徽师范大学学报(自然科学版),2013,03∶254-258.
[3]单金缓,王立平,申世刚,许明远. 碱性介质中二过碘酸合铜(Ⅲ)氧化三乙醇胺的动力学及机理[J]. 河北师范大学学报(自然科学版),2009,06∶766-769.
[4]宋文玉,李文魁,贾春平. 碱性介质中二过碘酸合银(Ⅲ)配离子氧化四氢糠醇的反应动力学及机理[J]. 高等学校化学学报,2009,11∶1767-1771.
