白念珠菌蛋白磷酸酯酶CaPph3和调节亚基CaPsy2在调节菌丝发育中的作用*
2013-12-11冯金荣朱丹丹段义农
冯金荣,孙 伟,庄 重,朱丹丹,段义农
(南通大学医学院病原生物学系,江苏 226001)
白念珠菌(Canidia albicans)是一种最重要的人体病原真菌。据统计临床上大约10%的血液感染由它引起,导致的病死率高达40%[1]。目前白念珠菌仍是最主要的真菌病原,占真菌感染的50%以上[1-2]。研究发现白念珠菌能以酵母态、假菌丝态和菌丝态3种形态存在[3]。相比较而言,其菌丝态细胞对人体危害更为严重,特别是当患有艾滋病、恶性肿瘤等免疫力下降时,它能够从酵母态向菌丝态转换,并能侵入患者内部器官造成深部感染,严重时可导致患者死亡。所以,研究清楚白念珠菌的形态转换机制,对于其临床治疗和抗真菌药物的开发都具有重要的意义[4]。
白念珠菌的形态转换是一个复杂的过程,受多种信号通路调控。最近研究表明白念珠菌的DNA损伤检验点与其菌丝发育过程有关,参与该途径的重要蛋白激酶或蛋白磷酸酯酶的缺失或失活都会影响白念珠菌菌丝发育[5]。前期实验中,我们已经构建了白念珠菌CaPPH3和CaPSY2缺失株以及它们的双基因缺失株。初步发现它们对于多种遗传毒性试剂敏感,但对于其是否参与调控菌丝发育过程还没未明确。鉴于在酿酒酵母中,ScPsy2作为ScPph3的调节亚基而共同参与检验点修复过程[6],本文中我们利用已构建的CaPPH3和CaPSY2缺失株,以及它们的双缺失株进行菌丝发育实验。结果发现在缺失株中加入遗传毒性试剂HU和MMS后,会导致缺失株菌丝生成速度明显加快,且移除这些遗传毒性试剂后,缺失株的菌丝能够进一步伸长。结果说明CaPph3和CaPsy2对于白念珠菌极性生长有重要的作用,这为今后深入研究白念珠菌DNA损伤修复过程和菌丝发育间调控机制打下了基础。
1 材料与方法
1.1 材料 (1)菌株:白念珠菌野生型菌株RM1000由本实验室保存,CaPPH3缺失株、CaPSY2缺失株及CaPPH3 CaPSY2双缺失株由本实验室构建并保存。(2)主要试剂:羟基脲(HU)购自上海生工公司,甲基磺酸甲酯(MMS)购自 SIGMA 公司,顺铂(CP)购自大连美仑生物公司,其余试剂为国产分析纯等。
1.2 方法 (1)表型筛选试验:参照Feng等[7]方法,将各待测菌株在液体YPD培养基中过夜培养到稳定期后,进行倍比稀释。然后取3μL 10-5稀释的菌液,滴加在YPD平板及加有各种遗传毒性试剂的YPD平板上。30℃培养2~3天后,观察各菌株生长情况并拍照保存。(2)缺失株的存活率实验:参照Wang等[8]方法,将各待测菌株接种于YPD液体培养基中于30℃过夜培养,第2天以1/10的接种量转接到新鲜YPD液体培养基中。30℃培养3小时后加入一定浓度的HU或MMS,处理1小时后取100 μL菌液,按上文方法进行倍比稀释。最后取100 μL 10-5稀释的菌液涂布于YPD固体培养基上,30℃培养2天后统计菌落数。实验重复3次。(3)菌丝发育实验:参照Zhao等[9]方法,将RM1000和各缺失株接种于YPD液体培养基中于30℃过夜培养,第2天以1/10的接种量转接到新鲜YPD培养基中。培养到对数期后,分别加入终浓度为50 mmol/L的HU和0.02%的MMS,处理4小时后收集菌体,用无菌水洗3次,然后加入新鲜YPD液体培养基于30℃培养,分别在0小时、2小时、4小时、6小时等时间点取样,用显微镜观察并拍照。本实验重复3次。
1.3 统计学处理 利用SPSS13.0软件进行统计学分析,最后取平均数,两两比较采用t检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 CaPPH3和CaPSY2缺失株的表型鉴定 在前期实验中,我们已经分别构建了CaPPH3缺失株(pph3/pph3)、CaPSY2缺失株(psy2/psy2)和 CaPPH3 CaPSY2双基因缺失株(pph3/pph3 psy2/psy2),并对缺失株的表型进行初筛。本文中对各缺失株在含有各种浓度的遗传毒性试剂平板上的表型行进一步鉴定。结果发现在0.015%MMS平板上,CaPPH3缺失株与野生型菌株RM1000相比,表现出明显的生长缺陷。而CaPSY2缺失株与CaPPH3缺失株的表型基本一致,也表型出对0.015%MMS敏感,且敏感程度基本与CaPPH3缺失株一致。而当这2个基因共同缺失时,双基因缺失株的表型与单基因缺失株类似,且对MMS的敏感程度也基本一致。而在0.02%MMS的平板上,各缺失株敏感程度进一步加剧,但相互之间差异不大。类似现象在含有2 mmol/L CP、2.5 mmol/L CP、30 mmol/L HU 及 40 mmol/L HU 平板上都可观察得到。预示着CaPph3和CaPsy2在DNA损伤修复过程中发挥着类似的作用。
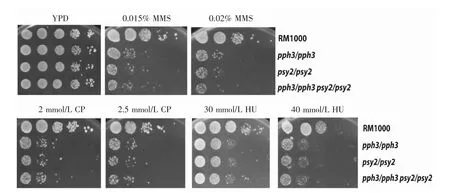
图1 CaPPH3和CaPSY2缺失株的表型鉴定
2.2 CaPPH3和CaPSY2缺失株对遗传毒性试剂的敏感程度测定 在酿酒酵母中,当细胞遭受DNA损伤时,会激活检验点激酶修复损伤。当胞内的DNA损伤被修复后,ScPph3和ScPsy2可使检验点激酶ScRad53失活而使细胞周期恢复正常。但如这2个蛋白缺失,则会导致ScRad53不能被正常失活,使细胞周期不能恢复正常,从而导致缺失株存活率下降。本文利用获得的白念珠菌各种缺失株,也进行类似存活率检测试验。结果如图2所示,与未处理组相比,用0.015%MMS处理各菌株时,野生型菌株的存活率约95%,而CaPPH3缺失株存活率仅有20%左右。CaPSY2缺失株和CaPPH3 CaPSY2双基因缺失株的存活率也仅剩20%,与CaPPH3缺失株比较差异无统计学意义,(P>0.05)。用0.02%MMS处理各菌株时,野生型菌株的存活率没有明显下降。而CaPPH3缺失株、CaPSY2缺失株和CaPPH3 CaPSY2双基因缺失株的存活率进一步下降,仅有7%。

图2 MMS处理后各菌株的存活率
而如图3所示,用30 mmol/L HU和40 mmol/L HU处理各菌株后,同样会导致缺失株的存活率大幅度下降,而野生型基本无变化。说明在白念珠菌中CaPPH3和CaPSY2基因的缺失可能会导致缺失株不能完成DNA损伤修复过程,从而影响存活率。
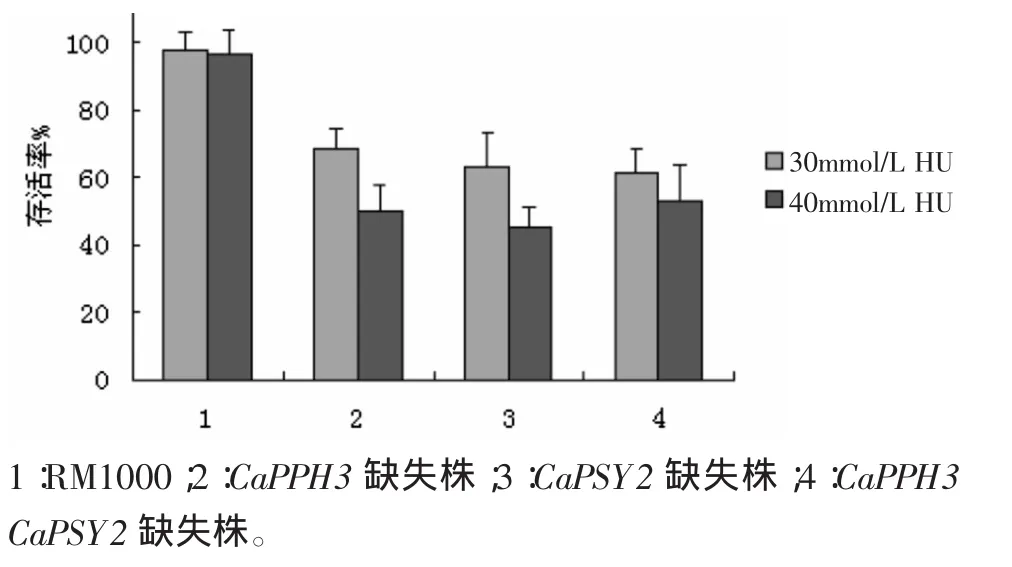
图3 HU处理后各菌株的存活率
2.3 CaPPH3和CaPSY2缺失株的菌丝发育实验近期研究表明白念珠菌的极性生长与其DNA损伤修复过程有关,所以本实验中进一步研究CaPPH3和CaPSY2基因缺失后,对于白念珠菌菌丝生成的影响。如图4所示,用终浓度为0.02%MMS处理各菌株,4小时后观察其菌丝发育情况。结果发现用MMS处理4小时后,野生型菌株RM1000还维持酵母态,而CaPPH3缺失株、CaPSY2缺失株,以及CaPPH3 CaPSY2双缺失株已出芽形成一定长度的菌丝。而移除MMS后,野生型菌株逐渐形成菌丝并延长,到6小时后其菌丝不再延长,而是逐渐出芽,在菌丝顶端形成酵母态细胞。但在CaPPH3缺失株中移除MMS后,缺失株的菌丝逐渐延长,直至8小时时缺失株仍维持菌丝态。而CaPSY2缺失株,以及CaPPH3 CaPSY2双缺失株的菌丝生成情况与CaPPH3缺失株基本类似。从而说明在MMS诱导条件下,蛋白磷酸酯酶CaPph3和CaPsy2的缺失会促进白念珠菌的菌丝生成。
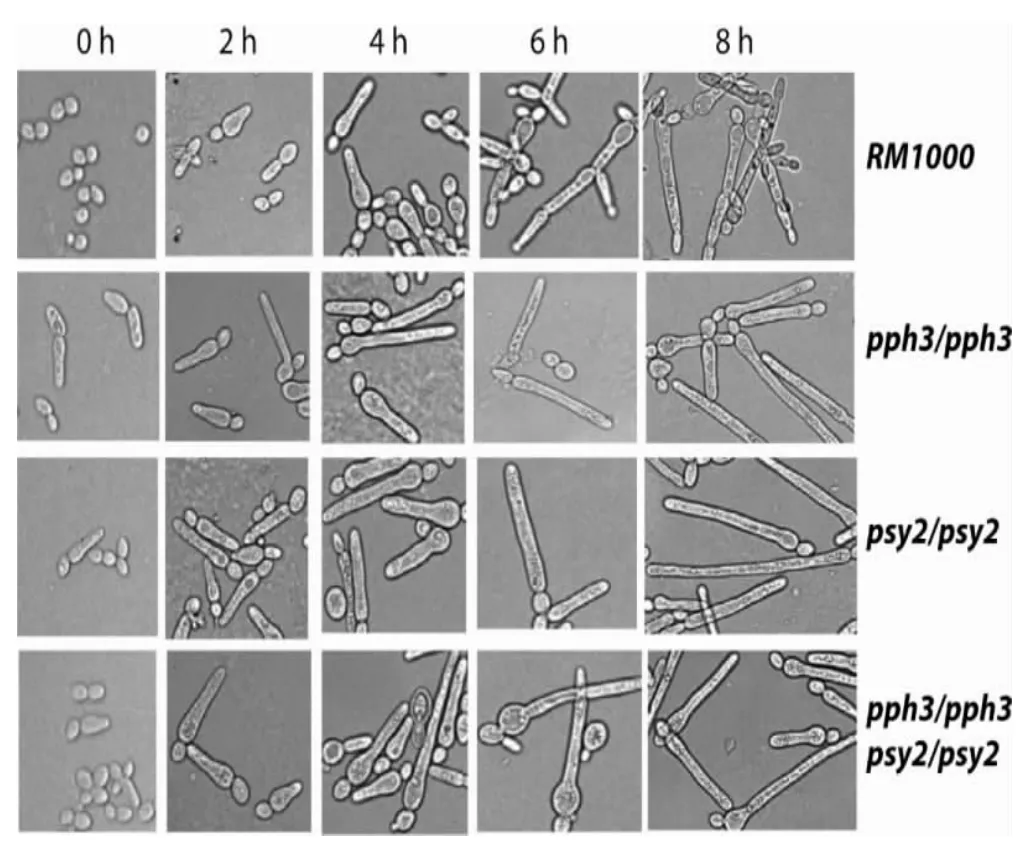
图4 MMS处理后各菌株的菌丝生成情况
采用同样的方法,用终浓度为50 mmol/L的HU处理4小时后观察各菌株的菌丝发育情况。结果发现处理前后,野生型菌株基本不形成明显的菌丝。而在CaPPH3缺失株、CaPSY2缺失株及CaPPH3 CaPSY2双缺失株中,移除HU后各缺失株均逐渐形成菌丝,且随着时间延长缺失株的菌丝也逐渐伸长。结果说明HU诱导条件下,CaPph3和CaPsy2缺失也会促进白念珠菌菌丝生成。

图5 HU处理后各菌株的菌丝生成情况
3 讨 论
本实验中我们利用所获得的白念珠菌CaPPH3缺失株、CaPSY2缺失株及CaPPH3 CaPSY2双缺失株进行表型鉴定和菌丝发育实验。结果发现CaPPH3和CaPSY2单独缺失或共同缺失,均会导致缺失株对各类遗传毒性试剂敏感,且它们敏感程度基本一致。进一步研究发现,经过HU或MMS处理后CaPPH3缺失株、CaPSY2缺失株及CaPPH3 CaPSY2双缺失株存活率均明显下降,且下降程度一致。研究还发现,在遗传毒性试剂HU和MMS诱导条件下,CaPPH3和CaPSY2单独或共同缺失后均会促进缺失株菌丝的发育,且各缺失株的菌丝发育情况基本一致。说明CaPph3和CaPsy2共同参与DNA损伤修复过程,并调控白念珠菌菌丝发育过程。
在酿酒酵母中,蛋白磷酸酯酶ScPph3存在两个调节亚基即ScPsy2和ScPsy4,它们能组成复合体而调节其最重要的检验点激酶ScRad53活性。而在白念珠菌中,目前只鉴定出CaPph3可能调节亚基CaPsy2,且发现它与检验点CaRad53间确实存在相互作用,但对于其是否存在另一个与ScPsy4相对应的调节亚基还未定论。近期实验发现,一个白念珠菌可能存在的CaPsy4蛋白,通过酵母双杂交实验发现它与CaPph3及CaPsy2间存在相互作用。所以推测在白念珠菌中,CaPph3及CaPsy2借助于可能存在的CaPsy4桥接作用,组成复合体共同参与DNA损伤修复过程,调控某些检验点激酶的活性,进而调节菌丝发育过程。本实验发现,CaPph3和CaPsy2在调节DNA损伤修复过程中,和菌丝发育过程方面几乎具有类似的作用,进一步验证我们的推测。所以本研究成果对于今后进一步研究磷酸酯酶CaPph3复合体在菌丝发育方面的作用具有重要的意义。
[1]Pfaller MA,Diekema DJ.Epidemiology of invasive candidiasis:a persistent public health problem [J].Clin Microbiol Rev,2007,20(1):133-163.
[2]Shi SH,Lu AW,Shen Y,et al.Spectrum and risk factors for invasive candidiasis and non-Candida fungal infections after liver transplantation[J].Chin Med J (Engl),2008,121(7):625-630.
[3]Whiteway M,Oberholzer U.Candida morphogenesis and host-pathogen interactions[J].Curr Opin Microbiol,2004,7(4):350-357.
[4]Lengeler KB,Davidson RC,D'souza C,et al.Signal transduction cascades regulating fungal development and virulence[J].Microbiol Mol Biol Rev,2000,64(4):746-785.
[5]Shi QM,Wang YM,Zheng XD,et al.Critical role of DNA checkpoints in mediating genotoxic-stress-induced filamentous growth in Candida albicans[J].Mol Biol Cell,2007,18(3):815-826.
[6]Heideker J,Lis ET,Romesberg FE.Phosphatases,DNA damage checkpoints and checkpoint deactivation[J].Cell Cycle,2007,6(24):3058-3064.
[7]Feng J,Zhao Y,Duan Y,et al.Genetic interactions between protein phosphatases CaPtc2p and CaPph3p in response to genotoxins and rapamycin in Candida albicans[J].FEMS Yeast Res,2013,13(1):85-96.
[8]Wang H,Gao J,Li W,et al.Pph3 dephosphorylation of Rad53 is required for cell recovery from MMS-induced DNA damage in Candida albicans[J].PLoS One,2012,7(5):e37246.
[9]Zhao Y,Feng J,Li J,et al.Mitochondrial type 2C protein phosphatases CaPtc5p,CaPtc6p,and CaPtc7p play vital roles in cellular responses to antifungal drugs and Cadmium in Candida albicans[J].FEMS Yeast Res,2012,12(8):897-906.
