盐地碱蓬二型性种子及其幼苗对盐渍环境的适应性
2013-12-08周家超张晓东王宝山
刘 艳,周家超,张晓东,李 欣,范 海,王宝山,宋 杰
(山东师范大学生命科学学院,逆境植物重点实验室, 济南 250014)
盐地碱蓬二型性种子及其幼苗对盐渍环境的适应性
刘 艳,周家超,张晓东,李 欣,范 海,王宝山,宋 杰*
(山东师范大学生命科学学院,逆境植物重点实验室, 济南 250014)
研究了盐地碱蓬二型性种子中离子含量与刚萌发幼苗耐盐性之间的关系,以及盐分对砂培盐地碱蓬二型性种子的幼苗生长、离子含量及光合特性的影响。棕色种子中离子含量显著高于黑色种子。与对照相比,100和400 mmol/L NaCl对棕色种子幼苗伸长没有抑制作用,却显著抑制黑色种子幼苗的伸长。 NaCl处理下棕色种子的幼苗地上部分干重和主茎一级分枝数比黑色种子幼苗高,但二型性种子的幼苗叶片中离子含量、叶绿素含量及光合放氧速率却没有明显差异。上述结果说明盐地碱蓬棕色种子较高的离子含量可能是棕色种子刚萌发幼苗耐盐性较强的重要原因。棕色种子幼苗较高的生物量可能与其较多的分枝数有关。二型种子的这些特征可能决定了其在群落建成中所起到的不同作用。
盐地碱蓬;种子二型性;离子积累;幼苗伸长;光合放氧
植物种子二型性是指在同一植株上生长有形态结构、生理特性等方面有显著差异的两种种子。不同类型的种子形态学特征、遗传结构或胚的大小及生态行为存在明显差异[1- 3]。种子二型性在一些盐生植物中常见,是盐生植物适应不同生长环境重要策略[4- 5]。
盐地碱蓬(SuaedasalsaL.)为藜科碱蓬属1年生草本肉质化真盐生植物,具有很强的耐盐性。种植盐地碱蓬可明显改善盐碱地土壤[6]。盐地碱蓬种子具有二型性,即外种皮柔软的棕色种子和外种皮坚硬的黑色种子[7]。研究发现,盐地碱蓬的棕色种子均重于黑色种子,发育完全,具有较高的抗盐性[7- 8]。盐地碱蓬黑色种子能长时间保持休眠。相比棕色种子,长期储存后黑色种子具有更高萌发力。盐地碱蓬在春天可能主要以棕色种子建群。夏天当雨季来临土壤含盐量降低以后,则部分黑色种子萌发,即黑色种子可能是土壤种子库的主要组成[9]。然而,目前有关盐地碱蓬二型性种子在幼苗阶段对盐胁迫响应的比较研究尚未见报道。为此,本文研究了盐地碱蓬二型性种子中离子含量与刚萌发幼苗耐盐性之间的关系,以及盐分对砂培幼苗的生长及光合特性的影响,试图为理解盐地碱蓬二型性种子适应盐渍生境的生理生态机制提供一定参考。
1 材料和方法
1.1 实验材料
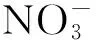
1.2 植物的培养与处理
挑选籽粒饱满的盐地碱蓬棕色种子和黑色种子,分别播种于盛有洗净河沙的塑料盆中,待长至2—3片真叶时间苗,每盆留6株。30d后开始盐处理。NaCl溶液设3个浓度:0、200和600 mmol/L(均用以去离子水配制的1/2 Hoagland营养液配制,以KOH和H2SO4调节pH至6.2±0.1),以不加NaCl作对照处理,每天定量浇灌,每个处理3盆。NaCl溶液每天以50 mmol/L递增以避免盐冲击,在600 mmol/L NaCl处理的达到其终浓度20d后测定各相关生理指标。
1.3 测定方法
1.3.1 种子中离子含量测定
挑选大小一致的盐地碱蓬棕色种子和黑色种子各20—40粒,于80 ℃烘箱中烘干至恒重,将烘干样品研磨成粉末,称重后置于马弗炉中,550 ℃充分灰化,灰分用2—3滴浓硝酸溶解后用去离子水定容至20 mL,Na+、K+含量用410型火焰光度计(英国Sherwood公司)测定,Cl-含量用PXSJ- 216型离子分析仪(上海雷磁)氯离子选择电极测定。每处理3个重复。
1.3.2 刚萌发幼苗伸长的测定
选取大小一致的盐地碱蓬棕色种子和黑色种子,分别放于铺有滤纸的培养皿中,每皿5粒。NaCl溶液设4个浓度:0、100、400和800 mmol/L(均用1/5 Hoagland配制)。先以5 mL 1/5 Hoagland(以KOH和H2SO4调节pH至6.2±0.1),25 ℃进行室内黑暗培养,每隔两天换一次培养液,以保证相对恒定的渗透势。待幼苗伸长到一定长度时测量并记录幼苗长度l1,随后转移到NaCl溶液中继续培养3d,测量并记录此时幼苗长度l2。3d内幼苗伸长的长度用以下公式计算:l=l2-l1。每处理3个重复。
1.3.3 植株地上部分干重的测定
将植株地上部分用去离子水快速冲洗干净,吸干表面的水分,然后放入105 ℃的烘箱中杀青10 min,再以80 ℃烘至恒重,称干重。每处理3个重复。
1.3.4 植株地上部分分枝数
统计各处理植株地上部分沿主茎一级分枝的数目。每处理3个重复。
1.3.5叶片Na+和K+含量测定
将植物材料用去离子水快速冲洗干净,吸干表面水分。分别称取0.4 g相同叶位的叶片并剪碎,放入试管,加入10 mL去离子水,封口后置于沸水浴中50 min后取出,过滤并定容至25 mL,用410型火焰光度计(英国Sherwood公司)测定。每处理3个重复。
1.3.6 叶绿素含量的测定
称取0.3 g相同叶位的叶片(从主茎顶端数第5到第8片完全伸展叶),去离子水洗净剪碎后放入试管中,加入5 mL 80%的丙酮和5 mL二甲基亚砜,封口后摇匀,于65 ℃保温提取至叶片变白为止。过滤,冷却后用80%的丙酮定容至25 mL,测定663 nm和645 nm处的吸光度。每处理3个重复。
1.3.7 叶片光合放氧速率的测定
采用英国Hansatech公司生产的Oxy-Lab系统(Chlorolab 2型液相氧电极)测定[10- 11]。光照由冷光源提供,反应杯内光照强度为1 000 μmol·m-2·s-1,反应杯温度用恒温水浴控制,温度为(22±0.2)℃。每种处理3个重复。
1.4 数据分析
种子中离子含量采用SPSS统计软件进行单因素分析,其他数据均采用SAS 6.12进行双因素显著性分析。
2 结果
2.1 盐地碱蓬二型性种子中离子含量
棕色种子中Na+、K+、Cl-及总离子含量均高于黑色种子,分别为黑色种子的2.3、1.5、1.8和2.0倍(图1)。
2.2 盐处理对盐地碱蓬刚萌发幼苗伸长的影响
与对照相比,100和400 mmol/L NaCl对棕色种子幼苗伸长没有抑制作用,却显著降低黑色种子幼苗的伸长。800 mmol/L NaCl处理则显著抑制棕色种子及黑色种子的幼苗伸长(图2,表1)。
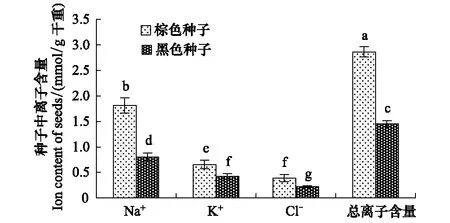
图1 盐地碱蓬棕色种子和黑色种子中Na+、 K+、 Cl- 及总离子含量Fig.1 Contents of Na+, K+, Cl- and total ions in dimorphic seeds of S. salsa平均值±SD;平均值上的字母不同表示在P lt; 0. 05水平上差异显著
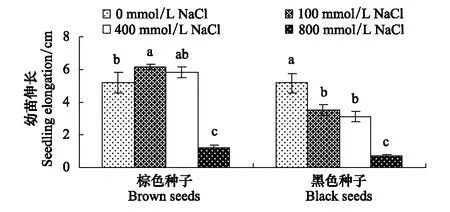
图2 盐处理对棕色种子及黑色种子幼苗伸长的影响Fig.2 Effect of NaCl on elongation of seedlings from dimorphic seeds of S. salsa 平均值±SD;同一列中平均值上的字母不同表示在P lt; 0. 05水平上差异显著
2.3 盐处理对盐地碱蓬幼苗地上部分干重的影响
与对照相比,200 mmol/L NaCl明显促进两种种子的幼苗地上部分干重,600 mmol/L NaCl处理则降低两种种子的幼苗地上部分干重。不同处理下,棕色种子幼苗地上部分干重高于黑色种子幼苗(图3,表1)。
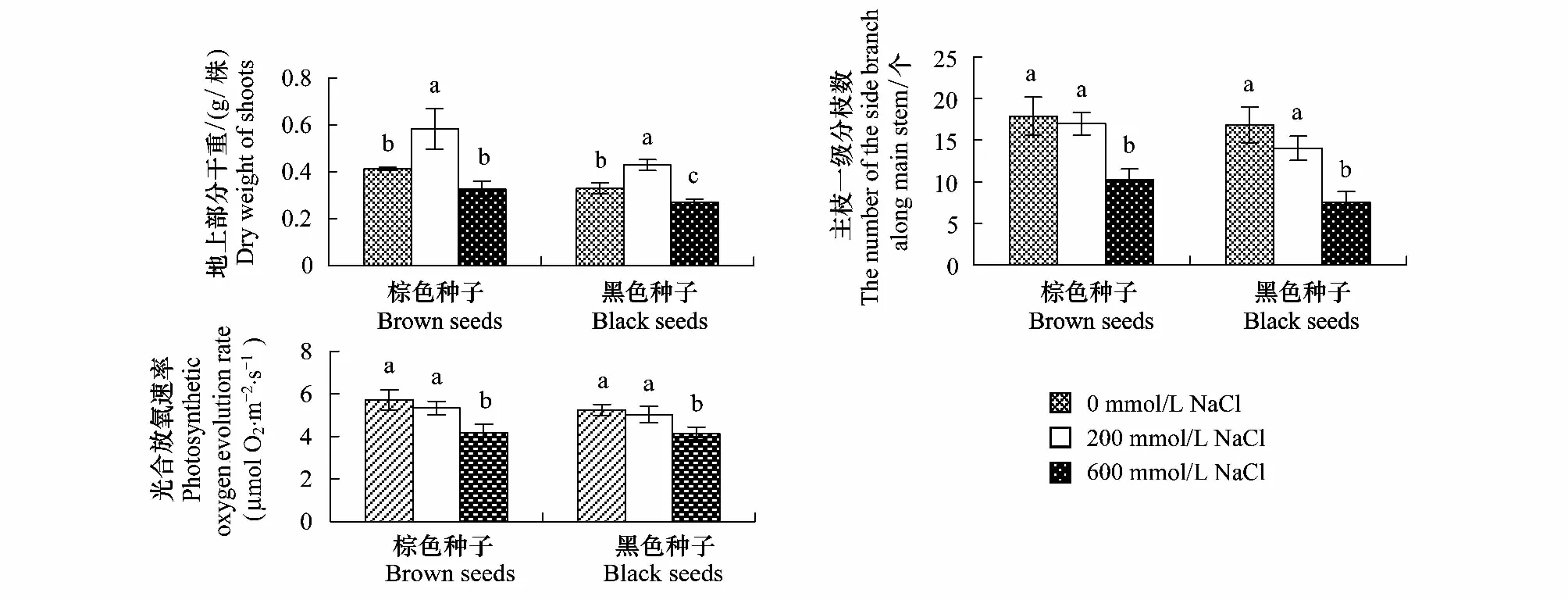
图3 盐处理对棕色种子及黑色种子幼苗地上部分干重、主茎一级分枝数和叶片光合放氧速率的影响Fig.3 Effect of NaCl on shoot dry weight of, number of the side branch along main stem and rate of photosynthetic oxygen evolution in leaves of plants from dimorphic seeds of S. salsa
2.4 盐处理对盐地碱蓬幼苗地上部分主茎一级分枝数的影响
200 mmol/L NaCl处理对棕色种子与黑色种子幼苗主茎一级分枝数没有明显影响,600 mmol/L NaCl处理对其显著抑制,尤其是对黑色种子幼苗主枝一级分枝数。200和600 mmol/L NaCl处理下棕色种子的幼苗主茎一级分枝数比黑色种子幼苗高(图3,表1)。
表1棕色种子及黑色种子幼苗伸长、幼苗地上部分干重、主枝一级分枝数、叶片光合放氧速率、叶片中叶绿素含量及Na+、K+含量等特征关于种子类型、盐度的双因素分析结果
Table1Resultsoftwo-wayANOVAofcharacteristicsofseedlingelongation,shootdryweight,numberofsidebranchalongmainstem,photosyntheticoxygenevolutionrate,chlorophyllcontent,leafNa+andK+contentofplantsfromdimorphicseedsofS.salsainrelationtoseedtypesandsalinity

性状Traits种子类型Seedtype盐度Salinity幼苗伸长Seedlingelongation78.4***140.6***地上部分干重Dryweightofshoots37.3***57.8***主茎一级分枝数Numberofthesidebranchalongmainstem7.9*41.1***光合放氧速率Photosyntheticoxygenevolutionrate2.14NS18.62***叶绿素a含量chlorophyllacontent0.6NS14.3**叶绿素b含量chlorophyllbcontent0.9NS19.2***叶绿素(a+b)含量chlorophyll(a+b)content0.7NS15.6***叶片Na+含量Na+contentinleaves1.3NS349.0***叶片K+含量K+contentinleaves0.3NS230.2***
*表示在Plt; 0.05 水平上差异显著;* * 表示在Plt; 0.01 水平上差异显著;* * *表示在Plt; 0.001 水平上差异显著;NS 表示没有显著性差异;数值代表F值
2.5 盐处理对盐地碱蓬幼苗叶片光合放氧速率的影响
棕色种子及黑色种子幼苗光合放氧速率均随着盐浓度的增加有下降的趋势。相同处理下两种种子幼苗叶片的光合放氧速率无明显差异(图3;表1)。
2.6 盐处理对盐地碱蓬幼苗叶片叶绿素含量的影响
随着盐浓度的增加,两种种子幼苗叶片中叶绿素含量均呈下降趋势,200 mmol/L NaCl处理显著降低了盐地碱蓬黑色种子幼苗叶片叶绿素a、b 及a+b 的含量,但对棕色种子幼苗无显著影响。600 mmol/L NaCl处理显著降低两种种子幼苗叶片叶绿素含量。不同浓度NaCl处理下,棕色种子和黑色种子幼苗叶片叶绿素含量没有明显差异(图4,表1)。
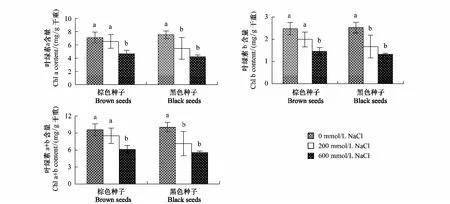
图4 盐处理对棕色种子及黑色种子幼苗叶片中叶绿素a、叶绿素b以及叶绿素a+b含量的影响Fig.4 Effect of NaCl on content of chlorophyll a, chlorophyll b and chlorophyll (a+b) in leaves of plants from dimorphic seeds of S. salsa
2.7 盐处理对盐地碱蓬幼苗叶片中离子含量的影响
两种种子幼苗叶片中Na+含量均随着NaCl浓度的升高而显著增加。不同处理下,棕色种子和黑色种子幼苗叶片中Na+含量无显著差异(图5,表1)。
两种种子幼苗叶片中K+含量均随着NaCl浓度的升高而降低。不同处理下,棕色种子和黑色种子幼苗叶片中K+含量无显著差异(图5,表1)
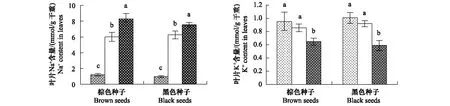
图5 盐处理对棕色种子及黑色种子幼苗叶片中Na+ 和K+ 含量的影响Fig.5 Effect of NaCl on content of Na+ and K+ in leaves of plants from dimorphic seeds of S. salsa
3 讨论
种子多型性是指同一株植株的不同部位产生不同形态或行为种子的现象,常出现在那些生长于荒漠、盐沼等严酷生境中的植物上,被认为是对时空异质环境的一种适应[12]。在盐碱地中,由于土壤溶液较低的水势,种子萌发时很难从土壤中吸收水分[13],而种子中较高的离子含量可能会缓解渗透胁迫[14]。盐地碱蓬棕色种子比黑色种子吸水快[7]。史功伟[15]等研究发现,盐渍环境中盐地碱蓬棕色种子出苗率明显高于黑色种子。本实验发现,棕色种子中总离子含量比黑色种子中高,这可能棕色种子比黑色种子吸水快[7],以及棕色种子较黑色种子萌发率和出苗率高以及萌发快的原因之一[8,15]。
种子大小直接影响幼苗建成的能力,主要表现在种子大小对幼苗出现的时间及幼苗竞争能力[16- 17],幼苗大小[18- 19]和幼苗存活和定居能力[20- 21]等几个方面的影响。柯文山[22]等的研究结果显示,种子大小明显地影响幼苗的初始大小和幼苗的生长高度。相对于较小种子产生的幼苗,较大种子产生幼苗的存活和竞争能力也都有明显提高[20,23]。胁迫环境下,较大种子产生的幼苗活力旺盛,能更好地适应不同的环境变化。比如种子中离子的积累与盐环境下种子萌发及之后幼苗生长过程的耐盐性有关[24]。本文研究发现,100和400 mmol/L明显抑制刚萌发的黑色种子的幼苗伸长,而对棕色种子的幼苗没有抑制作用,这可能与棕色种子含有较多离子有关。一般情况下,盐生植物刚萌发的小幼苗不耐盐,例如里海盐爪爪(Kalidiumcaspicum),种子在-0.8 MPa NaCl溶液中的萌发率是80%左右,但在此NaCl溶液中其刚萌发的幼苗生长却明显受到抑制[25]。盐地碱蓬棕色种子幼苗较高的耐盐性说明棕色种子在群落建成中起到重要作用。
不同形态种子产生的幼苗一般有显著的差异,大种子产生的幼苗较大,具竞争优势[2,26]。三角叶滨藜(Atriplextriangularis)产生的大种子的幼苗较大,在以后的生长中一直保持这种差异,这种差异是由于大种子发芽快的结果[27]。Yao[28]等发现,低盐条件下藜(Chenopodiumalbum)棕色种子的幼苗高度和分枝数与黑色种子幼苗没有明显差别,而高盐条件下棕色种子的幼苗高度和分枝数高于黑色种子幼苗。碱蓬属植物Suaedasplendens在较低盐分条件下(0和200 mmol/L NaCl)棕色种子的相对生长速率、一级和二级分枝数均比褐色种子低,而高盐时(400 mmol/L NaCl)却相反[29]。本实验结果发现不同盐浓度处理下,盐地碱蓬棕色种子的植株地上部分生物量均高于黑色种子植株(图 3),可能与棕色种子的幼苗具有较多的分枝有关(图 4),而与两种种子幼苗的叶绿素含量以及光合放氧无关。因为不同盐度下,两种种子幼苗的叶绿素含量和光合放氧速率没有明显差别(图5,图6)。
盐胁迫下,植物细胞从外界吸收无机离子,作为渗透调节剂降低细胞水势,以保证植物能够在高盐环境下吸水并正常生长[30]。参与无机渗透调节的无机离子主要是Na+、K+和Cl-等。而高盐条件下较高的K+/Na+对维持离子稳态意义重大[31]。本实验发现不同盐分浓度下棕色种子和黑色种子的幼苗叶片Na+和K+含量没有明显差异。不同盐度对干重的抑制作用也表现出相似的趋势。即棕色种子和黑色种子生长的植株(较长时间培养的植株)耐盐性没有明显差异。
综上所述,盐地碱蓬棕色种子较高的离子含量以及棕色种子发育的更好[8]可能是棕色种子刚萌发幼苗耐盐性较强,以及砂培幼苗较多分枝和较高的地上部分生物量的重要原因。棕色种子的这一特性进一步说明盐地碱蓬二型性种子中,棕色种子可能在种子成熟后的来年春天群落的建成中起主要作用(棕色种子不耐储存[9]),而黑色种子可能在环境不利情况下群落的持续建成中起一定作用。
[1] Maun M A, Payne A M. Fruit and seed polymorphism and its relation to seedling growth in the genusCakile. Canadian Journal of Botany, 1989, 67: 2743- 2750.
[2] Venable D L, Levin D A. Ecology of achene dimorphism inHeterothecalatifolia: Ⅰ. Achene structure, germination and dispersal. Journal of Ecology, 1985, 73: 113- 145.
[3] Baskin J M, Baskin C C. Germination dimorphism inHeterothecasubaxillarisvar.subaxillaris. Bulletin of the Torrey Botanical Club, 1976, 103(5): 201- 206.
[4] Khan M A, Ungar I A. The effect of salinity and temperature on the germination of polymorphic seeds and growth ofAtriplextriangularisWilld. American Journal of Botany, 1984, 71(4): 481- 489.
[5] Khan M A, Gull B, Weber D J. Germination of dimorphic seeds ofSuaedamoquiniiunder high salinity stress. Australian Journal of Botany, 2001, 49(2): 185- 192.
[6] Zhao K F, Fan H, Jiang X Y, Song J. Improvement and utilization of saline soil by planting halophytes. Chinese Journal of Applied and Environmental Biology, 2002, 8(1): 31- 35.
[7] Li W Q, Liu X J, Khan M A, Yamaguchi S. The effect of plant growth regulators, nitric oxide, nitrite and light on the germination of dimorphic seeds ofSuaedasalsaunder saline conditions. Journal of Plant Research, 2005, 118(3): 207- 214.
[8] Song J, Fan H, Zhao Y Y, Jia Y H, Du X H, Wang B S. Effect of salinity on germination, seedling emergence, seedling growth and ion accumulation of a euhalophyteSuaedasalsain an intertidal zone and on saline inland. Aquatic Botany, 2008, 88(4): 331- 337.
[9] Li W, An P, Liu X. Effect of storage, stratification, temperature and gibberellins on germination of dimorphic seeds ofSuaedasalsaunder saline conditions. Seed Science and Technology, 2008, 36(1): 122- 132.
[10] Xu D Q. Photosynthetic Efficiency. Shanghai Scientific and Technological Press, 2002: 29- 35.
[11] Hall D O, Scurlock J M O, Bolhar-Nordenkampf H R, Leegood R C, Long S P. Photosynthesis and Production in a Changing Environment, a Field and Laboratory Manual. Chapman and Hall, 1993: 268- 282.
[12] Wang L, Dong M, Huang Z Y. Review of research on seed heteromorphism and its ecological significance. Chinese Journal of Plant Ecology, 2010, 34(5): 578- 590.
[13] Tlig T, Gorai M, Neffati M. Germination responses ofDiplotaxisharrato temperature and salinity. Flora-Morphology, Distribution, Functional Ecology of Plants, 2008, 203(5): 421- 428.
[14] Song J, Feng G, Tian C Y, Zhang F S. Strategies for adaptation ofSuaedaphysophora,HaloxylonammodendronandHaloxylonpersicumto saline environment during seed germination stage. Annals of Botany, 2005, 96(3): 399- 405.
[15] Shi G W, Song J, Gao B, Yang Q, Fan H, Wang B S, Zhao K F. The comparation on seedling emergence and salt tolerance ofSuaedaSalsaL. from different habitats. Acta Ecologica Sincica, 2009, 29(1): 138- 143.
[16] Seiwa K. Effects of seed size and emergence time on tree seeding establishment: importance of developmental constraints. Oecologia, 2000, 123(2): 208- 215.
[17] Roach D A, Wulff R D. Maternal effects in plants. Annual Review of Ecology and Systematics, 1987, 18: 209- 235.
[18] Weis I M. The effects of propagule size on germination and seeding growth inMimbilishirsuta. Canadian Journal of Botany, 1982, 60(10): 959- 971.
[19] Diane L M. Effects of seed size on seeding success in three species ofSesbaniaFabaceae. American Journal of Botany, 1986, 73(4): 457- 464.
[20] Coomes D A, Grubb P J. Colonization, tolerance, competition and seed-size variation within functional groups. Trends in Ecology and Evolution, 2003, 18(6): 283- 291.
[21] Walters M B, Reich P B. Seed size, nitrogen supply, and growth rate affected tree seeding survival in deep shade. Ecology, 2000, 81: 1887- 1901.
[22] Ke W S, Zhong Z C, Xi H A, Yang Y, Wang X. The variation of seed sizes ofGordoniaacuminatageographic populations and its effect on seed germination and seedling. Acta Ecologica Sinica, 2000, 20(4): 697- 701.
[23] Gross K L. Effects of seed size and growth form on seeding establishment of six monocarpic plants. Journal of Ecology, 1984, 72(2): 369- 387.
[24] Hosseini M K, Powell A A, Bingham I J. Comparison of the seed germination and early seedling growth of soybean in saline conditions. Seed Science Research, 2002, 12: 165- 172.
[25] Tobe K., Li X M, Omasa K. Seed germination and radicle growth of a halophyte,Kalidiumcapsicum(Chenopodiaceae). Annals of Botany, 2000, 85: 391- 396.
[26] Schnee B K, Waller D M. Reporductive behavior ofAmphicarpaeabracteata(Leguminosae), an amphicarpic annual. American Journal of Botany, 1986, 73(3): 376- 386.
[27] Ellison A M. Effect of seed dimorphism on the density-dependent dynamics of experimental populations ofAtriplextriangularis(Chenopodiaceae). American Journal of Botany, 1987, 74(8): 1280- 1288.
[28] Yao S X, Lan H Y, Zhang F C. Variation of seed heteromorphism inChenopodiumalbumand the effect of salinity stress on the descendants. Annals of Botany, 2010, 105(6): 1015- 1025.
[29] Redondo- Go′mez S, Mateos-Naranjo E, Cambrolle′ J, Luque T, Figueroa M, Davy A J. Carry-over of differential salt tolerance in plants grown from dimorphic seeds ofSuaedasplendens. Annals of Botany, 2008, 102(1): 103- 112.
[30] Song J, Feng G, Tian C Y, Zhang F S. Osmotic adjustment traits ofSuaedaphysophora,HaloxylonammodendronandHaloxylonpersicumin field or controlled conditions. Plant Science, 2006, 170(1): 113- 119.
[31] Gao B, Song J, Liu J P, Shi G W, Fan H, Zhao K F, Wang B S. Seedling emergence and salt tolerance ofSuaedaphysophoraPall. under salt stress. Acta Ecologica Sincica, 2009, 29(11): 6131- 6135.
参考文献:
[6] 赵可夫, 范海, 江行玉, 宋杰. 盐生植物在盐渍土壤改良中的作用. 应用与环境生物学报, 2002, 8(1): 31- 35.
[10] 许大全. 光合作用效率. 上海: 上海科学技术出版社, 2002: 29- 35.
[12] 王雷, 董鸣, 黄振英. 种子异型性及其生态意义的研究进展. 植物生态学报, 2010, 34(5): 578- 590.
[15] 史功伟, 宋杰, 高奔, 杨青, 范海, 王宝山, 赵可夫. 不同生境盐碱地碱蓬出苗及幼苗抗旱性的比较研究. 生态学报, 2009, 29(1): 138- 143.
[22] 柯文山, 钟章成, 席红安, 杨毅, 王万贤. 四川大头茶地理种群种子大小变异及对萌发、幼苗特征的影响. 生态学报, 2000, 20(4): 697- 701.
[31] 高奔, 宋杰, 刘金萍, 史功伟, 范海, 赵可夫, 王宝山. 盐胁迫下囊果碱蓬出苗状况及苗期抗盐性. 生态学报, 2009, 29(11): 6131- 6135.
AdaptationsofdimorphicseedsandseedlingsofSuaedasalsatosalineenvironments
LIU Yan, ZHOU Jiachao, ZHANG Xiaodong, LI Xin, FAN Hai, WANG Baoshan, SONG Jie*
KeyLaboratoryofPlantStress,CollegeofLifeScience,ShandongNormalUniversity,Jinan250014,China
We investigated the relationship between ion concentration of dimorphic seeds and salt tolerance of young seedlings from dimorphic seeds, and the effect of salinity on seedling growth, ion content and photosynthetic characteristics in leaves of plants from dimorphic seeds ofSuaedasalsaL. in sand culture. concentrations of Na+, K+, Cl-and total ions of brown seeds were 2.3, 1.5, 1.8 and 2.0 times higher than those of black seeds, respectively. Compared to 0 mmol/L NaCl, 100 and 400 mmol/L NaCl did not inhibit the elongation of seedlings from brown seeds, but the opposite trend was found for seedlings from black seeds. The elongation of seedlings from either brown seeds or black seeds markedly decreased in 800 mmol/L NaCl.
Compared to 0 mmol/L NaCl, shoot dry weight significantly increased in 200 mmol/L NaCl, whereas 600 mmol/L NaCl decreased shoot dry weight of plants from dimorphic seeds. Lower salinity (200 mmol/L NaCl) had no effect on the number of the side branches along the main stem of plants from dimorphic seeds, while higher salinity (600 mmol/L NaCl) markedly decreased this number in plants from dimorphic seeds, especially for plants from black seeds. Shoot dry weight and the number of side branches along the main stem of plants from brown seeds were much higher than those of plants from black seeds under salinity. High salinity (600 mmol/L NaCl) decreased the rate of photosynthetic oxygen evolution in leaves of plants from dimorphic seeds. Salinity (200 and 600 mmol/L NaCl) markedly decreased concentrations of chlorophyll a and chlorophyll b in leaves of plants from black seeds, while 200 mmol/L NaCl had no adverse effect on these parameters in leaves of plants from brown seeds. Leaf Na+concentrations increased with increasing concentration of NaCl, whereas leaf K+concentrations decreased with increasing concentration of NaCl for dimorphic seeds. There was no significant difference in ion concentration, concentration of chlorophyll and the rate of photosynthetic oxygen evolution in leaves of plants from dimorphic seeds ofS.salsa.
The present results indicate that higher concentrations of ions in brown seeds and better development of brown seeds may be related to higher salt tolerance of seedlings from brown seeds, and more branches may be related to higher biomass of shoots for seedlings form brown seeds. These characteristics of dimorphic seeds ofS.salsamay affect their roles in establishment of the population in saline environments. Brown seeds may play a main role in seedling establishment in spring, while black seeds may play a sustaining role in seedling establishment under unfavourable conditions.
Suaedasalsa; dimorphic seeds; ion accumulation; seedling elongation; photosynthetic oxygen evolution
山东省自然科学基金(ZR2010CM005);国家支撑计划(2009BADA7B05)资助
2012- 06- 25;
2012- 10- 23
*通讯作者Corresponding author.E-mail: songjieever@163.com
10.5846/stxb201206250893
刘艳,周家超,张晓东,李欣,范海,王宝山,宋杰.盐地碱蓬二型性种子及其幼苗对盐渍环境的适应性.生态学报,2013,33(17):5162- 5168.
Liu Y, Zhou J C, Zhang X D, Li X, Fan H, Wang B S, Song J.Adaptations of dimorphic seeds and seedlings ofSuaedasalsato saline environments.Acta Ecologica Sinica,2013,33(17):5162- 5168.
