微波辐射非热效应对A549细胞损伤反应的研究
2013-12-08刘晓冬王晓军孙璐阳曹慧玲
刘晓冬 徐 冶 王晓军 孙璐阳 康 晶 曹慧玲
1.吉林医药学院附属医院呼吸内科,吉林吉林 132011;2.吉林医药学院附属医院科研实验中心,吉林吉林 132011
微波治疗肿瘤主要是利用其热效应, 生物组织被微波辐照后,即吸收微波能,导致该区组织细胞内的极性分子处于一种激励状态,发生高速振荡,与邻近分子频频磨擦而将微波能量转变为热能,从而使组织凝固、坏死。 微波治疗配合放、化疗可增加放、化疗的作用,从而减少它们的剂量,提高疗效。 目前伴随对微波研究的不断深入,尤其是在医疗领域的广泛应用, 人们对微波治疗肿瘤的机理有了新的认识。 研究证实,一定强度的微波辐射是通过热和(或)非热效应对机体造成损伤,所以微波治疗肿瘤应包含热和(或)非热效应。 以往人们过多偏注于微波的热效应,至于非热效应的作用机制至今也不明确,尚无定论[1]。 实验室及离体实验结果更是众说纷纭,因此解开微波的“非热效应”之谜是当前急待解决的任务之一。该研究以人肺癌A549 细胞为研究对象,探讨了微波非热效应对组织细胞损伤的反应及其作用机制,以期为微波治疗肿瘤提供新的思考方向。
1 资料与方法
1.1 一般资料
微波辐射仪为南京汇研微波系统工程有限公司,MY8C-1 型微波功率源。 Cytochrome c、GRP 78、Cathepsin D 鼠单克隆抗体,Caspase-3、Caspase-4 兔多克隆抗体, 均购自美国Santa Cruz 公司。 单丹磺酰尸胺染料(monodansylcaolaverine,MDC)、多聚赖氨酸均购自美国Sigma 公司。 激光扫描共聚焦显微镜(Olympus FV1000)。
1.2 方法
1.2.1 细胞培养 人肺癌A549 细胞株由吉林大学白求恩医学院病理生理学教研室惠赠,细胞用含10%小牛血清(杭州四季青生物工程材料有限公司)、100 U/mL 青霉素、0.1 mg/mL 链霉素的高糖完全培养基IMDM 培养基(Gibco,USA)在37℃、5%CO2饱和湿度的培养箱中培养,0.25%胰蛋白酶消化传代。 取对数生长期细胞, 并调成2×105个/mL 接种于培养板,2~3 d 后细胞生长至70%融合用于实验。
1.2.2 分组及非热效应模型 将细胞培养板中A549 细胞按辐射强度分为: 100 W、150 W、200 W3 个实验组。 同时设立未辐射的空白对照组,处理方式为除不接受微波辐射外,其它均与辐射组相同。 辐射时将细胞培养板放置于冰浴条件下,在辐射台上依次进行辐射,每组辐射时间均为10 min,辐射距离为10 cm。辐射后立即采用温度计测定细胞培养物温度没有升高, 以确保非热效应模型的可靠性。 辐射后细胞继续培养24 h,然后分别收集每实验组以及空白对照组的细胞进行相关检测。
1.2.3 Western 印迹检测凋亡相关蛋白 将实验组(100 W、150 W、200 W) 及未辐射的阴性对照组细胞消化后收集于离心管,PBS清洗2 次,加入细胞裂解液冰上静置15 min,10 000 g 离心15 min收集上清,得到样品蛋白。 Bradford 法测定收集到的样本的蛋白浓度,据此取等量蛋白。蛋白质样品与等量的2×SDS 凝胶加样缓冲液混合均匀,煮沸变性,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白、然后转膜并于室温封闭,分别加入Cytochrome c、Caspase-3、GRP 78、Caspase-4、Cathepsin D 的一抗,4 ℃孵育过夜, 缓冲液洗膜4 次,每次15 min ,然后与辣根过氧化物酶标记的二抗室温孵育2 h,洗膜后加入免疫印迹化学发光剂DAB,室温显色20 min,暗室中X 线片曝光。 β-actin 作为内参照,天能凝胶成像仪分析系统(TANON 2500R 型)获取图像并进行半定量分析。
1.2.4 MDC 染色法检测溶酶体功能变化 细胞以5×104铺于24孔板,按实验分组细胞处理24 h 后:①PBS 洗2 遍,弃上清;②加入50 umol/L MDC 染液200 μL/孔,37 ℃温育60 min; ③4%多聚甲醛500 μL/孔,固定15 min;④PBS 洗2 次,抗荧光淬灭剂封片。通过激光共聚焦显微镜 (Confocal Laser Scanning Microscope,CLSM)观察细胞内溶酶体的变化,并取图拍照。
2 结果
2.1 非热效应对辐射细胞线粒体损伤
以β-actin 的吸光度值作为内参照,对各组条带的吸光度值进行校正,进行半定量分析。 与阴性对照组相比各辐射组细胞的胞质内Cytochrome c 蛋白水平明显上调,并随着辐射剂量增加。同时与阴性对照组相比,辐射组细胞的Caspase-3 蛋白的活化形式即cleaved caspase-3 表达明显增加,这两种蛋白是细胞线粒体凋亡途径相关蛋白。 见图1。
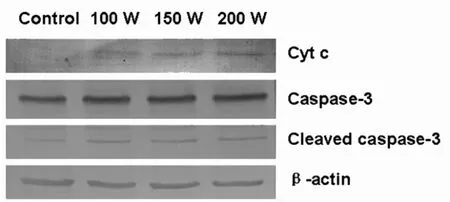
图1 Western 印迹检测Cytochrome、caspase-3 蛋白
2.2 非热效应对辐射细胞内质网损伤
Western 印迹检测阴性对照组以及辐射组细胞的内质网应激蛋白78(GRP78),结果辐射组细胞的胞质内GRP78 蛋白水平明显上调,并随着辐射剂量增加。GRP78 蛋白在正常组织细胞中表达水平较低,但在低糖、低氧、酸中毒、细胞毒性免疫反应等应激情况下,GRP78 蛋白表达水平显著升高。 同时与阴性对照组相比,辐射组细胞的Caspase-4 蛋白活化,这两种蛋白是细胞内质网应激相关蛋白。 见图2。

图2 Western 印迹检测GRP78、caspase-4 蛋白
2.3 非热效应对辐射细胞溶酶体损伤
Western 印迹检测结果显示:与阴性对照组相比,微波辐射非热效应可以导致A549 细胞溶酶体蛋白水解酶Cathepsin D 表达增加(图3),此结果表明微波辐射后的非热效应,可引起细胞溶酶体功能增强,释放Cathepsin D 增多,并且是随着辐射剂量而增加。Cathepsin D 是一种酸性溶酶体蛋白酶,在酸性环境中可溶解基底膜,降解细胞外基质和结缔组织,与侵袭性生物学行为有关。 同时MDC 染色后共聚焦显微镜观察,显示见实验组荧光明显增强,表明微波辐射非热效应可以导致A549 内的自噬情况增加,微波处理后的细胞胞浆中出现了大量的自噬泡,并且是随着辐射剂量而增加。 进一步说明非热效应导致受损细胞利用溶酶体降解自身损伤的细胞器和大分子物质。 阴性对照组却很少发现发现自噬泡的生成。 见图4。

图3 Western 印迹检测Cathepsin D 蛋白

图4 MDC 染色共聚焦显微镜观察溶酶体变化
3 讨论
目前,伴随微波的生物学效应及其机制研究不断深入,微波对生物体的非热效应引起了人们的极大关注。 非热效应是指热效应以外的微观生物学效应。 很多学者认为,微波的非热效应主要作用机制是作为一种信号作用于细胞膜, 通过细胞信息传导激活控制细胞代谢和生长的酶系统, 导致相应的基因转录和翻译水平、细胞因子、信号通路等的改变,影响细胞的增殖和分化进而影响细胞的功能。 但由于各种理论未能完全阐明 “非热效应”的作用机理,尤其是实验的重复性也差,所以引起争论。 该研究以A549 细胞为研究对象,建立微波辐射非热效应模型,验证“非热效应”的存在,并且认为“热效应”对组织细胞所造成的损伤反应可能是通过细胞线粒体、 内质网和溶酶体途径共同所诱导的细胞凋亡。
该研究显示, 微波辐射非热效应致A549 细胞胞质内Cytochrome c 蛋白水平明显上调, 并随着辐射剂量而增加。 Cytochrome c 在线粒体电子传递链中负责传递电子, 释放增多可使线粒体产生更多超氧阴离子自由基和H2O2 以及活性氧。 活性氧的积累又将导致线粒体膨胀,内膜非特异性孔道产生,细胞色素c 从内膜脱落并释放到胞质中,加剧活性氧的产生,引起氧化应激损伤细胞,促进细胞凋亡的发生[2]。 caspase-3 是细胞凋亡过程中最关键的执行分子之一, 多数诱发凋亡的信号都要经过caspase 的介导,最终由caspase-3 执行细胞 凋亡[3]。 cleaved caspase-3 是caspase-3 活化时经剪切产生的活性片段,是有活性的caspase-3,其表达程度可反应caspase-3 的活性状态和细胞凋亡的大致情况。 该研究采用检测cleaved caspase-3 的方法了解caspase-3 的激活状态,结果发现,辐射组细胞的Caspase-3 蛋白明显活化,认为微波辐射非热效应对A549 细胞的线粒体造成一定的损伤,并启动凋亡途径。 微波辐射非热效应导致A549 细胞内质网应激,通过抑制蛋白合成、促进错误折叠蛋白降解等机制保护发生内质网应激的细胞。 葡萄糖调节蛋白GRP78 即内质网应激蛋白,属于热休克蛋白70 家族成员,其在促进蛋白加工、成熟以及维持内质网稳态中发挥重要作用。 多种扰乱内质网功能的刺激均能够诱导GRP78 表达[4-5]。 在内质网应激反应过程中,GRP78 的诱导表达对应激细胞抵抗凋亡和恢复正常功能具有重要意义。 Caspase-4 是鼠类凋亡蛋白Caspase-12 的人类同源物,在内质网应激持续活化时被激活, 活化下游Caspase 蛋白激酶,caspase-12 是内质网应激诱导调亡的关键分子[6-8]。该研究结果显示辐射组细胞胞质内的GRP78 蛋白水平明显上调, 并随着辐射剂量增加,表明微波辐射非热效应对A549 细胞的内质网造成一定的损伤,并通过高表达GRP78 蛋白抵抗凋亡。 但是随后Caspase-4 蛋白的表达增加表明损伤加重,分析认为GRP78 与caspase12 交互作用共同调控着凋亡的发生。 具体调控机制还有待进一步深入的研究。 至于Cathepsin D 是溶酶体内的天冬氨酰蛋白酶,在多种病理条件下可见其表达增加,与细胞溶酶体途径凋亡密切相关[9]。 MDC 染色曾经被作为自噬体的标志,广泛用于自噬检测。 然而,目前的研究显示MDC 是与细胞内酸性囊泡结合(溶酶体或自噬性溶酶体)而不是特异的结合自噬体。 该研究中随着微波剂量的增加,Western 印迹检测结果显示, 溶酶体Cathepsin D 蛋白表达增高,通过共聚焦显微镜观察MDC 染色明显增强,提示微波辐射非热效应可以导致溶酶体途径凋亡发生,并且微波辐射非热效应对A549 细胞诱导凋亡作用呈现剂量依从性。
微波是300 MHz~300GHz 频率范围内的非电离辐射, 伴随着广泛应用于雷达、航空、通信工业以及医学领域,人们曝露于微波辐射的机会越来越多, 微波辐射可能产生生物效应及其对健康的影响已经受到公众以及研究人员的非常关注。 Omura 等人研究认为环境中,例如彩电、计算机、微波炉、移动电话等产生的电磁场对人体的影响包括甚至是以“非热效应”为主。 而微波“非热效应”对生物体产生的影响是复杂的,多数学者认为其生物学功效是多基因协同调控及蛋白表达所产生的作用, 这与该研究的结论是一致的,但具体分子机制还尚未阐明。 今后有关微波对肿瘤细胞的作用及其诱导凋亡不同途径之间的关系的更深入研究,必将为充分、合理利用微波治疗肿瘤提供新线索,同时也将为微波有效防护提供一定新的理论依据。
[1] 文静, 徐天昊, 彭瑞云.微波辐射损伤及防护研究进展[J].军事医学科学院院刊, 2009, 33(4):385-387.
[2] 李晓明, 韩芳, 石玉秀.线粒体凋亡路径参与创伤后应激障碍大鼠海马神经元凋亡的调控[J].解剖学报,2010, 41(2):201-204.
[3] Zhi-Jun Dai,Xi-Jing Wang,Zong-Fang Li, et al.Scutellaria barbate extract induces apoptosis of hepatoma H22 cells via the mitochondrial pathway involving caspase-3[J].World J Gastroenterol 2008 December 28;14(48):7321-7328.
[4] Vanya I,Rasheva ,Pedro M.Domingos.Cellular responses to endoplasmic reticulum stress and apoptosis[J].Apoptosis,2009,14:996-1007.
[5] Dai RY,ChenY,Fu J,et al.p28GANK inhhibits endoplasmic reticulum stress-induced cell death via endoplasmic reticulum adaptive capacity[J].Cell Res,2009,19(11):1243-1257.
[6] 李蕊君, 何昆仑, 李鑫.Grp78 和caspase-12 在缺氧心肌细胞中的表达[J].军医进修学院学报,2011,32(3):270-272.
[7] Ron D, Walter P.Signal integration in the endoplasmic reticulum unfolded protein response[J].Nat Rev Mol Cell Biol, 2007, 8(7):519-529.
[8] Glembotski CC.The role of the unfolded protein response in the heart[J].J Mol Cell Cardiol, 2008, 44(3):453-459.
[9] 张延波, 陈溪萍, 陶陆阳.大鼠脑外伤后溶酶体酶Cathepsin-B 和D的表达[J].法医学杂志,2006,22 (6):404-406.
