多指标综合评价玉竹酒蒸炮制工艺
2013-12-05王冬梅吕振江王永红张春孙
王冬梅,吕振江,王永红,张春孙
(1.西北农林科技大学 林学院,陕西 杨凌 712100;2.上海睿智化学研究有限公司,上海 201203)
玉竹Ploygonatum odoratum为百合科Liliaceae黄精属Ploygonatum多年生草本植物,以干燥根茎入药[1-2]。玉竹是中国的传统中草药,且可药食两用。该药性甘,微寒,能养阴润肺,益胃生津,用于燥热、伤阴、热伤胃阴之症[3-4]。药理研究表明,玉竹能增强免疫力,煎剂有扩张血管、抗急性心肌缺血、降压、抗衰老、抗菌作用,注射液有降血脂、抗动脉粥样硬化、抗肿瘤等作用[5-6]。玉竹的药理作用与其多种活性成分有密切关系。糖类是玉竹的主要成分,其次是黄酮类化合物和甾体皂苷[7-9]。目前,国内外对玉竹的研究主要集中在化学成分、药理作用、临床疗效等方面,而对玉竹的炮制方法、炮制工艺及饮片的质量标准鲜有研究。玉竹为传统中药,临床需炮制后方可入药[10]。玉竹干条、干片(饮片)也是玉竹进入药材市场的主要方式[11]。《中华人民共和国药典》所颁布的玉竹炮制规范中仅涉及其除杂、水洗,润透,切厚片或段,干燥等工艺,而且对具体的工艺参数没有规范,另外,目前对玉竹生品加工的研究主要是关于药材干燥方法和去皮、切片等处理[12-14]。由于不同操作的人有不同的经验,所得产品很难一致,甚至存在误传误用,严重影响了中药的疗效。陈胜璜等[15]研究表明,玉竹的炮制方法主要有蒸法(清蒸、酒蒸、和蜜蒸)和炒法(清炒、蜜炒)2类,蒸法优于炒法,但却未说明具体的蒸制影响因素。作者在前期研究中已对玉竹蜜蒸炮制工艺进行了研究,确定了玉竹蜜蒸炮制的最优条件,但却没有对玉竹酒蒸工艺进行进一步的深入研究和比较,因此,为了进一步确定玉竹炮制的最佳方法和工艺条件,本研究以多糖、皂苷、黄酮、醇提物、水溶物和水分等6个指标为评价标准,以6种成分的抗氧化活性和含量为基础,采用多指标综合评分法及正交试验优化了玉竹的酒蒸炮制工艺,以期为改善玉竹炮制品的质量,提升玉竹在药用或保健食品等方面的应用价值提供基础理论依据。
1 材料与方法
1.1 材料、仪器与试剂
1.1.1 试验材料 玉竹根茎于2010年10月采自秦岭太白山厚畛子。样品由西北农林科技大学林学院李登武教授鉴定,切成薄片,自然干燥后备用。
1.1.2 仪器与试剂 TU1810型紫外可见分光光度计(北京普析通用仪器有限责任公司);JA5003型分析天平(上海舜宇恒平科学仪器有限公司);R-GG17型旋转蒸发仪(上海申生科技有限公司);SHB-Ⅱ型循环水式多用真空泵(郑州长城科工贸有限公司);101-1型电热恒温鼓风干燥箱(北京科伟永兴仪器有限公司);HHSY2-N18型电热恒温水浴锅(哈尔滨东联公司)。无水葡萄糖(广东光华化学厂有限公司,批号20100508),薯蓣皂苷元(中国药品生物制品检定所,批号111539-20000),芦丁(中国药品生物制品检定所,批号100080-200707),黄酒(乙醇体积分数为 14.5%,总糖以葡萄糖计≤15.0 g·L-1)。苯酚、浓硫酸、高氯酸、甲醇、无水乙醇、亚硝酸钠、氢氧化钠、三氯化铝均为分析纯。
1.2 方法
1.2.1 实验设计 玉竹酒蒸工艺中有4个关键因素:酒润时间、黄酒用量、蒸制时间和蒸制温度。每个因素根据实际生产选定5个水平进行单因素实验。根据单因素实验结果,再选定3个因素和3个水平进行正交实验(表1)。

表1 试验因素和水平Table 1 Factors and levels of factor experiential
1.2.2 样品的炮制 称取玉竹药材60.00 g,置于适宜容器内,依据表1设计的炮制条件进行炮制。先用定量的黄酒(A)拌匀,闷润(D)至黄酒被吸尽后,再按蒸制时间(B)和蒸制温度(C)进行炮制。60℃干燥4 d后,测定炮制品中各指标(表2)。

表2 指标权重Table 2 Weight of index
1.2.3 多糖测定[16-17]①标准曲线的制备。精密称取无水葡萄糖标准品60.0 mg,用蒸馏水溶解定容至100.0 mL。分别精密吸取1.0,1.5,2.0,2.5,3.0,3.5 mL上述标准液并定容至 50.0 mL。分别吸取2.0 mL上述溶液置试管中,加入1.0 mL体积分数为5%苯酚,7.0 mL浓硫酸,摇匀,静置5 min,沸水浴加热15 min,置冰水浴5 min。另吸取2.0 mL蒸馏水重复上述操作,做空白对照。在波长490 nm处测吸光度。以质量(mg)为横坐标,吸光度(A)为纵坐标绘制标准曲线,得回归方程y=5.733 33x+0.032 4(r=0.999 6,线性范围0.024~0.120 mg)。②样品中多糖测定。称取玉竹样品2.00 g,加水200.0 mL,浸泡12.0 h,80℃回流1.5 h,提取1次,合并滤液,浓缩至5.0 mL,加无水乙醇至醇体积分数为95%,加入1.0 mol·L-1氢氧化钠,调节酸碱度至pH 7,静置12.0 h,过滤,将滤渣于60℃下鼓风烘干即得多糖精制品。取多糖精制品25.0 mg,加水溶解并定容至50.0 mL,吸取3.0 mL加水定容至50.0 mL,得样品溶液。吸取样品溶液2.0 mL,按标准曲线制备的方法操作,显色,测定,计算多糖。
1.2.4 皂苷测定[18]①标准曲线的制备。精密称取3.0 mg薯蓣皂苷元,用甲醇溶解并定容至10.0 mL,精密移取0.2,0.3,0.4,0.5,0.6,0.7,0.8 mL上述溶液,用高氯酸定容至10.0 mL,旋涡混匀1 min后置70℃水浴中加热15 min,立即置于冰水浴中5 min以停止反应,以高氯酸为空白对照,在波长408 nm处测定吸光度。以质量(mg)为横坐标,吸光度为纵坐标绘制标准曲线,得回归方程y=3.549 8x+0.077 0(r=0.999 9,线性范围0.060~0.240 mg)。②样品中皂苷测定。称取玉竹样品 5.00 g,加60.0 mL石油醚脱脂2.0 h,加入45.0 mL体积分数为70%乙醇浸泡12.0 h,80℃水浴中回流提取2次,1.5 h·次-1,合并滤液,浓缩至干。50.0 mL蒸馏水溶解,用正丁醇萃取3次,合并萃取液,浓缩至干即得皂苷粗品。用甲醇溶解皂苷粗品并定容至50.0 mL,取溶液0.5 mL,按标准曲线制备的方法操作,测吸光度,根据回归方程计算样品中皂苷。
1.2.5 黄酮测定[19]①标准曲线的制备。精密称取4.00 mg芦丁对照品,用体积分数为60%乙醇溶解并定容至100.0 mL容量瓶中,即得对照品溶液。分别移取1.0,2.0,4.0,6.0,8.0,10.0 mL对照品溶液于 25.0 mL 容量瓶中,加入 1.0 mL 0.50 mol·L-1亚硝酸钠(NaNO2),静置 5 min 后加 1.0 mL 0.30 mol·L-1氯化铝(AlCl3)溶液,摇匀,5 min后加入5.0 mL 1.0 mol·L-1氢氧化钠溶液,用体积分数为60%乙醇定容至刻度,空白对照用体积分数为60%乙醇代替对照品溶液,在525 nm波长处测吸光度。以质量(mg)为横坐标,吸光度为纵坐标绘制标准曲线,得回归方程y=0.500 01x-0.003 4(r=0.999 3,线性范围0.040~0.400 mg)。②样品中黄酮含量的测定。称取玉竹样品5.00 g,加60.0 mL体积分数为70%的乙醇,浸泡1.0 h,在80℃水浴中回流提取2次,2.0 h·次-1,合并滤液,定容至250.0 mL。吸取溶液5.0 mL,按标准曲线制备的方法操作,测吸光度,根据回归方程计算样品中黄酮。
1.2.6 水分测定 将各酒蒸玉竹样品冷却至室温后,精密称取1.00 g,60℃下烘干至恒质量后,计算水分含量。
1.2.7 水溶物测定 称取酒蒸玉竹样品2.00 g于锥形瓶中,加水50.0 mL,静置1.0 h后,80℃水浴回流1.0 h,过滤,滤液减压浓缩至干,称量,计算水溶物。
1.2.8 醇溶物测定度 称取酒蒸玉竹样品2.00 g于锥形瓶中,加50.0 mL无水乙醇,静置1.0 h后,80℃水浴回流1.0 h,过滤,滤液减压浓缩至干,称量,计算醇溶物。
1.2.9 层次分析法[20-21]①层次分析法的基本思路。通过将复杂问题分解为若干层次或若干要素,并在同一层次各要素之间简单地进行比较、判断和计算,即可以得出不同方案的重要度,从而为选择最佳方案提供决策依据。②权重系数的确定。根据层次分析法原理,以多糖、皂苷、黄酮、醇溶物、水溶物和水分6个指标为评价标准,以6种成分的抗氧化活性和含量为基础[22-24],反应玉竹酒蒸工艺的总评价目标,建立评价目标树,确定权重系数(表2)。经一致性检验,判别矩阵的一致性比例<0.10,表明权重系数合理有效。
权重系数计算公式:

1.2.10 单因素试验[25]选取影响酒蒸工艺的几个主要参数,酒润时间、料液比、酒蒸时间、酒蒸温度,分别讨论各参数对各指标的影响。试验因素和水平见表1。
1.2.11 工艺优化试验 根据正交试验设计原理,在单因素试验结果的基础上,选取料液比(A)、酒蒸时间(B)、酒蒸温度(C)3个因素,每个因素设置3个水平(表1)。以多糖、皂苷、黄酮、醇提物、水溶物和水分6个指标为考察对象,进行L9(34)正交试验,利用层次分析法进行多指标评价一步优选玉竹酒蒸工艺。
2 结果与分析
2.1 单因素实验结果
从表3及图1可以看出:4个因素对各指标的综合得分均在第2水平达到最大值。即综合得分在酒润时间为2.0 h,料液比为100∶20、温度为70℃及蒸煮时间为2.0 h时分别达到最高。图1还显示:酒润时间各水平的综合得分变化较平缓,说明该因素对各指标的影响较小。所以在正交试验设计中不再考虑该因素。
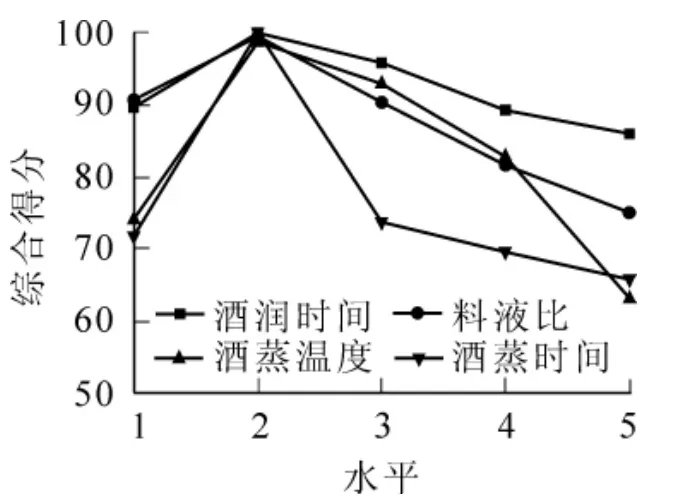
图1 单因素试验结果Figure 1 Result of single factor experiment
2.2 工艺优选试验
根据正交试验设计原理,在单因素试验结果的基础上,选取料液比(A),酒蒸时间(B),酒蒸温度(C)3个因素,每个因素设置3个水平(表1)。以多糖、皂苷、黄酮、醇提物、水溶物和水分6个指标为考察对象,进行L9(34)正交试验,利用层次分析法进行多指标评价一步优选玉竹酒蒸工艺[26-27]。
直观分析结果(表4)表明:以综合评分为评价标准,在所选的因素水平范围内,料液比对玉竹各指标的提取效果影响最大,酒蒸时间影响较小,酒蒸温度影响最小。方差分析结果(表5)表明:料液比对综合评分的影响均达到显著水平,具有统计学意义(P=0.037),酒蒸温度、酒蒸时间影响不显著。选取最佳酒蒸条件为A2B3C1;即料液比为100∶20,酒蒸温度为60℃,酒蒸时间为3.0 h。
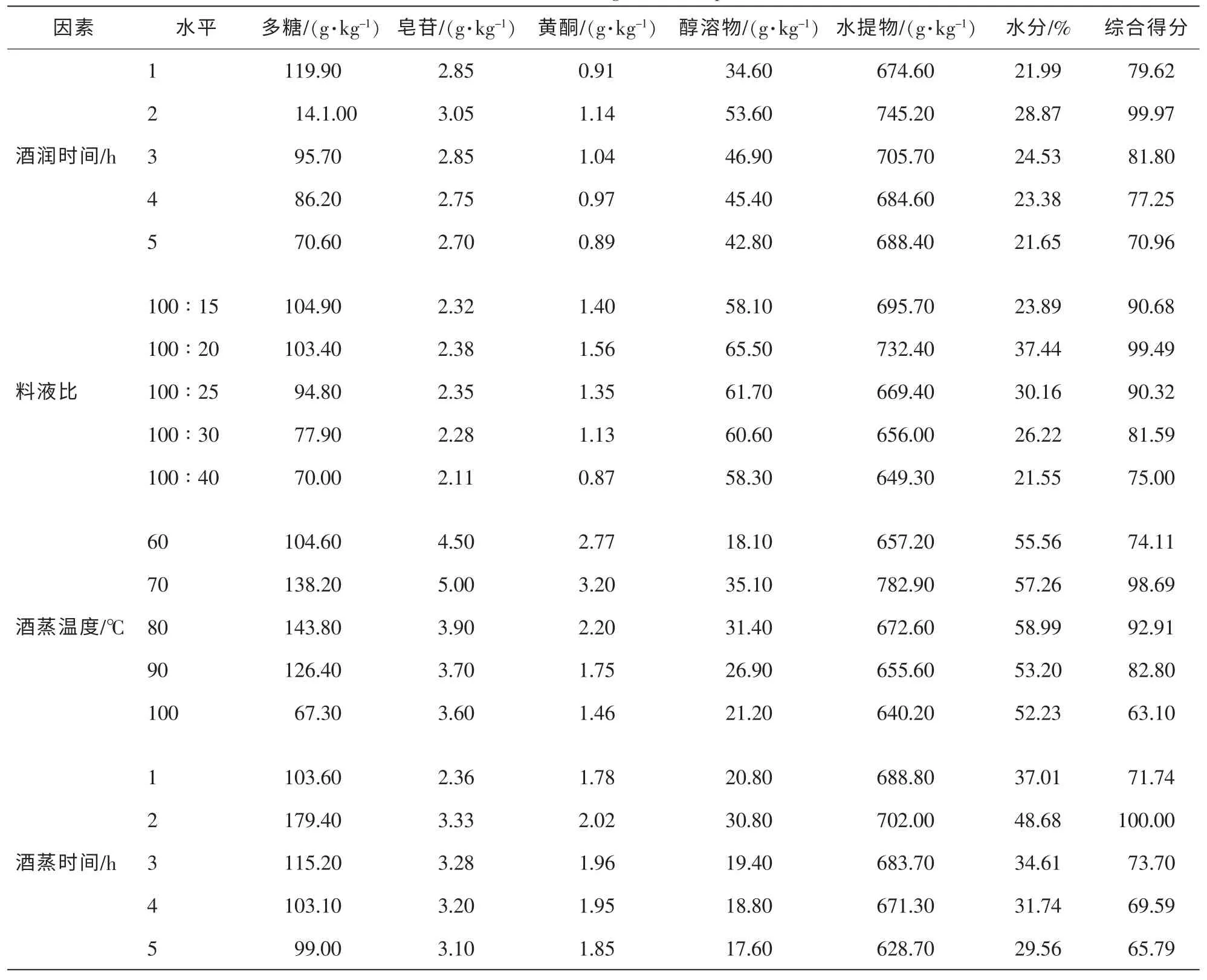
表3 单因素试验结果Table 3 Result of single factor experiment

表4 L9(34)正交试验结果Table 4 Results of L9(34)orthogonal test
各因素不同水平间多重比较结果显示(表6),料液比的后2个水平差异不显著,酒蒸温度、酒蒸时间的3个水平之间差异不显著,因此,从节约原料,经济价值,减少能耗等方面考虑,本研究最终选取的酒蒸条件为A2B1C1;即料液比为100∶20,酒蒸温度为60℃,酒蒸时间为1.0 h。
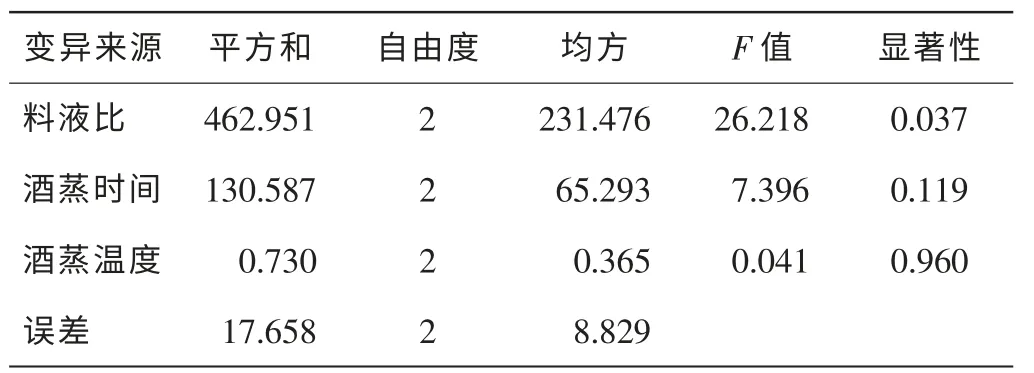
表5 正交试验方差分析Table 5 Variance analysis of orthogonal test
3 结论
本实验结果表明:酒润时间对玉竹各指标综合得分的影响最小,料液比、酒蒸时间、酒蒸温度3个因素对各指标综合得分影响较大,且均在第二水平综合得分最高。正交试验分析结果表明:料液比对各指标综合得分影响最显著,酒蒸时间、酒蒸温度两因素均不显著。综合直观分析、方差分析、多重比较、生产成本及周期,本研究最终选取的酒蒸条件为A2B1C1,即料液比为100∶20,酒蒸温度60℃,酒蒸时间1.0 h。
中药炮制和制药、临床应用关系密切,大部分药材需经过炮制才能用于临床和制剂的生产。药物在炮制过程中,往往需要加入一些辅料与药物一起共制,目的在于消除有害物质,发挥有利作用。如酒、醋、盐、姜、蜂蜜等,经过添加不同的辅料炮制后起的作用各异。如酒蒸黄精可免去生用刺激咽喉的毒副作用[28-29];酒蒸黄芩可阻止黄芩素酶解,利于保存药效等[30];酒蒸后的山萸肉补肝肾作用增强,常用于眩晕耳鸣、腰膝酸软等症[31]。由于玉竹炮制前、后与药效相关的关键化学成分尚未完全明确,因此,有关玉竹酒蒸后具体的药效变化及炮制机制还有待进一步研究。
[1]国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:78-79.
[2]江苏新医学院.中药大辞典[S].上海:上海人民出版社,1977:1156.
[3]许金波,陈正王.玉竹多糖抗肿瘤作用及其对免疫功能影响的实验研究[J].深圳中西医结合杂志,1996,6(1):13-15.XU Jinbo,CHEN Zhengwang. Study of the polygonatum polysaccharide for the anti-tumor effected and the immune function impacted[J].Shenzhen J Int Trad Chin Western Mede,1996,6(1):13-15.
[4]李尘远,刘艳华,李淑华,等.玉竹提取物B对人结肠癌CL-187细胞的抑制作用[J].锦州医学院学报,2003,24(1):40-42.LI Chenyuan,LIU Yanhua,LI Shuhua,et al.A poptosis in human colon cancer CL-187 cells induced by the extract B of Polygonatum odoratum[J].J Jinzhou Med Coll,2003,24(1):40-42.
[5]潘兴瑜,张明策,李宏伟.玉竹提取物 B对肿瘤的抑制作用[J].中国免疫学杂志,2000,16(7):376-377.PAN Xingyu,ZHANG Mingce,LI Hongwei.Inhibitory action of EB-PAOA on tumor[J].Chin J Immunol,2000,16(7):376-377.
[6]李尘远,刘玲,潘兴瑜.玉竹提取物B对Hela细胞的抑制作用[J].锦州医学院学报,2003,24(5):1-3.LI Chenyuan,LIU Ling,PAN Xingyu.The inhibition effect of the extract B of Polygonatum odoratum on Hela cells[J].J Jinzhou Med Coll,2003,24(5):1-3.
[7]胡思玉.玉竹保健饮料的研制[J].食品与机械,1984(4):24.HU Siyu.Research for Polygonatum odoratum aureus drink[J].Food & Mach,1984(4):24.
[8]WANG Dongmei,LI Dengwu,ZHU Wei,et al. A new C-methylated homoisoflavanone and triterpenoid from the rhizomes of Polygonatum odoratum[J].Nat Prod Res,2009,23(6):580-589.
[9]WANG Dongmei,LI Dengwu,ZHU Wei,et al. Steriodal saponins from the rhizomes of Polygonatum odoratum[J].Nat Prod Res,2009,23(10):940-947.
[10]肖永庆,张村,李丽.中药炮制研究回顾与展望[J].世界科学技术:中药现代化,2009,11(4):536-540.XIAO Yongqing,ZHANG Cun,LI Li.The review and prospect of processing Chinese materia medica[J].World Sci Technol Mod Trad Chin Med Mat Med,2009,11(4):536-540.
[11]彭秧锡,刘士军,郭军,等.玉竹的研究开发现状与展望[J].食品研究与开发,2005,26(6):120-122.PENG Yangxi,LIU Shijun,GUO Jun,et al. Present situation and perspective of Polygonatum odoratum product research and development[J].Food Res Dev,2005,26(6):120-122.
[12]张永清,徐凌川,王丽萍,等.玉竹产地直接切片晒干的可行性研究[J].中药材,1996,19(12):620.ZHANG Yongqing,XU Lingchuan,WANG Liping,et al. The feasibility study of the direct slicing dried for the place of Polygonatum production[J].J Chin Med Mat,1996,19(12):620.
[13]张永清,李岩坤,蓝翠兰,等.玉竹去皮晒千与直接晒干的质量对比[J].山东中医学院学报,1996,20(6):407.ZHANG Yongqing,LI Yankun,LAN Cuilan,et al.quality comparison between the peeled dried and directly dried of Polygonatum[J].J Shandong Coll Trad Chin Med,1996,20(6):407.
[14]张永清,丁少纯.干燥方法对玉竹药材质最的影响[J].基层中药杂志,1998,12(4):14-16.ZHANG Yongqing,DING Shaochun.The impact for the quality of Polygonatum with different drying methods[J].J Primary Trad Chin Med,1998,12(4):14-16.
[15]陈胜璜,蒋孟良,周日宝.不同炮制方法对玉竹质量的影响[J].湖南中医药大学学报,2007,27(3):18-19.CHEN Shenghuang,JIANG Mengliang,ZHOU Ribao. Different processing methods on the quality of Polygonatum[J].J Trad Chin Med Univ Hunan,2007,27(3):18-19.
[16]国家药典委员会.中华人民共和国药典:一部[S].北京:化学工业出版社,2005:附录ⅡD.
[17]彭秧锡,彭月明.苯酚-硫酸分光光度法测定玉竹中多糖含量[J].化学分析计量,2006,15(5):29-31.PENG Yangxi,PENG Yueming. Determination of polyoses in Polygonatum by phenol-sulfuric acid visible spectrophotometer[J].Chem Anal Met,2006,15(5):29-31.
[18]王光忠,刘伟伟.分光光度法测定盾叶薯蓣总皂苷的含量[J].湖北中医学院学报,2008,10(2):44-45.WANG Guangzhong,LIU Weiwei. Determination of total saponins in Dioscorea zingiberensis C.H.wright by colorimetric analysis[J].J Hubei Univ Chin Med,2008,10(2):44-45.
[19]彭秧锡,陈启元.分光光度法测定玉竹中黄酮类化合物的含量[J].华西药学杂志,2006,21(6):604-605.PENG Yangxi,CHEN Qiyuan.Determination of flavonoids in Polygonatum odoratum by spectrophotometry[J]. West China J Pharm Sci,2006,21(6):604-605.
[20]任爱农,卢爱玲,田耀洲,等.层次分析法用于中药复方提取工艺的多指标权重研究[J].中国中药杂志,2008,33(4):372-374.REN Ainong,LU Ailing,TIAN Yaozhou,et al.AHP application to study of weighted coefficient on multicriteria optimization of extraction technology about Chinese traditional compound drugs[J].China J Chin Mat Med,2008,33(4):372-374.
[21]王晖,陈丽,陈垦,等.多指标综合评价方法及权重系数的选择[J].广东药学院学报,2007,23(5):583-589.WANG Hui,CHEN Li,CHEN Ken,et al. The choice of multi-index comprehensive evaluation method and weight coefficient[J].J Guangdong Coll Pharm,2007,23(5):583-589.
[22]阎欲晓,石庆师.玉竹多糖分离纯化及自由基清除能力研究[J].食品工业科技,2009,30(2):149-151.YAN Yuxiao,SHI Qingshi.Study on separation,purification and scavenging free radical of polysaccharide in Polygonatum odoratum[J].Sci Technol Food Ind,2009,30(2):149-151.
[23]徐大量,林辉,李盛青,等.玉竹水提液体内外抗氧化的实验研究[J].中药材,2008,31(5):729-781.XU Daliang,LIN Hui,LI Shengqing,et al.Study on in vitro and in vivo antioxidant activity of the aqueous extract from Polygonatum odoratum[J].J Chin Med Mat,2008,31(5):729-781.
[24]张轩铭,王冬梅,王瑾,等.不同产地玉竹黄酮提取物体外抗氧化活性研究[J].西北植物学报,2011,31(3):628-631.ZHANG Xuanming,WANG Dongmei,WANG Jin,et al. In vitro antioxidative activities of Polygonatum odoratum flavonoids extracts from different regions in China[J].Acta Bot Boreali-Occident Sin,2011,31(3):628-631.
[25]冉懋雄,郭建民.现代中药炮制手册[M].北京:中国中医药出版社,2002:286-288.
[26]张彤,徐莲英,陶建生,等.多指标综合评分法优选葛根提取工艺[J].中草药,2004,35(1):38-40.ZHANG Tong,XU Lianying,TAO Jiansheng,et al.Applying grading methods of synthesizing multiple guidelines to optimizing extract technology for Radix puerariae[J].Chin Tad Herbal Drug,2004,35(1):38-40.
[27]刘先琼,徐腊英.多指标综合加权评分研究乌梅炭炮制工艺[J].中草药,2009,40(12):1898-1900.LIU Xianqiong,XU Laying.Processing technology for Prunus mume carbon by comprehensive weighted of multi-index[J].Chin Trad Herbal Drug,2009,40(12):1898-1900.
[28]张洁,杨云,马百平.中药黄精炮制的历史沿革及现代研究[J].河南中医学院学报,2005,20(3):28-29,31.ZHANG Jie,YANG Yun,MA Baiping.The research development of processing chinese herb-rhizoma polygonti[J].J Henan Univ Chin Med,2005,20(3):28-29,31.
[29]庞玉新,赵致,冼富荣.黄精的炮制研究[J].时珍国医国药,2006,17(6):921.PANG Yuxin,ZHAO Zhi,XIAN Furong.The study of processing on Polygonatum sibiricum[J].Lishizhen Med Mat Med Res,2006,17(6):921.
[30]温华珍,肖盛元,王义明,等.黄芩化学成分及炮制学研究[J].天然产物研究与开发,2004,16(6):575-580.WEN Huazhen,XIAO Shengyuan,WANG Yiming,et al.General situation of chemical constitutions and drug-processing of Scutellaria baicalensis Georgi[J].Nat Prod Resd Dev,2004,16(6):575-580.
[31]刘波,江崇湖,朱冬梅.酒蒸山萸肉炮制工艺的研究[J].山东中医杂志,2007,26(9):634-635.LIU Bo,JIANG Chonghu,ZHU Dongmei.Study on the processing technology of wine fried common macrocarpium fruit[J].Shandong J Trad Chin Med,2007,26(9):634-635.
