IGF2在小鼠胚胎干细胞定向分化为胰岛样细胞过程中的表达*
2013-12-03汤佳珍朱凌燕甘华侠
刘 峰 汤佳珍 朱凌燕 甘华侠
胚胎干细胞(embryonic stem cells,ES细胞)具有无限增殖和全能分化的潜力,理论上ES细胞具有分化为各种细胞的潜能[1],目前已成功将ES细胞诱导分化为多种终末组织细胞,成为细胞和器官移植领域最具潜在优势的资源[2-3]。基因组印迹是指某些基因呈不遵从孟德尔定律依靠单亲传递某些遗传学性状的现象,也就是某些基因呈亲源依赖性单等位基因表达[4],是目前表观遗传学研究的主要内容之一。有研究显示,体外长期培养的ES细胞,其表观遗传学呈现不稳定趋势[5]。经体外受精(IVF)得到的ES细胞,存在基因组印迹异常[6]。鼠胰岛素样生长因子(IGF)2基因位于7号染色体上,是最早发现的印迹基因,胰腺的IGF2只从父本染色体表达。本研究旨在通过聚合酶链式反应-限制性内切酶片段长度多态性分析法(PCR-RFLP),检测印迹基因IGF2在诱导分化细胞中的表达情况,探讨体外诱导培养对基因组印迹的影响。
1 材料与方法
1.1 材料 小鼠ES细胞系由美国斯坦福大学Andrew.R.Hoffman惠赠。试剂:Knock-out DMEM、DMEM/F12、L-谷氨酰氨、胎牛血清(FBS)和TRIzol购自Invitrogen公司,白血病抑制因子(LIF)购自Chemicon公司,全反式维甲酸(all-trans retinoic acid,RA)和尼克酰胺(nicotinamide,NIC)购自Sigma公司,N2添加物、B27添加物购自GIBCOBRL公司,Activin A购自Ramp;D公司,逆转录试剂盒和Taq DNA聚合酶购自Fer⁃menta公司,限制性内切酶购自NEB公司,胰岛素单克隆抗体购自abcam公司,C肽单克隆抗体购自Licon公司。
1.2 方法
1.2.1 逆转录(RT)-PCR检测诱导分化后胰岛细胞标志基因的表达情况 按常规法培养扩增ES细胞,参照Shi等[7]的三阶段法诱导培养。分化各阶段细胞总RNA按TRIzol说明书提取,逆转录合成cDNA。引物序列及PCR的条件见表1。反应体系为10 μL,具体如下:10×缓冲液1.0 μL,MgCl2(25 mmol/L)0.8 μL,dNTPs(10 mmol/L)0.2 μL,Taq 酶(5 U/μL)0.2 μL,引物(10 μmol/L,正反引物Mix)0.2 μL,cDNA模板(0.1 g/L)0.2 μL,ddH2O 7.6 μL。反应条件:94 ℃预变性2 min后,94 ℃变性30 s,60℃(β-actin为58℃)退火30 s,72℃延伸30 s,完成30个循环,72℃5 min,琼脂糖凝胶上电泳,紫外灯下摄像观察。

Table 1 The primer sequence of islet-specific genes表1 胰岛细胞特异表达基因引物序列
1.2.2 免疫荧光染色 分化成熟的第3阶段细胞,免疫荧光检测胰岛素及C肽,收集的分化细胞用PBS洗去细胞中的培养基,加4%的多聚甲醛溶液室温下固定细胞;加一抗,室温1 h或4℃过夜孵育,加磷酸盐缓冲液(PBS)清洗3遍;孵育二抗,室温孵育1 h;PBS洗4次,每次5~10 min,然后用5%BSA室温封闭30 min;加DAPI(1∶1 000稀释)染核,室温避光孵育5 min,用PBS清洗2遍;将DAPI/Antifade Solution稀释30倍,滴适量到盖玻片上,室温染色20 min;PBS洗3次,每次5 min;封片剂封片,37℃烤片10 min,激光共聚焦显微镜下观察结果。
1.2.3 PCR-RFLP法分析诱导分化前后细胞印迹基因IGF2亲本表达 以分化前后细胞cDNA为模板,用特异性引物扩增印迹基因 IGF2,引物序列:5'-TGGCCCTCCTGGAGA⁃CRTACTGTGC-3',5'-CTGTCCCTGCTCAAGAGGAGGTCA-3',PCR产物(380 bp)用特异的限制性内切酶(BsaAI);酶切产物(380、321、59 bp)在2%琼脂糖凝胶进行电泳,溴乙锭染色,紫外投射仪上观察电泳结果并摄像。
2 结果
2.1 诱导分化各阶段细胞胰岛细胞性标志物的表达情况 胰岛素、胰高糖素、生长抑素、葡萄糖转运蛋白2在未分化的ES细胞中不表达,在诱导分化第2阶段末和第3阶段末的细胞都有表达,且在第3阶段比第2阶段要强,见图1。
2.2 最终分化细胞特异性蛋白表达 诱导分化终末细胞能表达胰岛细胞特异性激素蛋白胰岛素和C肽,见图2。
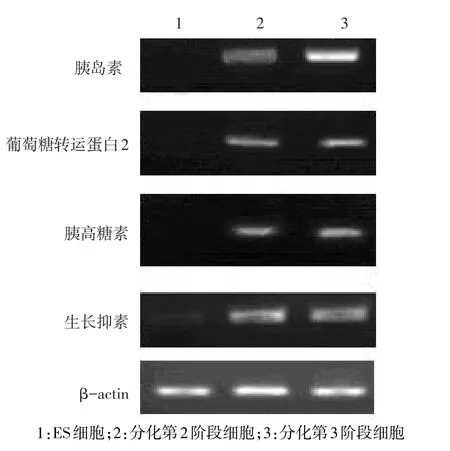
Figure 1 The expression of specific marker genes at different stages in islet cells图1 胰岛细胞标志基因在诱导分化各阶段的表达情况
2.3 PCR-RFLP检测印迹基因表达结果 印迹基因IGF2在分化终末的胰岛样细胞中呈双等位基因表达,见图3。

Figure 3 The expression of IGF2 at different stages图3 分化前后细胞印迹基因表达情况
3 讨论
ES细胞作为个体生长发育最早阶段来源的细胞,其分化的整个过程其实就是表观遗传调控基因表达的过程,遗传物质不变,其表型却可以有多种形式。环境因素、体外操作及内分泌因素的变化也对IGF2的印迹及胎盘和胎儿的发育有一定的影响。IGF2/H19的表观遗传修饰在早期发育时也容易受到环境频繁变化的影响,尤其是胚外组织[8]。应用乙醇处理胎盘发现,父系等位基因甲基化程度显著低于生理盐水处理的胎盘,提示外界因素对IGF2的印迹以及胎盘发育产生影响[9]。
本研究中ES细胞诱导分化过程中应用了Ac⁃tivin A和RA。Activin A是转化生长因子(TGF)超家族的一种二硫化物稳定蛋白,与细胞表面受体结合后诱导许多基因表达,对限定性内胚层的早期分化具有重要作用[10]。尤其胚胎干细胞在高浓度的Ac⁃tivin A培养作用下能大规模的向限定性内胚层细胞分化[11]。RA是神经外胚层和中胚层前肠尾端化特征性的信号分子[12]。RA为胚胎发育和细胞功能维持所必需,参与诱导细胞分化和促进细胞凋亡[13]。有研究表明,RA能够调节胚胎内胚层细胞分化,尤其是早期胰芽细胞的形成[14]。印迹基因IGF2的表达产物胰岛素样生长因子是一种胚胎生长因子,也是一种促有丝分裂肽,生理条件下对胚胎的正常生长发育有重要作用,病理条件下能刺激肿瘤细胞的增殖。在啮齿动物中,IGF2的表达在出生后迅速下降,相当于功能上的单倍体,即正常胎儿中只产生一个剂量的蛋白质;如果2个等位基因均不表达,将表现为生长受限;相反,如果2个等位基因均出现表达,必将产生2个剂量的蛋白质,导致胎儿过度生长,出生体质量过重或产后生长速度过快[15]。本研究的杂交ES细胞系,在IGF2等位基因中存在特异性的限制性内切酶多态位点。母源性表达的IGF2等位基因其RT-PCR产物可被酶解为321 bp及59 bp片段,父源性表达的IGF2等位基因则不被酶解。据此,酶解产物经琼脂糖凝胶电泳即可区分出IGF2等位基因的表达情况。研究表明,IGF2印迹丢失与多种疾病有关[16]。
笔者利用不同小鼠品系间等位基因限制性内切酶多态性,对杂交而来的SF1-G细胞诱导分化为胰岛样细胞,收集分化前后细胞,通过PCR-RFLP检测印迹基因IGF2表达亲本来源,结果显示,本来主要从父源单等位基因表达的印迹基因呈双等位基因表达,表现为印迹丢失状态(LOT),其机制有待进一步研究。本研究结果提示,在体外培养胚胎干细胞时,要尽量保持其微环境的稳定,避免引起表观遗传调控的异常,同时在应用胚胎干细胞资源时要监测其表观遗传的稳定性。

Figure 2 Immun of luorescence assay for detection of specific proteins in differentiated cells(×800)图2 分化细胞免疫荧光染色检测特异蛋白结果(×800)
[1]Rossant J.Stem cells from the Mammalian blastocyst[J].Stem Cells,2001,19(6):477-482.
[2]Pal R.Embryonic stem(ES)cell-derived cardiomyocytes:a good candidate for cell therapy applications[J].Cell Biol Int,2009,33(3):325-336.
[3]Hipp J,Atala A.Sources of stem cells for regenerative medicine[J].Stem Cell Rev,2008,4(1):3-11.
[4]Sun B,Ito M,Mendjan S,et al.Status of genomic imprinting in epi⁃genetically distinct pluripotent stem cells[J].Stem Cells,2012,30(2):161-168.
[5]Nguyen HT,Geens M,Spits C.Genetic and epigenetic instability in human pluripotent stem cells[J].Hum Reprod Update,2013,19(2):187-205.
[6]Li T,Vu TH,Ulaner GA,et al.IVF results in de novo DNA methyla⁃tion and histone metylation at an Igf2-H19 imprinting epigenetic switch[J].Mole Hum Repro,2005,11(9):631-640.
[7]Shi Y,Hou L,Tang F,et al.Inducing embryonic stem cells to differ⁃entiate into pancreatic βcells by a novel three-step approach with activin A and All-Trans retinoic acid[J].Stem Cells,2005,23(5):656-662.
[8]Turan N,Katari S,Gerson LF,et al.Inter-and intra-individualvari⁃ation in allele-specific DNA methylation and gene expression in⁃children conceived using assisted reproductive technology[J].PLoS Genet,2010,6(7):1-14.
[9]Haycock PC,Ramsay M.Exposure of mouse embryos to ethanol dur⁃ing preimplantation development:effect on DNA methylation inthe H19 imprinting control region[J].Biol Reprod,2009,81(4):618-627.
[10]Ueno S,Kario K.Transient complete inhibition of TGF-beta/activin/nodal signaling enhances cardiogenesis induced by canonical Wnt signaling in ES cells[C].England:Oxford Univ Press,2012.
[11]D’Amour KA,Agulnick AD,Eliazer S,et al.Efficient differentia⁃tion of human embryonic stem cells to definitive endoderm[J].Nat Biotechnol,2005,23(12):1534–1541.
[12]Goodman T,Crandall JE,Nanescu SE,et al.Patterning of retinoic ac⁃id signaling and cell proliferation in the hippocampus[J].Hippocam⁃pus,2012,22(11):2171-2183.
[13]Jagtap S,Meganathan K,Wagh V,et al.Embryo toxicity of alltrans-retinoic acid in human embryonic stem cells[J].Toxicology Letters,2012,211:S74-S75.
[14]Lefebvre P,Martin PJ,Flajollet S,et al.Transcriptional activities of retinoic acid receptors[J].Vitam Horm,2005,70:199-264.
[15]杨晓煜,黄燕芳.传代培养对供核细胞胰岛素样生长因子Ⅱ基因表达的影响[J].中国现代医生,2008,46(36):1-3.
[16]Ratajczak MZ.Igf2-H19,an imprinted tandem gene,is an important regulator of embryonic development,a guardian of proliferation of adult pluripotent stem cells,a regulator of longevity,and a'pass⁃key'to cancerogenesis[J].Folia Histochem Cytobiol,2012,50(2):171-179.
