硫化氢在SB203580影响肝星状细胞增殖、凋亡中的作用*
2013-12-03宋丽秀陈卫刚
徐 霞 李 睿 任 嫱 刘 芳 宋丽秀 郑 勇 陈卫刚△
硫化氢(hydrogen sulfide,H2S)被称为继NO、CO之后发现的第三种气体信号分子,它具有多种生理功能,尤其在肝纤维化中作用明显[1]。研究显示,内源性或外源性H2S能以多种方式调节细胞的增殖与凋亡,其作用与H2S的剂量和信号途径有关[2]。最近研究表明,H2S对肝纤维化及门脉高压的发生发展起重要的保护作用[3]。本研究通过Annexin V-FITC/PI双染法流式细胞术(FCM)检测肝星状细胞(hepat⁃ic stellate cell,HSC)凋亡情况,并用逆转录聚合酶链反应(PCR)法检测HSC中Ⅰ、Ⅲ型胶原mRNA表达,初步探讨H2S在P38丝裂原活化蛋白激酶(P38MAPK)阻断剂SB203580影响HSC增殖、凋亡中的作用。
1 材料与方法
1.1 材料 大鼠HSC-T6细胞株购自中南大学湘雅中心实验室;NaHS(美国Sigma公司);SB203580(德国Merck公司);DMEM(高糖)培养基、胎牛血清(FBS)、胰蛋白酶-EDTA(美国HyClone公司),二甲基亚砜(DMSO,美国Amersco公司),逆转录试剂盒(美国Fermentas公司),琼脂糖(Spanish公司),TRIzol(美国Invitrogen公司),四甲基偶氮唑盐(MTT,美国Sigma公司),Annexin V-FITC试剂盒(美国Biovision公司),流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 细胞培养 HSC-T6选用100 mL/L FBS DMEM(高糖)培养基,按1.5×105个/mL接种,37 ℃、5%CO2中培养,8 h常规贴壁,1~2 d换液,4~7 d后细胞铺满瓶底70%~90%传代,传代周期稳定即可用于实验。
1.2.2 实验分组 对照组:10%FBS的DMEM培养基;DMSO组:对照组基础上加DMSO,使DMSO终浓度为0.1%;NaHS组:对照组基础上加NaHS(H2S供体)至最适浓度;SB组:DMSO组基础上加SB203580至最适浓度;SB+NaHS组:SB组基础上加NaHS至最适浓度。
1.2.3 MTT法检测细胞增殖 在无菌96孔细胞培养板中接种传代的HSC,每组6复孔,调整细胞浓度为6×104个/mL,每孔加入200 μL细胞悬液,当细胞生长至80%以上融合度时,用无血清培养基同步化处理12 h。NaHS组分别按照25、50、75、100、200 μmol/L浓度梯度给药,SB组分别按照10、25、50、75、100 μmol/L浓度梯度给药,确定最适浓度。在CO2培养箱中继续孵育48 h后,除边缘孔外每孔均加入5 g·L-1的MTT 20 μL。反应4 h后用1 mL注射器吸去培养基,并加150 μL DMSO,反应30 min后用酶标仪测定其吸光度(A)值,测定波长570 nm,参考波长630 nm,计算A值=A570-A630,以消除非特异性光吸收效应。计算细胞增殖抑制率(IR),IR=(1-实验组A/对照组A)×100%。
1.2.4 FCM检测细胞凋亡 将传代的HSC接种于6孔培养板中,在细胞生长至80%以上融合度后,吸去原培养基,换为无血清培养基同步化处理24 h,按照实验分组分别加入相应浓度的NaHS和SB203580,加样后的各组细胞继续在CO2培养箱孵育48 h后开始取样,取样方法:每孔用PBS洗2遍,各加300 μL胰酶消化,持续吹打使其分散,PBS离心(1 000 r/min离心5 min)洗涤2次,加入binding buffer和Annexin V-FITC/PI双染色剂,4℃避光30 min后上机检测细胞凋亡率。
1.2.5 逆转录PCR法测Ⅰ、Ⅲ型胶原mRNA表达 应用TRIzol试剂按说明书提取HSC总RNA,用紫外分光光度仪测定总RNA的纯度及浓度。A260/A280≥1.8说明RNA纯度较高。琼脂糖凝胶电泳鉴定总RNA的完整性,-80℃保存待用。(1)cDNA第一链合成:逆转录使用RevertAidTMH minus First Strand cDNA Synthesis Kit,按照说明书方法进行。(2)逆转录PCR反应。PCR扩增反应体系为25 μL,其中cDNA 2 μL,上下游引物各0.5 μL,PCR Master Mix(2×)12.5 μL,DEPC水定容至25 μL。设计引物,Ⅰ型胶原引物序列:正义5′-GGTCCCAAAGGTGCTGATGG-3′,反 义 5′-GACCAGCCT⁃CACCACGGTCT-3′;Ⅲ型胶原引物序列:正义5′-CGAGGT⁃GACAGAGGTGAAAGA-3′,反义 5′-AACCCAGTATTCTCC⁃GCTCTT-3′;GAPDH引物序列:正义5′-CAAGGTCATCCAT⁃GACAACTTTG-3′,反义5′-GTCCACCACCCTGTTGCTGTAG-3′。PCR扩增条件为:Ⅰ型胶原95 ℃ 5min,95℃ 30 s,58 ℃30 s,72℃ 30 s,共37个循环,72℃延伸 10 min;Ⅲ型胶原95℃ 5 min,95℃ 30 s,55℃ 30 s,72℃ 30 s,共36个循环,72℃延伸10 min。(3)PCR产物用20 g/L琼脂糖凝胶进行电泳分析,采用Quantity one 4.6.2凝胶成像分析系统计算各个条带的A值,以各样本蛋白与GAPDH的比值表示mRNA的相对表达水平。
1.3 统计学方法 使用SPSS 17.0统计软件进行分析,计量资料以±ss表示,多组间比较采用单因素方差分析(ANO⁃VA),组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 NaHS对SB203580影响HSC增殖的作用 50 μmol/L NaHS组的A值高于对照组(P<0.05),其余NaHS组与对照组差异无统计学意义;不同药物浓度SB组的A值均低于对照组(P<0.05),但因低浓度SB203580无明显抑制HSC增殖,而高浓度SB抑制率较大且影响细胞形态,故75 μmol/L SB为最适浓度,见表1。倒置显微镜下观察NaHS组细胞较对照组明显增多,细胞形态未见改变,而SB组细胞内可见较多空泡状及凋亡细胞,细胞数量无明显增多,见图1。
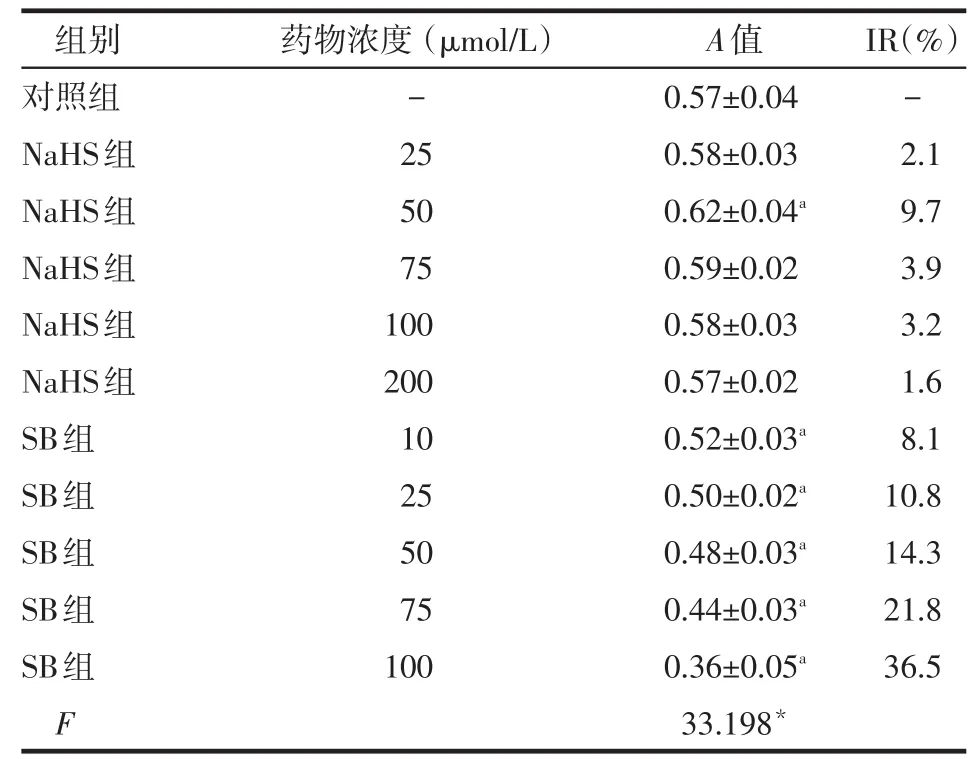
Table 1 Comparison of cell proliferation of HSC-T6 between groups表1 各组HSC-T6细胞增殖情况的比较
2.2 SB203580和NaHS对HSC-T6凋亡的影响 从FITC和PI荧光双参数点图观察到,对照组HSC-T6主要分布在左下象限,因操作等原因引起的机械性死亡细胞数量非常少(<2%),见图2。SB组、SB+NaHS组细胞凋亡率高于对照组,且SB+NaHS组高于SB组(均P<0.05);DMSO组、NaHS组与对照组差异无统计学意义,见表2。

Table 2 Comparison of apoptotic rates in HSC T6 between five groups表2 各组HSC-T6凋亡率的比较
2.3 SB203580和NaHS对HSC-T6Ⅰ、Ⅲ型胶原mRNA水平的影响 HSC-T6中Ⅰ、Ⅲ型胶原mRNA在各组中均表达,其中NaHS组表达高于对照组(P<0.05),且表达量最多,条带最亮、最宽,SB组与SB+NaHS组表达低于对照组和NaHS组(P<0.05),表达量较少,条带较暗,见表3、图3。
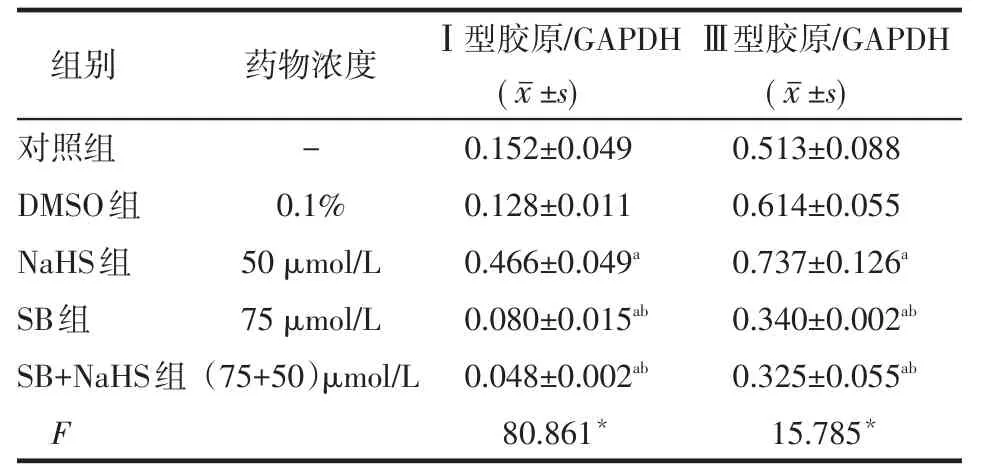
Table 3 The expressions of COL-Ⅰand COL-ⅢmRNA in HSC T6 between five groups表3 各组HSC-T6Ⅰ、Ⅲ型胶原mRNA的表达
3 讨论
HSC活化是肝纤维化的中心环节,活化后的HSC是肝内胶原及细胞外基质(extracellular matrix,ECM)的主要来源。肝脏受损时HSC被激活,分泌大量ECM,并表达Ⅰ、Ⅲ型胶原等促纤维化因子。H2S作为一种新型内源性气体信号分子,存在于人体多个系统,具有广泛的生物学效应。课题组前期研究结果表明H2S能够促进肝硬化大鼠肝组织内某种细胞的增殖,减少肝细胞损伤[4];外源性H2S可使抗凋亡分子survivin蛋白及基因表达上调,从而减少肝细胞凋亡[5];肝硬化大鼠给予H2S代谢酶抑制剂后门静脉压力升高[2],提示H2S在肝硬化发生发展过程中及调节门静脉压力方面起重要保护作用。
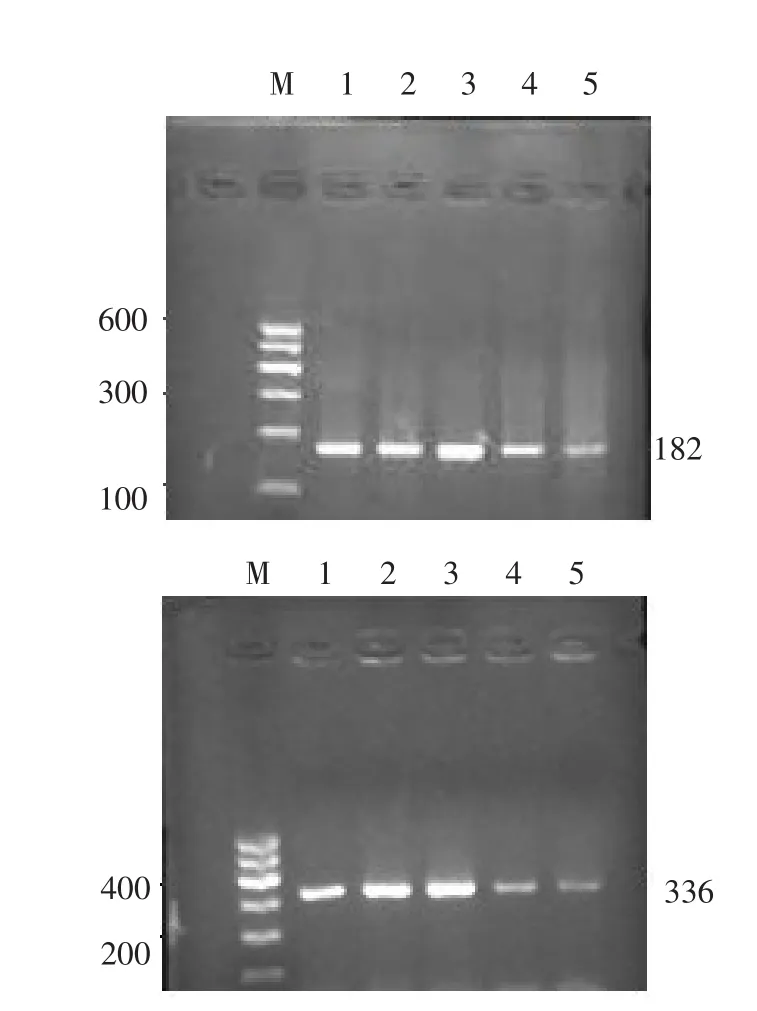
Figure 3 The expressions of COL-Ⅰand COL-ⅢmRNA in HSC T6 detected by RT-PCR assay图3 逆转录PCR检测HSC-T6Ⅰ、Ⅲ型胶原mRNA的表达
P38MAPK信号通路与细胞增殖、凋亡等多种生物学行为密切相关。Keuling等[6]用SB203580特异性阻断P38MAPK通路能够增强ABT-737诱导的黑色素瘤细胞凋亡。有研究者发现P38MAPK不仅参与调节α1(Ⅰ)型胶原mRNA表达,而且增强mRNA稳定性[7]。Schnabl等[8]用从大鼠分离的HSC分别用表达TAK1的腺病毒载体、JNK特异性阻断剂阻断JNK通路,P38MAPK特异性阻断剂阻断P38MAPK信号通路,发现阻断P38MAPK后可使α1(Ⅰ)型胶原mRNA的表达降低,但使HSC增殖较明显,而JNK信号通路一定程度上调控了HSC激活、生长调节及胶原的合成。Anania等[9]研究证实阻断JNK活性后可抑制HSC内α2(Ⅰ)型胶原的表达。由此本课题组推测H2S可能通过P38MAPK信号通路对HSC起作用,从而对Ⅰ、Ⅲ型胶原mRNA表达有影响。
在涉及多种细胞的凋亡反应中核因子-κB(nu⁃clear factor kappa B,NF-κB)是HSC最重要的抗凋亡因子,抑制NF-κB能够影响HSC的激活,许多研究证实它在肝纤维化的发生、发展中起重要作用[10]。Schwabe等[11]研究发现NF-κB不但能够抑制肝细胞凋亡,同时抑制HSC凋亡,还可促进其增殖。沈钦海等[12]证实外源性硫化氢可抑制NF-κB表达,促进激活的HSC凋亡。由于NF-κB可直接参与调节胶原蛋白的表达[13],故抑制其活性可能具有直接减少ECM合成的作用。
本实验结果显示,给予P38MAPK阻断剂SB203580,H2S刺激的HSC凋亡率明显高于仅给予通路抑制剂组,提示H2S可能与P38MAPK信号通路有关,将SB203580与NaHS(H2S)同时作用于HSC时,或许引起两药物发生某种化学反应,使H2S增加了SB203580的药物敏感性,从而促进凋亡。当外源性给予H2S供体NaHS后,阻断P38MAPK可使HSC内Ⅰ、Ⅲ型胶原mRNA表达明显降低,未给予抑制剂的NaHS可促进HSC增殖,增加Ⅰ、Ⅲ型胶原mRNA表达,此结果与Schnabl等[8]研究结果相似,证实了H2S通过P38MAPK信号通路参与调节HSC内Ⅰ、Ⅲ型胶原mRNA表达。推测H2S通过激活P38MAPK信号通路作用于HSC,HSC活化伴随NF-κB激活,活化的NF-κB通过抑制肝细胞凋亡且促进HSC增殖,引起ECM增多,胶原是ECM的最主要成分,从而引起Ⅰ、Ⅲ型胶原mRNA表达增高。由于课题组前期研究结果已证实H2S对肝纤维化具有保护作用,胶原蛋白的最终表达才能对肝纤维化起明显指示作用,那么翻译过程中是否由于某种机制使高表达的mRNA翻译为低表达的蛋白质而使胶原产生减少,从而起到抗肝纤维化作用;且本实验仅研究H2S对HSC的作用,H2S对肝细胞是否也能够促增殖产生胶原使其高表达,其具体作用机制还尚未可知。在此需要注意的是,上述研究结果提示阻断P38MAPK信号通路可以明显抑制H2S刺激的HSC增殖,促进其凋亡,这与Schnabl等[8]的研究结果又有所不同,考虑可能与如下原因有关:MAPK信号通路包括P38、ERK和JNK等,本实验仅用SB203580阻断P38MAPK信号通路,这是否是由于P38MAPK信号通路与细胞内其他信号通路产生交叉反应,又或者MAPK信号通路各分支间存在协同或干扰效应,具体机制尚需进一步研究。
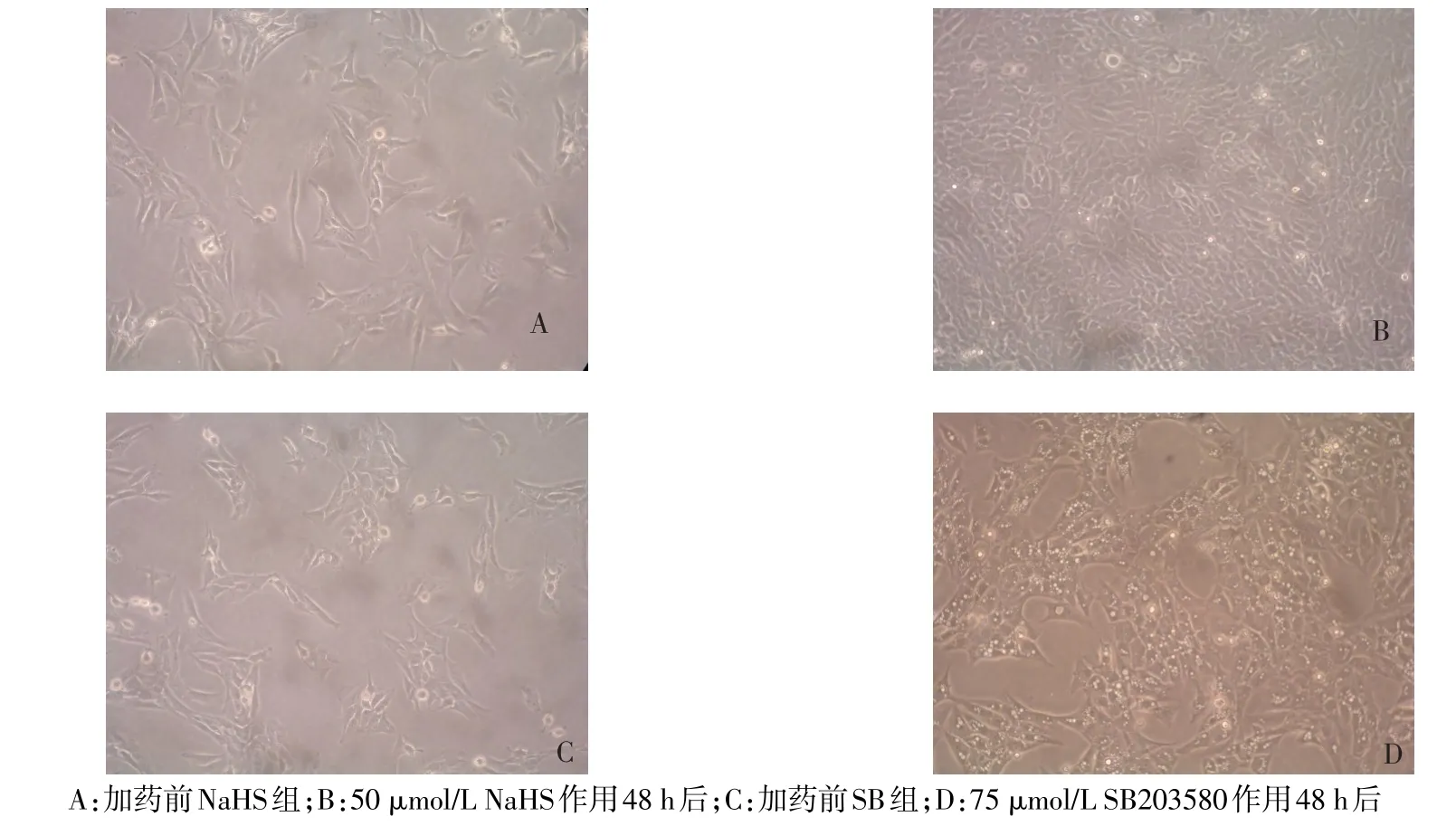
Figure 1 Changes in cell morphology under inverted microscope(×200)图1 倒置显微镜下观察细胞形态变化(×200)
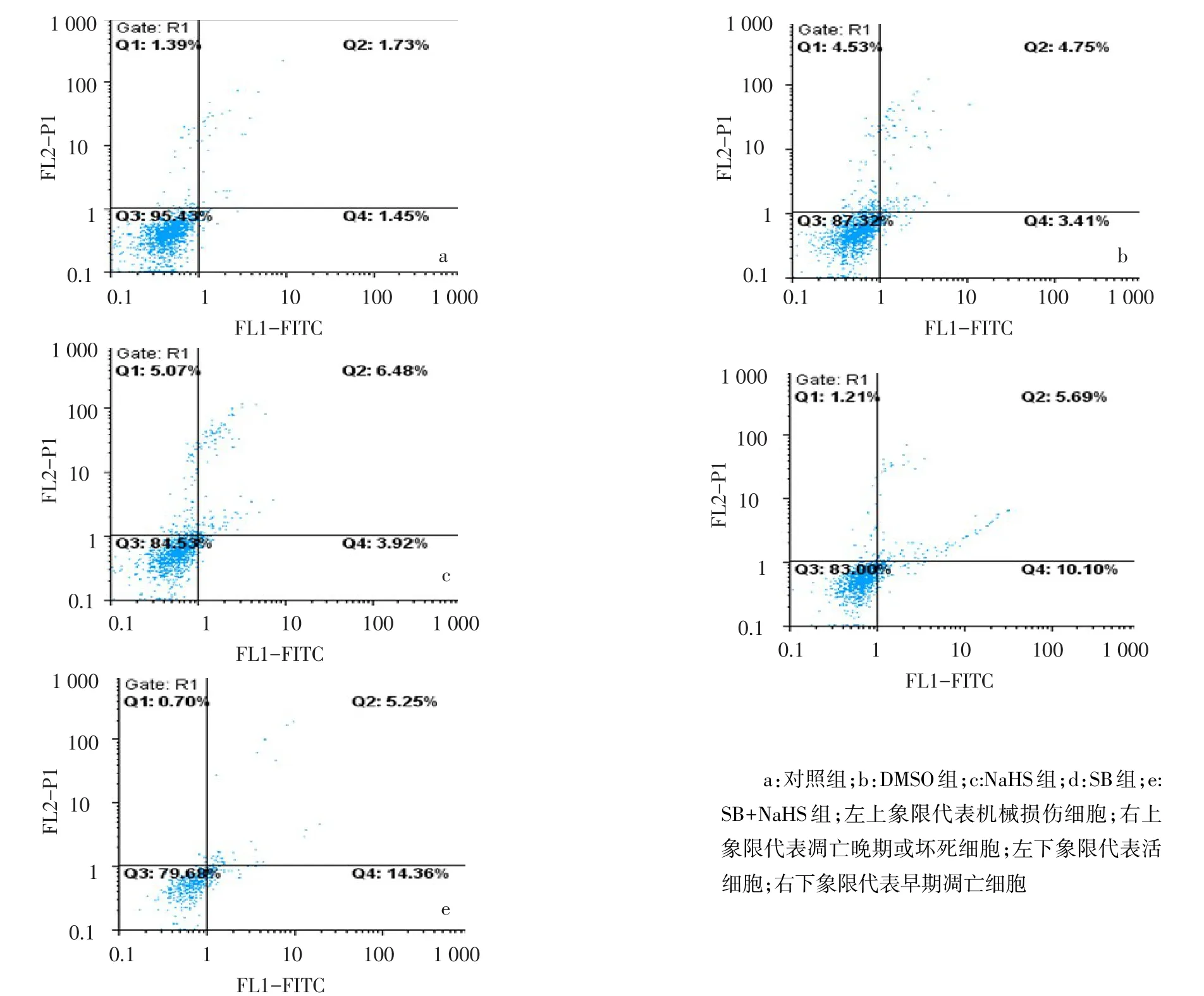
Figure 2 Comparison of apoptotic rates in HSC T6 cells between groups图2 各组HSC-T6细胞凋亡率的比较
[1]沈钦海,秦召敏,逯爱梅.硫化氢对大鼠肝纤维化的预防作用[J].中南大学学报(医学版),2012,37(9):911-915.
[2]孙东升,张力.外源性硫化氢对人胃癌细胞凋亡的影响[J].中国医疗前沿,2010,5(13):16-17.
[3]陈卫刚,郑勇,宋丽秀,等.内源性H2S对大鼠实验性肝硬化门脉高压的影响[J].世界华人消化杂志,2011,19(3):467-471.
[4]阎继攀,郑勇,陈卫刚,等.实验性肝硬化大鼠肝组织中CSE和Ki-67的表达及 其意义[J].胃肠病学和肝病学杂志,2012,21(3):232-235.
[5]许广鑫,郑勇,陈卫刚,等.硫化氢对肝硬化大鼠肝脏survivin表达的影响[J].世界华人消化杂志,2012,20(10):846-850.
[6]Keuling AM,Andrew SE,Tron VA.Inhibition of p38 MAPK en⁃hances ABT-737-induced cell death in melanoma cell lines:novel regulation of PUMA[J].Pigment Cell Melanoma Res,2010,23(3):430-440.
[7]Tsukada S,Westwick JK,Ikejima SN,et al.SMAD and p38MAPK signaling pathways independently regulateα1(Ⅰ)collagen gene ex⁃pression in unstimulated and transforming growth factor-β-stimu⁃lated hepatic stellate cells[J].J Biochem,2005,280(11):10055-10064.
[8]Schnabl B,Bradham CA,Bennett BL,et al.TAK1/JNK and p38 have opposite effects on rat hepatic stellate cells[J].Hepatology,2001,34(5):953-963.
[9]Anania FA,Womack L,Jiang MD,et al.Aldehydes potentiate alpha(2)(I)collagen gene activity by JNK in hepatic stellate cells[J].Free Radic Biol Med,2001,30(8):846-857.
[10]朱净,范建荣,潘亮,等.NF-κB在鼠肝纤维化组织中的表达及其与α-SMA、Ⅲ型胶原的相关性[J].世界华人消化杂志,2012,20(22):2081-2085.
[11]Schwabe RF,Schnabl B,Kweon YO,et al.CD40 activates NF-kap⁃pa B and c-Jun N-terminal kinase and enhances chemokine secre⁃tion on activated human hepatic stellate cells[J].J Immunol,2001,166(11):6812-6819.
[12]沈钦海,秦召敏,于天贵,等.外源性硫化氢对大鼠肝纤维化的影响[J].第三军医大学学报,2012,34(8):754-757.
[13]袁晓梅,孙浩杰,苗润红,等.苦参碱对肺纤维化大鼠核转录因子-κB及胶原蛋白III的影响[J].新乡医学院学报,2009,26(4):327-330.
