Cd Te量子点与人血清白蛋白的相互作用研究
2013-12-01赖璐,梅平
赖 璐,梅 平
(长江大学化学与环境工程学院,湖北 荆州434023)
量子点(quantu m dots,QDs)是一种具有独特光学和电学性质的无机纳米材料,具有多元激发一元发射、抗光漂白强等特性,因此被广泛的用于生物医学成像[1]、药物载体[2]、DNA检测[3]、电子工业[4]等领域。随着量子点在生物成像及医学诊断等领域的广泛应用,其生物安全性也引起了人们的关注。为了解量子点的生物安全性,人们从生物大分子[5]、亚细胞器[6]、细胞[7]、原生动物[8-9]等不同生命层次研究了量子点的毒性大小以及致毒机制。蛋白质是生物体内最重要的一类生物大分子,是细胞原生质的主要成分,与核酸一起共同构成了生命体的物质基础。当分散在生物流体(如血液)中时,量子点的表面可能会吸附蛋白质或其他生物大分子,或者发生聚集生成不同大小的団簇[10]。这些作用均可能导致蛋白质等生物大分子的结构和功能发生变化。因此,研究量子点与蛋白质的相互作用显得非常必要。下面,笔者采用荧光光谱、紫外-可见吸收光谱、圆二色谱、红外光谱等方法系统地研究了谷胱甘肽(GSH)修饰的Cd Te量子点和人血清白蛋白(HSA)之间的相互作用,探讨了相互作用机理与相互作用热力学参数,研究了量子点对HSA构象的影响。
1 试验部分
1.1 试剂与仪器
1)试剂 人血清白蛋白(HSA),L-谷胱甘肽(GSH,98%),氯化镉(99.99%),硼氢化钠(99%),碲粉(99.999%,约200目)购自Sig ma-Al drich公司。试验用水均采用Millipore超纯水系统进行纯化(18.2 mΩ·c m-1)。
2)仪器 TU-1900双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);带恒温系统的LS-55荧光分光光度计(美国Perkin El mer公司);J-810圆二色光谱仪(日本Jasco公司);PB-10 p H计、BS110S电子分析天平(北京赛多利斯仪器系统有限公司);KQ2200型超声波清洗器(昆山市超声仪器有限公司);Milli-Q Advantage A10超纯水系统(美国Millipore公司)。
1.2 GSH修饰Cd Te量子点的制备
1)Cd前体的制备 称取0.2 mmol Cd Cl2和0.24 mmol GSH,溶于50 ml超纯水。边搅拌边逐滴加入1 mol/L Na OH溶液(超纯水配制),调节pH值至8.0。将溶液转移至三口烧瓶中,采用Schlenk技术抽气充气(高纯Ar)反复6次,除尽溶液中的O2。
2)Te前体的制备 称取0.2 mmol Te粉和0.5 mmol NaBH4,置于10 ml的离心管中,加入2 ml超纯水,冰水浴下搅拌反应直至成无色透明溶液。
在室温下,强力搅拌下用注射器向Cd前体中加入0.4 ml新制备的Na HTe溶液(0.04 mmol),[Cd]∶[GSH]∶[Te]=1∶1.2∶0.2(摩尔浓度比)。将三口烧瓶置于油浴中,冷凝回流不同时间,可得到最大发射波长不同的Cd Te量子点。
3)纯化方法 加入一定量的异丙醇至溶液变浑浊,离心弃上清,重复3次。将离心收集的沉淀置于真空干燥箱中,35℃干燥48 h。再将所得固体溶于磷酸盐缓冲溶液(PBS)中,用0.22μm过滤头过滤。最后用0.01 mol/L PBS缓冲液(p H=7.4)透析。用紫外-可见吸收光谱(UV-vis)、荧光发射光谱(FL)以及X-射线衍射图谱(XRD)对合成所得Cd Te QDs进行结构表征。
1.3 荧光光谱试验
采用荧光滴定法测定不同温度下(298、304和310 K)Cd Te量子点对HSA的荧光猝灭作用。激发波长为280n m,激发狭缝和发射狭缝宽度分别为5.0和10.0n m,记录研究体系在290~430n m之间的荧光发射光谱。
1.4 紫外-可见吸收光谱
测定1×10-6mol/L HSA、1×10-6mol/L Cd Te量子点以及Cd Te量子点与 HSA 物质的量之比为1∶1的混合溶液的紫外-可见吸收光谱。
1.5 圆二色谱
测定室温下各不同体系溶液的远紫外(260~200nm)圆二色谱。选用池径为0.1c m的石英比色皿,扫描时间为500nm/min,响应时间为0.5s。HSA与Cd Te量子点的物质的量之比分别为20∶1,10∶1,5∶1。以PBS缓冲液为空白扣除溶剂吸收峰。
2 结果与讨论
2.1 Cd Te QDs的表征
图1为GSH修饰Cd Te量子点的紫外-可见吸收光谱图及荧光光谱图。从图1中可以看出,合成得到的Cd Te量子点有明显的激子吸收峰,荧光峰位于581.5n m,荧光发射峰对称性较好,半峰宽约为50n m。以上结果说明合成得到的Cd Te量子点尺寸分布比较均一、光学性能好。图2为合成所得Cd Te量子点的固体粉末样品的XRD表征。由图2可知,Cd Te QDs的衍射谱图与体相立方形Cd Te的衍射峰相近(PDF No.15-0770)。合成产物在2θ(入射角)=24.0°、39.8°和47.0°处有3个明显的衍射峰,分别对应于立方晶系Cd Te的(111)、(220)和(311)3个晶面,说明合成所得Cd Te量子点有比较好的晶形结构[11]。XRD衍射峰的宽化说明Cd Te量子点的粒径比较小。
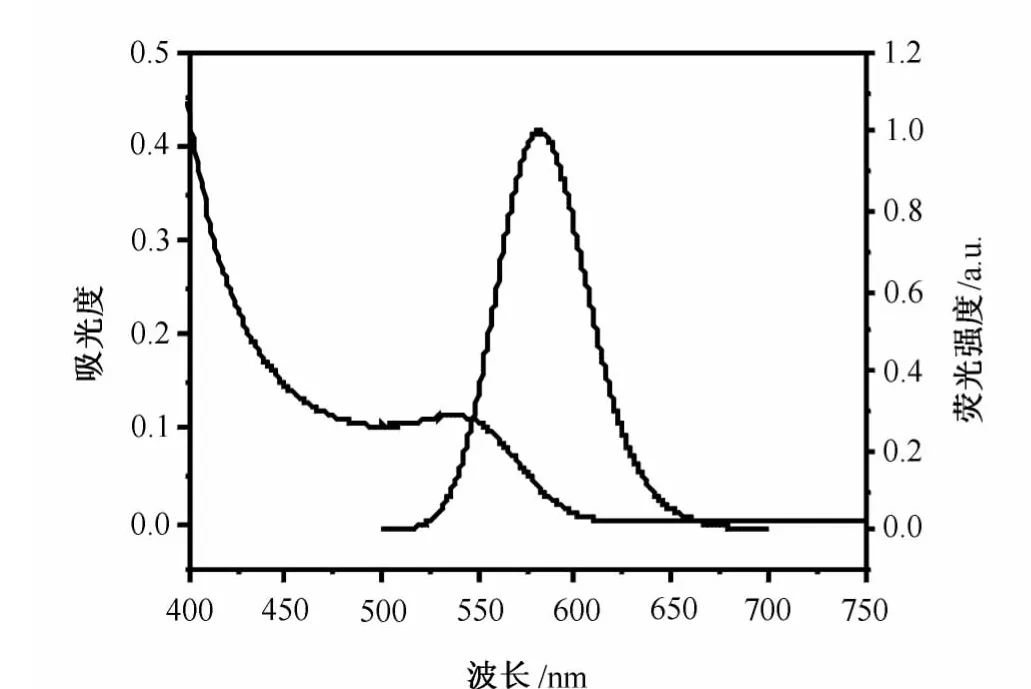
图1 GSH-CdTe量子点的紫外-可见吸收光谱和荧光发射光谱图(激发波长为400n m)

图2 GSH-CdTe量子点的X-射线衍射图谱
2.2 荧光猝灭机理和猝灭常数
荧光是电子从高能级轨道跃迁回低能级轨道时所引起的光子发射过程,各种分子间的相互作用会导致荧光的猝灭,包括激发态的反应、能量转移、基态复合物的生成以及碰撞引起的猝灭[12]。根据猝灭常数与温度的关系或者通过测定荧光寿命,猝灭机理通常被区分为动态猝灭或者静态猝灭。具体而言,动态猝灭取决于扩散过程,温度升高粒子的扩散速度越快,因此猝灭常数随温度的升高而增加。相反,温度升高会导致复合物的稳定性下降,因此静态猝灭常数随温度的升高而减小[12]。图3为量子点对HSA的荧光猝灭图谱。从图3中可以看出,以280n m的激发光激发时,HSA在340n m处出现较强的荧光发射峰,而量子点在此处没有荧光发射。随着量子点的加入,HSA的荧光随之逐渐降低。对于荧光猝灭,荧光强度的降低通常可以用经典的Ster n-Vol mer方程[13]描述:

式中,F0和F分别为未加入猝灭剂量子点和加入猝灭剂后的HSA的荧光强度;Ksv为Ster n-Vol mer猝灭常数;[Q]是猝灭剂的浓度。根据式(1),以F0/F对[Q]作图,由直线的斜率可求得Ksv。图4是不同表面修饰量子点在不同温度下F0/F对[Q]图。表1为根据图4计算所得不同温度下的猝灭常数Ksv。由表1中数据可知,量子点对HSA荧光的猝灭常数随温度的升高而减小,这表明量子点与HSA之间形成了复合物,猝灭机理是静态猝灭而不是动态猝灭。

图3 不同浓度量子点溶液对HSA的荧光猝灭图
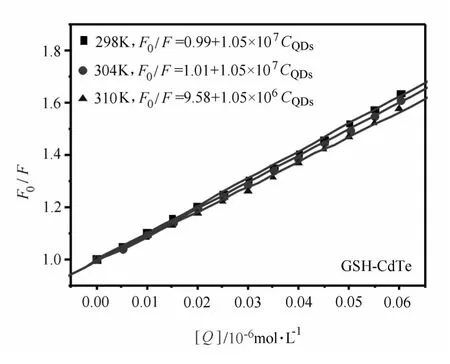
图4 不同温度下量子点猝灭HSA内源荧光的Ster n-Vol mer关系图

表1 不同温度下量子点猝灭HSA内源荧光的猝灭常数与结合常数
为了进一步验证表面带负电的量子点对人血清白蛋白的猝灭机制是静态猝灭,笔者测定了体系的紫外-可见吸收光谱的变化。动态猝灭主要由HSA和猝灭剂之间的碰撞或能量转移引起,所以HSA的紫外-可见吸收光谱不会发生变化[12]。而静态猝灭是由于HSA和量子点之间形成了静态复合物,所以会引起紫外-可见吸收光谱的变化。图5是HSA的紫外-可见吸收光谱图(曲线a)、量子点-HSA与同浓度量子点紫外-可见差谱(曲线b)。从图5可以看出,HSA的吸收光谱与其差谱并不重合且有明显差异,280与220n m处吸收峰的强度明显下降。因此,Cd Te量子点对HSA的荧光猝灭是个静态过程。
对于静态猝灭过程,修正的Ster n-Vol mer方程[13]可以用来计算结合常数Ka:

式中,fa为荧光物质(荧光基团)可接近猝灭剂的部分(分数);Ka为有效猝灭常数,对于静态猝灭机理可认为是结合常数。由式(2)可知与斜率的比值即为结合常数Ka。图6为不同温度下根据修正Ster n-Vol mer方程拟合的结果,根据截距与斜率的比值可得到不同温度下量子点和HSA的结合常数Ka(见表1)。表1中数据表明量子点和HSA的结合常数Ka随温度的升高数值减小,与静态猝灭机制相符。

图5 量子点紫外-可见吸收光谱图

图6 不同温度下量子点猝灭HSA内源荧光的修正Ster n-Vol mer关系图
2.3 相互作用力类型
一般而言,内源或外源物与生物大分子之间的相互作用力包括静电相互作用、氢键、范德华力、疏水作用力和抗体结合位点的空间接触等[14]。Ross和Subra manian总结了判断有机小分子与生物大分子相互作用力的热力学法则[15]。为了判断量子点和人血清白蛋白之间的相互作用力,可通过van’t Hoff方程(3)计算相关的热力学参数:

式中,K为反应温度下的结合常数;R是摩尔气体常数。将l n K对1/T作图,可得一直线,由直线的斜率和截距可求得ΔH 和ΔS。吉布斯自由能变(ΔG)可由式(4)得到:

表2为量子点和HSA相互作用的相关热力学常数。由表2可知,ΔH<0,ΔS>0,表明HSA和Cd Te量子点之间的相互作用以静电作用力为主[15]。
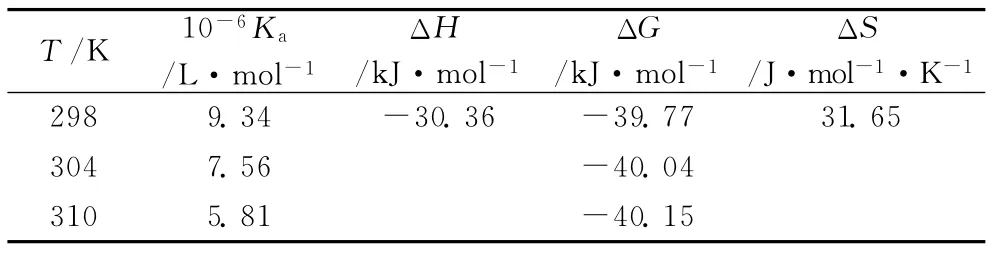
表2 量子点与HSA相互作用的热力学参数

图7 不同浓度量子点存在下HSA的圆二色谱
2.4 QDs对HSA二级结构的影响
为了研究量子点对HSA二级结构的影响,笔者考察了加入不同浓度量子点前后HSA的远紫外圆二色谱(CD)。在圆二色光谱中,HSA在208和222n m处存在2个负峰,通常被认为是由于α-螺旋结构中的肽键n→π*电子转移而产生的[16]。图7是室温下不同浓度的量子点对HSA圆二色光谱的影响。从图7中可以看出,随着量子点的加入,[θ]208和[θ]222的强度降低,这说明蛋白质中的α-螺旋结构含量减少。量子点与蛋白肽链上的氨基酸残基发生了相互作用,破坏了氢键的网络结构,使蛋白质以更为松散的构象存在[15]。蛋白质的二级结构与其三级结构相关,也与蛋白质的活性有关,蛋白质α-螺旋结构含量的减少意味着HSA生物活性的丧失。为了定量描述量子点对人血清白蛋白不同类型的二级结构数量的影响,笔者采用SELCON3算法分析了不同QDs浓度下人血清白蛋白的圆二色光谱。表3为未加入量子点和量子点加入之后HSA不同二级结构的百分比。由表3可知,随着量子点浓度的增加,α-螺旋结构含量下降,而β-折叠和无规卷曲等结构含量增加。

表3 量子点对HSA二级结构的影响
[1]Maestro L M,Ramirez-Hernandez J E,Bogdan N,et al.Deep tissue bio-i maging using t wo-photon excited Cd Te fl uorescent quantu m dots working within the biological window[J] .Nanoscale,2012,4(1):298-302.
[2]De Jong W H,Bor m P J A.Drug delivery and nanoparticles:Applications and hazards[J].Int J Nanomed,2008,3(2):133-149.
[3]Rosi N L,Mirkin C A.Nanostructures in biodiagnostics[J].Chem Rev,2005,105(4):1547-1562.
[4]Chen J,Li C,Zhao D W,et al.A quantum dot sensitized solar cell based on vertically aligned carbon nanotube templated Zn O arrays[J].Electr ochem Co mmun,2010,12(10):1432-1435.
[5]Vannoy C H,Leblanc R M.Effects of DHLA-Capped Cd Se/ZnS Quantu m Dots on the Fibrillation of Hu man Serum Albu min[J].J Phys Chem B,2010,114(33):10881-10888.
[6]Li J H,Zhang Y,Xiao Q,et al.Mitochondria as tar get of Quantum dots toxicity[J].J Hazard Mater,2011,194:440-444.
[7]Lu Z S,Li C M,Bao H F,et al.Mechanism of anti microbial activity of Cd Te quantum dots[J].Langmuir,2008,24(10):5445-5452.
[8]Werlin R,Priester J H,Miel ke R E,et al.Bio magnification of cad miu m selenide quantum dots in a simple experi mental microbial f ood chain[J] .Nat Nanotechnol,2011,6(1):65-71.
[9]Donaldson K,Brown D,Clouter A,et al.The pul monary toxicology of ultrafine particles[J].J Aerosol Med,2002,15(2):213-220.
[10]Safi M,Courtois J,Seigneuret M,et al.The effects of aggregation and protein cor ona on the cellular inter nalization of iron oxide nanoparticles[J].Bio materials,2011,32:9353-9363.
[11]Zheng Y,Gao S,Ying J Y.Synthesis and cell-i maging applications of glutathione-capped Cd Te quantum dots[J] .Advanced Materials,2007,19(3):376-380.
[12]Hu Y J,Liu Y,Zhang L X,et al.St udies of interaction bet ween colchicine and bovine serum albumin by fluorescence quenching met hod[J].Jour nal of Molecular Str ucture,2005,750(1-3):174-178.
[13]Lehrer S S.Sol ute Pertur bation of Protein Fluorescence-Quenching of Tr yptophyl Fluorescence of Model Co mpounds and of Lysozy me by Iodide Ion[J].Bioche mistry-Us,1971,10(17):3254-3257.
[14]Leckband D.Measuring the forces t hat contr ol pr otein interactions[J] .Annu Rev Bioph Biom,2000,29:1-26.
[15]Xiao Q,Huang S,Qi Z D,et al.Conf or mation,ther modyna mics and st oichio metry of HSA adsor bed to colloidal Cd Se/Zn S quantu m dots[J].Bba-Proteins Proteo m,2008,1784(7-8):1020-1027.
[16]Zhang Y Z,Zhou B,Zhang X P,et al.Interaction of malachite green wit h bovine serum albumin:Deter mination of the binding mechanism and binding site by spectroscopic met hods[J].J Hazar d Mater,2009,163(2-3):1345-1352.
