镉处理根表铁膜对水稻吸收镉、锰、铜、锌的影响
2013-12-01刘侯俊李雪平韩晓日高晓宁
刘侯俊,李雪平,韩晓日,2*,高晓宁
(1沈阳农业大学土地与环境学院,土肥资源高效利用国家工程实验室,沈阳110866;2沈阳农业大学农学院,辽宁省生物炭工程技术中心,沈阳110866;3辽宁省环境科学研究院,辽宁沈阳110161)
铁氧化物胶膜(铁膜)是水生植物通过体内发达的通气组织将空气中的O2运输到根系,根系向外分泌的O2与其它氧化性物质将土壤中高浓度的还原性Fe2+、Mn2+等氧化成溶解性很小的氧化物和氢氧化物,并沉积在土壤和根系表面而形成的[1]。水稻是一种典型的湿生植物,其根系表面也沉积着大量铁膜[2-6]。已有研究表明,水稻根表铁膜可以影响多种元素在水稻体内的吸收与分布。大多数研究结果发现,植物根表铁膜对元素的吸收具有明显的阻挡作用[7-10],也有研究证明,铁膜这种阻挡作用非常有限[11-13],甚至可以促进植物对养分的吸收[14-16]。
镉(Cd)是一种对生物体产生巨大危害的重金属元素,它可以通过多种途径进入农田土壤中,导致土壤中Cd的累积量增加。例如,Fu等分析了浙江省6个不同地区稻田土壤样品以及相应的水稻子粒样品,结果发现土壤中 Cd的平均含量为1.19 μg/g,是土壤最大允许值(0.3 μg/g)的4.0 倍,子粒样品中有 31% 超过最大允许值(0.2 μg/g)[17]。Ji等[18]的田间调查结果也发现,在所调查的32个稻田土壤及相应的水稻子粒样品中,有15个土壤样品Cd含量超过了1.0 μg/g,5个子粒样品中Cd含量超过了0.2 μg/g。可见稻田土壤中Cd污染状况不容乐观。
Cd的存在不仅影响水稻自身的生长与代谢,同时影响到水稻对其它必需营养元素的吸收运输以及这些元素在水稻体内功能的发挥。其中Cd与Fe、Mn、Cu、Zn等几种微量元素之间的关系研究较多。植物对Cd的吸收和运输往往是借助于Fe和其它二价离子的吸收系统进行的[19-20],因此 Cd经常与这些二价离子在吸收运输,甚至代谢过程中产生竞争作用,以至抑制了植物对Fe等离子的吸收。反过来,缺乏这些元素也可以增加植物对 Cd的吸收[21-22]。
Fe、Mn、Cu、Zn等微量元素是对植物生长发育非常重要的必需营养元素,但目前稻米中微量元素缺乏现象非常严重,以至严重影响到人类对微量元素的摄取,并引发一系列人体微量元素缺乏病症[23]。因此,研究水稻对微量元素的吸收运输以及影响因素具有非常重要的理论和实际意义。如前所述,铁膜和Cd均可以影响到水稻对一些元素的吸收,而两者同时存在的前提下它们如何影响水稻对Mn、Cu、Zn吸收,这正是本研究试图探讨的问题。
本论文针对稻田土壤中有效Fe2+含量较高,同时又有重金属Cd污染的现状,利用水稻根表可以利用Fe2+形成大量铁膜的生物学特性,在人工模拟Cd污染的前提下,探索根表铁膜对水稻吸收运输Cd、Fe、Mn、Cu和Zn的影响。
1 材料与方法
1.1 水稻幼苗预培养
水稻(Oryza sativa L.)种子用30%的 H2O2表面消毒30 min后,用饱和CaSO4浸泡6小时,在湿润滤纸上催芽。将露白的种子播于湿润的石英砂中(石英砂用5%的HCl浸泡过夜,依次用自来水和去离子冲洗至pH 7.0),石英砂用黑色塑料布覆盖遮光。待水稻出苗后将其揭开,保持石英砂湿润以避免水稻缺水。水稻出苗10天后,挑选生长一致的幼苗,移栽到5 L的陶瓷盆中,盆中供应pH 5.0的营养液[营养液组分含量(mol/L):NH4NO30.5×10-3,NaH2PO4·2H2O 0.6 × 10-4,K2SO40.23 ×10-3,MgSO4·7H2O 0.16 × 10-3,CaCl20.21 × 10-3,MnCl2·4H2O 5.0 × 10-7,(NH4)6Mo7O24·4H2O 5.0× 10-8,CuSO4·5H2O 1.0 × 10-8,ZnSO4·7H2O 5.0×10-7,H3BO32.0 × 10-7,Fe-EDTA 1.0 × 10-4]。幼苗前7天供以1/2强度营养液,以后为完全营养液,每隔7天换一次营养液。水稻在营养液中预培养26天。
1.2 试验处理过程
营养液培养试验:选生长一致的幼苗移栽到1 L陶瓷盆中,每盆4株。供应含有0、10、30、50、80、100 mg/L Fe(FeSO4·7H2O)的营养液,此时营养液中不再供应EDTA-Fe和P。水稻生长3 d后进行同样的处理,此时,水稻根表已形成明显的红棕色铁膜。水稻在正常营养液中生长1 d后,再生长于0、0.1、1.0 mg/L Cd(3CdSO4·8H2O)的营养液中2 d。因为在含Cd的营养液中生长的过程中,水稻根系长出许多新根和从根尖延伸出新的根段,为了使这些根段全部被铁膜覆盖,再次向水稻供应Fe营养液,浓度和方法同上。供应3 d后再次供应含Cd的营养液,同样为2 d,之后收获。试验包括18个处理,每处理重复3次,共54盆。
土壤培养试验:选生长一致的幼苗移栽到土壤中继续生长,每盆2株。试验用土壤属于灰色冲积性水稻土,土壤有机质含量为19.62 g/kg,全氮1.84 g/kg,Olsen-P 17.9 mg/kg,速 效 钾 34.0 mg/kg,DTPA-Fe 34.9 mg/kg,DTPA -Cd 0.227 mg/kg,pH(水∶土10∶1)6.2。将自然风干的土壤过3 mm筛,并施以 N 0.2 g/kg土,P2O50.15 g/kg土,K2O 0.2 g/kg土的基肥,以分析纯化合物[(NH4)2SO4、KH2PO4、K2SO4]配成溶液,先与少量土壤充分混合,再将这些土壤与其他土壤混匀。每10 kg土壤混一次基肥,最后将所有试验用土壤再充分混匀。将 Cd(3CdSO4·8H2O)和 Fe(FeSO4·7H2O)以溶液的形式与一定量已施入基肥的土壤充分混匀,各处理分别混合均匀,每次施入肥料,在混匀的过程中均过3 mm筛。土壤中添加Cd和Fe的浓度分别为Cd 0、2、10 mg/kg,Fe 0、1、2 g/kg。
将准备好的土壤装入10(直径)×20(高)cm的塑料盆,每盆装土600 g。先在盆底装少量土,之后将孔径为30 μm的空尼龙网袋(8 cm×20 cm)放入盆中央,再将剩余土壤装入盆中,此时网袋被固定在盆中央。网袋的作用在于减少根系与土壤的直接接触,收获时可得到相对干净完整的根系,但网袋不能阻止水分和养分在网袋内外的流动。装盆完毕,每盆加等量去离子水保持土壤湿润,平衡两周。水稻移栽后,保持水面约2 cm,移栽后43 d收获。试验共9个处理,重复5次,共45盆。
1.3 水稻植株收获
营养液培养试验:收获时从盆中选取一株水稻,用去离子水冲洗3次,然后从茎基部将水稻幼苗地上部和根系分开。地上部称鲜重后,装入纸袋。根系用DCB(Dithionite-Citrate-Bicarbonate)法提取根表铁膜中的微量元素,具体操作如下:将植株整个根系放入100 mL烧杯中,加30 mL浓度为0.03 mol/L Na3C6H5O7.H2O和0.125 mol/L NaHCO3混合提取液(及时配制)及0.6 g Na2S2O4,根系在25℃下静置浸泡60分钟用于提取根表铁膜,将提取液移入50 mL容量瓶,将根系用去离子水冲洗三次,冲洗的液体一并转移到容量瓶中定容,然后将液体过滤到胶卷盒中。提取后的根系与地上部放在烘箱里70℃下烘干,并称干重。
土壤培养试验:收获时取出网袋,将水稻植株从网袋中拿出,洗去粘附在根系上的少量土壤,根系表面呈现明显的红棕色铁膜,从茎基部将地上部和根系分开。称地上部鲜重后装入编号的纸袋中,根系装入封口袋,尽快运回实验室。根系用去离子水冲洗三次,置于150 mL烧杯中用DCB方法提取根系表面的铁膜。由于土壤培养条件下水稻根系较大,提取根表铁膜时加大提取液中各组分的用量,提取具体过程为:烧杯中加80 mL含0.03 mol/L Na3C6H5O7·2H2O和0.125 mol/L NaHCO3的提取液,再加1.6 g固体的Na2S2O4,25℃下静置70 min,此时根系由红色转为白色,根表的铁膜溶解在提取液中。将提取液转入100 mL容量瓶中,根系再用去离子水冲洗三次,冲洗液一并移入容量瓶中,定容后,摇匀过滤到塑料瓶中待测。
1.4 元素测定
将烘干的根和地上部样品粉碎,准确称量0.1600 g根和0.3000 g地上部样品到消煮管中,加入5 mL浓硝酸和1 mL混合酸(HNO3∶HClO4=1∶1),过夜。第二天在消煮炉上消煮至少10 h,直到消煮管中溶液完全转白色且消煮管中剩余液体大约为1 mL时为止。消煮温度和时间依次为90℃ 3 h,140℃ 5 h,180℃ 2 h。待消煮管冷却后,将消煮液转移到25 mL容量瓶中,用高纯水将消煮管冲洗三次,定容,再过滤到胶卷盒中。用电感耦合等离子发射光谱仪(ICP -OES,Optima3300 DV,Perkin Elmer,USA)测定塑料盒中的DCB提取液和消煮液中的微量元素。为了保证样品消煮和测定过程的准确性,空白试剂和西红柿叶片标准样品(GSB 07-1264-2000,Chinese National Certified Reference Material)与试验样品同步进行消煮和测定。标准样品测定值均在标准值范围之内。
1.5 水稻生长条件
营养液培养水稻幼苗生长于沈阳农业大学土地与环境学院植物营养系培养室中,培养室湿度为70%,温度为22 25℃,光照时间14 h/10 h(白天/晚上),光照强度为 120 150 μmol/(m2·s),移栽后再生长60 d。
土壤培养水稻试验布置于沈阳农业大学土地与环境学院植物营养系网室中,白天/晚上温度一般为30℃/15℃,湿度为60% 70%。
1.6 数据处理和统计方法
采用EXCEL进行数据处理,统计分析采用SAS 8.2系统(SAS Institute Inc.,Cary,NC,USA)进行双因素方差分析。同一Cd水平不同Fe处理之间进行多重比较(P<0.05)。
2 结果与分析
2.1 不同铁镉处理下水稻根表铁膜量
两种培养方式下,水稻根系表面的铁膜均随介质中Fe供应量的增加而显著增加(表1、表2)。土壤中未供应Fe时,水稻根表的Fe含量远远高于营养液中未供应Fe时,说明水稻利用了土壤中本身存在的Fe,从而形成了大量铁膜。

表1 营养液方式下不同铁镉处理下铁膜数量(mg/kg)Table 1 Amounts of the iron plaque in root surface of rice in the hydroponics culture experiments

表2 土壤培养方式下不同铁镉处理下铁膜数量(mg/kg)Table 2 Amounts of the iron plaque in root surface of rice in soil culture experiments
2.2 不同铁镉处理下水稻根表、根及地上部Cd含量
图1显示,营养液培养方式下,0.1 mg/L Cd(Cd0.1)处理时,水稻根表铁膜中Cd(DCB-Cd)为加Fe处理高于未加Fe处理,而在1.0 mg/L Cd(Cd1.0)处理时,根表铁膜中Cd则为加Fe处理低于未加Fe处理。土壤培养方式下,水稻根表铁膜中Cd随着土壤中供Fe浓度的增加而增加。两种培养方式下,水稻根中和地上部Cd含量均随介质中供应Fe浓度的增加而降低,且高Cd供应时下降幅度大于低Cd供应,这在土壤培养条件下更为显著。
两种培养方式下,根中Cd含量远远高于根表铁膜中和地上部Cd含量。如营养液培养方式下,水稻根系吸收Cd占植株Cd吸收总量的54%~71%,而铁膜中Cd占2% 9%,地上部Cd占24%~40%。土壤培养方式下,三者分别是30%~70%、1%~47%、17%~37%。

图1 营养液和土壤培养方式下水稻根表、根中和地上部镉含量Fig.1 Concentrations of Cd in root surface,roots and shoots in the hydroponics and soil culture experiments
2.3 不同铁镉处理下水稻根表、根中及地上部Mn含量
图2显示,不管营养液培养还是土壤培养条件下,水稻根表铁膜中Mn均在高Fe供应时高于低Fe供应和无Fe供应。而水稻根中和地上部Mn含量则是供Fe处理显著低于未供Fe处理,而且地上部下降幅度大于根中下降幅度。在营养液培养条件下,Cd也降低根系和地上部Mn含量,而土壤培养条件下此规律不明显。
营养液培养方式下,水稻根中Mn含量最低,根表铁膜中和地上部Mn含量接近。土壤培养方式下,则是地上部Mn含量最高,其次是根中,根表铁膜中最低。Mn在植物体内的分布规律一般都是地上部大于根部[24-25],尤其在外源添加 Mn 的情况下,地上部Mn的分配比例更高[26],说明Mn是一种很容易从根系向地上部运输的元素。本试验中水稻生长的淹水环境中,Mn被还原为Mn2+,其植物有效性很强,相当于外源供应多余的Mn,所以地上部Mn含量最高。
2.4 不同铁镉处理下水稻根表、根中及地上部Cu含量
图3显示,营养液培养条件下,水稻根表铁膜中Cu在高Fe供应时高于低Fe供应和无Fe供应。而在土壤培养条件下,根表铁膜中Cu则是供Fe处理低于未供Fe处理,这与前面两种元素变化规律不同。营养液培养条件下,水稻根中和地上部Cu含量除个别处理低以外,其它处理之间未呈现明显的规律。而在土壤培养条件下,水稻根中和地上部Cu含量则是供Fe处理低于未供Fe处理。在土壤培养条件下,Cd也有降低根系和地上部Cu含量的趋势,而在营养液培养条件下此规律不明显。这与Cd对Mn的影响呈现不同的规律。

图2 营养液和土壤培养方式下水稻根表、根中和地上部锰含量Fig.2 Concentrations of Mn in root surface,roots and shoots in the hydroponics and soil culture experiments
营养液培养方式下,水稻根表铁膜中、根中以及地上部Cu含量接近。但土壤培养条件下,三者差异很大,根中Cu含量远远高于根表铁膜中和地上部,有的处理根中Cu含量达到铁膜中和地上部的10倍左右。
2.5 不同铁镉处理下水稻根表、根中及地上部Zn含量
图4显示,不管营养液培养还是土壤培养条件下,水稻根表铁膜中Zn在不同Fe处理之间均未呈现明显规律,而根中和地上部Zn(土培条件下除外)含量则随着介质中供Fe浓度的增加而呈现下降趋势。两种培养方式下Cd在一定程度上降低了根系和地上部Zn含量。
营养液培养方式下,水稻根表铁膜中Zn含量远远高于根中和地上部,而土壤培养条件下,三者差异不大,根中Zn含量略高于根表铁膜和地上部。
3 讨论与结论
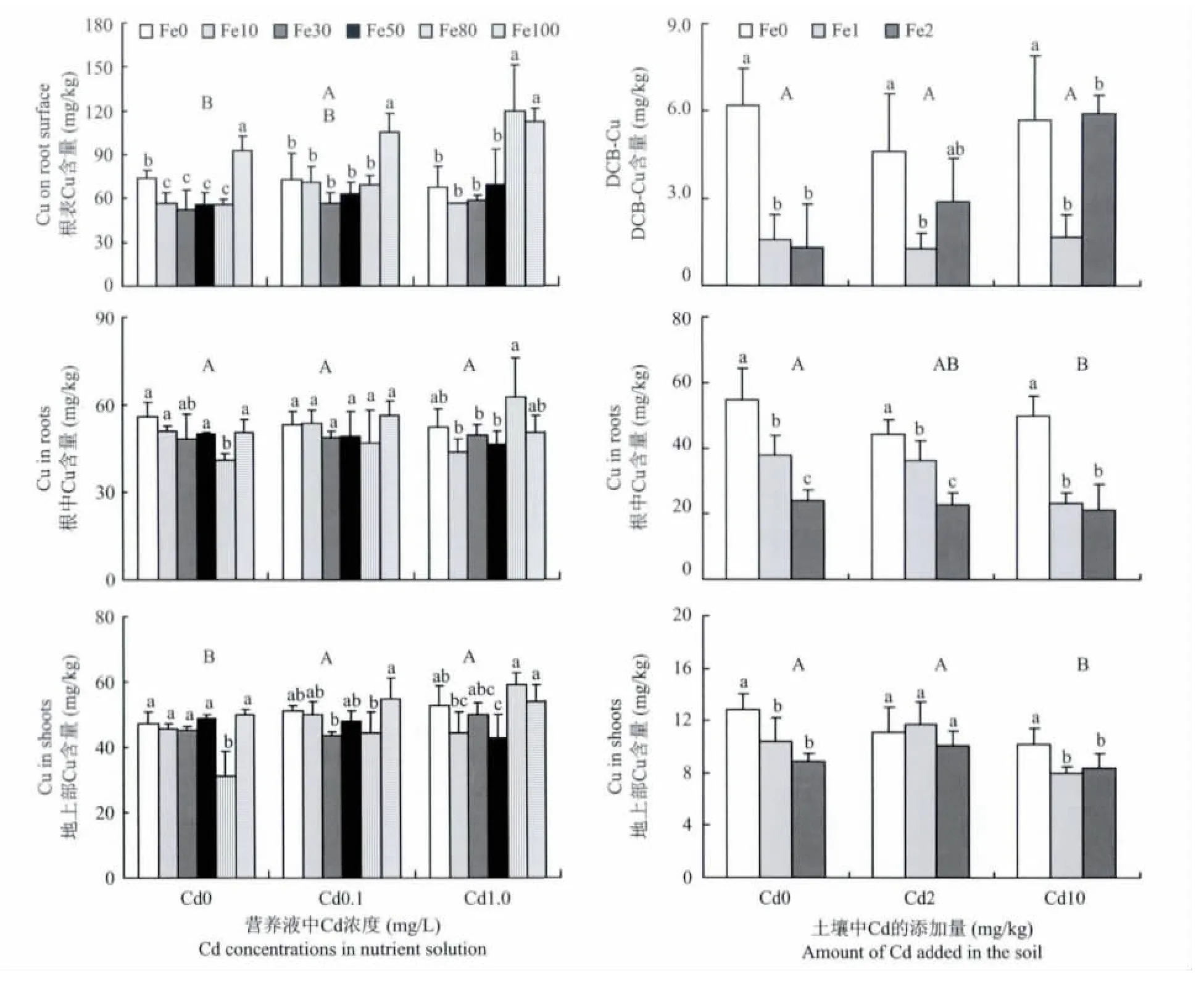
图3 营养液和土壤培养方式下水稻根表、根中和地上部铜含量Fig.3 Concentrations of Cu in root surface,roots and shoots in the hydroponics and soil culture experiments
本试验中,生长介质中供应不同浓度Fe,能够诱导水稻根表形成大量铁膜,而且铁膜量随着生长介质中Fe浓度的增加而增加。然而DCB提取的铁膜中Cd、Mn、Cu、Zn含量大多数情况下,并没有随着铁膜量的增加而增加。如营养液培养条件下,在高浓度Cd供应时,铁膜的增加还减少了其中Cd含量。铁膜中Zn含量则随铁膜量的增加未呈现明显的变化规律,铁膜中Mn和Cu也只在高量Fe供应时才有所增加(营养液培养Cu除外)。在土壤培养条件下,铁膜中Cd和Mn随铁膜量增加有一定程度的增加,但与铁膜自身的增加幅度相比却小的多。
由此可见,不同元素不仅被铁膜吸附的程度不同,而且向根中运输的比例也不同,其中Cd元素是最不容易被铁膜吸附的元素,不管在土壤培养还是营养液培养条件下,大部分Cd都可以通过铁膜进入根中,且与其它元素相比,Cd在铁膜中的比例更小,向根中运输的能力更大,铁膜中Cd与根中Cd含量在土壤培养和营养液培养条件下相差倍数最高分别达到100倍和10倍,说明铁膜对Cd的阻挡能力有限,其原因可能是Cd本身在土壤-植物系统中的移动性较强,加之水稻对Cd的吸收累积能力较大[27]。对于Mn、Zn、Cu三种元素,不同培养体系下铁膜对它们的吸附情况各不相同,营养液培养条件下,Mn、Zn、Cu在铁膜中的数量大于根中和地上部,尤其Zn元素最为明显,而在土壤培养条件下则又是根系中大于铁膜中。
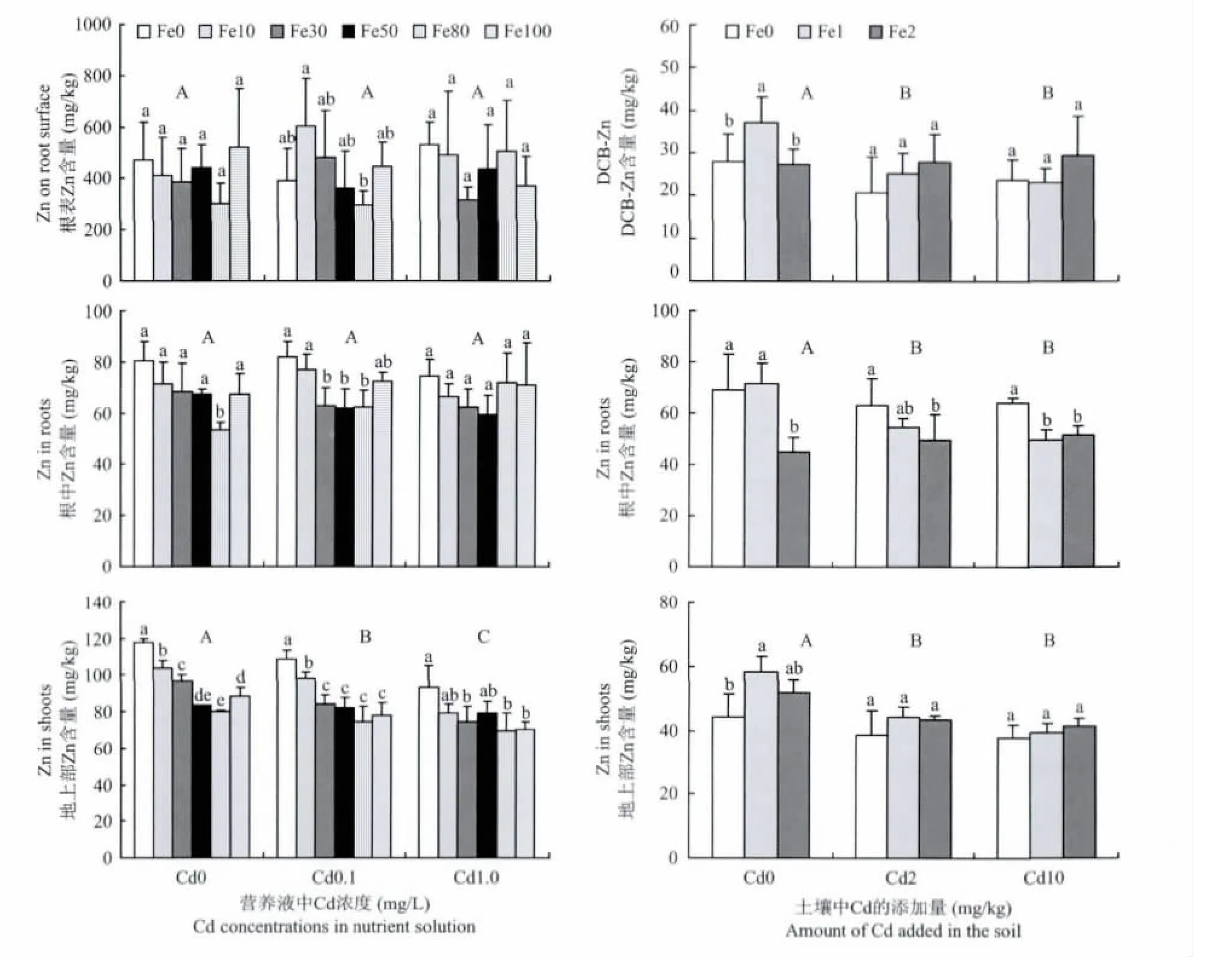
图4 营养液和土壤培养方式下水稻根表、根中和地上部锌含量Fig.4 Concentrations of Zn in root surface,roots and shoots in the hydroponics and soil culture experiments
可见,铁膜对Cd、Mn、Cu、Zn的吸附作用,因培养体系和元素种类不同而有差异。土壤培养和营养液培养的差异在于,土壤培养体系中外源Fe在水稻移栽之前就施入土壤,铁膜的形成和元素的吸收同时进行,所以铁膜的阻挡作用并未发挥,而营养液培养体系中,水稻先形成铁膜(在此过程营养液中未供应其他元素),再在正常营养液中生长,所以铁膜的作用明显,铁膜吸附的Mn、Zn、Cu也比根中和地上部多。实际上,许多学者的研究也证明水稻根表铁膜在不同培养条件下对不同元素的吸附作用表现出较大的差异性。Chen等的研究结果也表明,在营养液培养条件下,形成铁膜的水稻根表Al的吸附量远远高于未形成铁膜的根表,而且铁膜中Al含量是根中含量的10倍左右[2]。Liu等也发现营养液培养系统下,水稻铁膜中As含量高于根中[28],Zhou等对Se的研究也具有同样的规律[10]。但Deng等的研究却发现营养液培养条件下,铁膜中As含量低于根中含量,根中含量在350 mg/kg左右,而铁膜中含量则在160 270 mg/kg[29]。Liu等在土壤培养条件下,研究了三个不同品种水稻根表铁膜对Pb吸收的影响,研究结果表明,Pb在根系组织中含量占78%~93%,而在铁膜中占 6% ~21%[30]。
本试验中,Cd、Mn、Zn、Cu在铁膜中量并不是随着铁膜量的增加而增加,然而水稻根系和地上部中这些元素的含量则大多数随着介质中Fe浓度的增加而下降,营养液培养条件下,根中和地上部Fe与Cd、Mn、Zn含量之间达到显著性负相关关系,相关系数分别为根系 rFe-Cd=0.8924,rFe-Mn=0.7158,rFe-Zn=0.5033,地 上 部 rFe-Cd=0.8119,rFe-Mn=0.5554,rFe-Zn=0.8260(n=27,0.367,P < 0.05;0.470,P<0.01)。土壤培养条件下,相关系数分别为根系 rFe-Cd=0.9070、rFe-Mn=0.7825、rFe-Zn=0.7800、rFe-Cu=0.8307,地上部 rFe-Cd=0.8141、rFe-Mn=0.7511(n=18,0.444,P <0.05;0.561,P <0.01),说明根系和地上部Cd、Mn、Zn含量的下降与Fe元素含量增加有密切关系,很有可能是生长介质中的Fe2+和植株体内的Fe降低了水稻对Cd2+、Mn2+、Cu2+、Zn2+的吸收和运输。元素之间的拮抗作用在植物吸收和运输过程中非常普遍,有研究报道Fe2+的吸收运输过程蛋白(ZIP和Nramp家族蛋白)也可以运输 Mn2+、Zn2+、Cd2+等离子[31],由此推断,介质中的Fe2+势必与Mn2+、Zn2+、Cd2+竞争吸收运输系统,抑制植物对这些元素的吸收。Cd可以干扰Zn、Fe、Mn、Cu和Ca向植物地上部的运输[32]。本试验中Cd也对Mn、Cu和Zn的吸收和运输具有一定的抑制作用,也是元素之间拮抗作用的表现,在前人的研究中也得到证明。
[1]Armstrong W.The oxidizing activity of roots in water-logged soils[J].Physiol.Plant,1967,20:920 -926.
[2]Chen C C,Dixon J B,Turner F T.Iron coatings on rice roots:mineralogy and quantity influencing factors[J].Soil Sci.Soc.Am.J.,1980,44:635-639.
[3]郭伟,林咸永,程旺大.不同地区土壤中分蘖期水稻根表铁氧化物的形成及其对砷吸收的影响[J].环境科学,2010,319(2):496-503.Guo W,LIN X Y,Cheng W D.Effect of iron plaque formation of root surface on As uptake by rice seedlings grown on different types of soils[J].Environ.Sci.,2010,319(2):496 -503.
[4]刘文菊,胡莹,朱永官,等.磷饥饿诱导水稻根表铁膜形成机理初探[J].植物营养与肥料学报,2008,1:22-27.Liu W J,Hu Y,Zhu Y G et al.The mechanisms of iron plaque formation on the surface of rice roots induced by phosphorus starvation[J].Plant Nutr.Fert.Sci.,2008,1:22 -27.
[5]Wang M Y,Chen A K,Wong M H et al.Cadmium accumulation in and tolerance of rice(Oryza sativa L.)varieties with different rates of radial oxygen loss[J].Environ.Poll.,2011,159:1730-1736.
[6]Liu J G,Cao C X,Wong M H et al.Variations between rice cultivars in iron and manganese plaque on roots and the relation with plant cadmium uptake[J].J.Environ.Sci.,2010,22(7):1067-1072.
[7]Greipsson S,Crowder A A.Amelioration of copper and nickel toxicity by iron plaque on roots of rice(Oryza sativa L.)[J].Can.J.Bot.,1992,70:824 -830.
[8]Liu W J,Zhu Y G,Smith FA et al.Do iron plaque and genotypes affect arsenate uptake and translocation by rice seedlings(Oryza sativa L.)grown in solution culture[J].J.Exp.Bot.,2004,55:1707-1713.
[9]Chen R F,Shen R F,Gu P et al.Response of rice(Oryza sativa)with root surface iron plaque under aluminium stress[J].Ann.Bot.,2006,98:389-395.
[10]Zhou X B,Shi W M,Zhang L H.Iron plaque outside roots affects selenite uptake by rice seedlings(Oryza sativa L.)grown in solution culture[J].Plant Soil,2007,290:17-28.
[11]Ye Z H,Baker A J M,Wong M H et al.Zinc,lead and cadmium tolerance,uptake and accumulation by Typha latifolia[J].New Phytol.,1997,136:469-480.
[12]Liu H J,Zhang J L,Zhang F S.Role of iron plaque in Cd uptake by and translocation within rice(Oryza sativa L.)seedlings grown in solution culture[J].Environ.Exp.Bot.,2007,59(3):314-320.
[13]Liu H J,Zhang J L,Christie P,Zhang F S.Influence of iron plaque on uptake and accumulation of Cd by rice(Oryza sativa L.)seedlings grown in soil[J].Sci.Tot.Environ.,2008,394:361-368.
[14]刘文菊,尹君,李习平,等.根表铁膜对水稻吸收污灌土壤中的锌的影响[J].土壤与环境,2001,10(4):270-272.Liu W J,Yin J,Li X P et al.Effect of root iron plaque on Zn uptake by rice in soil irrigated with wastewater[J].Soil Environ.Sci.,2001,10(4):270-272.
[15]张西科,尹君,刘文菊,等.根系氧化力不同的水稻品种磷锌营养状况的研究[J].植物营养与肥料学报,2002,80:54-57.Zhang X K,Yin J,Liu W J et al.The nutritional status of P and Zn on rice cultivars with different oxidizing power of roots[J].Plant Nutr.Fert.Sci.,2002,80:54-57.
[16]Liang Y,Zhu Y G,Xia Y et al.Iron plaque enhances phosphorus uptake by rice(Oryza sativa)growing under varying phosphorus and iron concentrations[J].Ann.Appl.Biol.,2006,149(3):305-312.
[17]Fu J J,Zhou Q F,Liu J M et al.High levels of heavy metals in rice(Oryza sativa L.)from a typical E-waste recycling area in southeast China and its potential risk to human health[J].Chemosphere,2008,71:1269-1275.
[18]Ji W C,Chen Z Q,Li D et al.Identifying the criteria of cadmium pollution in paddy soils based on a field survey[J].Energy Proc.,2012,16:27-11.
[19]Korshunova Y O,Eide D,Clark W G et al.The IRT1 protein from Arabidopsis thaliana is a metal transporter with a broad substrate range[J].Plant Mol.Bio.,1999,40:37-44.
[20]Nakanishi H,Ogawa I,Ishimaru Y.Iron deficiency enhances cadmium uptakeand translocation mediated bytheFe2+transporters OsIRT1 and OsIRT2 in rice[J].Soil Sci.Plant Nutr.,2006,52:464-469.
[21]Thomine S,Lelievre F,Debarbieux E et al.AtNRAMP3,a multispecific vacuoluarmetaltransporterinvolved in plant responses to iron deficiency[J].Plant J.,2003,34:685-695.
[22]Oomen R JF J, WuJ, LelievreF etal. Functional characterization of NRAMP3 and NRAMP4 from the metal hyperaccumulator Thlaspi caerulescens[J].New Phytol.,2009,181:637-650.
[23]Aung M S,Masuda H,Kobayashi T et al.Iron biofortification of Myanmar rice[J].Fron.Plant Sci.,2013,4(158):1 -14.
[24]Mou D L,Yao Y N,YangY Q et al.Plant high tolerance to excess manganese related with root growth,manganese distribution and antioxidative enzyme activity in three grape cultivars[J].Ecotoxicol.Environ.Saf.,2011,74:776-786.
[25]Yoshihara T,Goto F,Shoji K et al.Cross relationships of Cu,Fe,Zn,Mn,and Cd accumulations in common japonica and indica rice cultivars in Japan[J].Environ.Exper.Bot.2010,68:180-187.
[26]Zornoza P,Sánchez-Pardo B,Carpena R O et al.Interaction and accumulation of manganese and cadmium in the manganese accumulator Lupinus albus[J].J.Plant Physiol.,2010,167:1027-1032.
[27]Shah K,Kumar R G,Verma S,Dubey R S.Effect of cadmium on lipid peroxidation,superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings[J].Plant Sci.,2001,161:1135-1144.
[28]Liu W J,Zhu Y G,Smith F A et al.Do phosphorus nutrition and iron plaque alter arsenate(As)uptake by rice seedlings in hydroponics culture?[J].New Phytol.,2004,162:481-488.
[29]Deng D,Wu S C,Wu F Y et al.Effects of root anatomy and Fe plaque on arsenic uptake by rice seedlings grown in solution culture[J].Environ.Poll.,2010,158:2589-2595.
[30]Liu J G,Leng X M,Wang M X et al.Iron plaque formation on roots of different rice cultivars and the relation with lead uptake[J].Ecotoxicol.Environ.Saf.,2011,74:1304-1309.
[31]Korshunova Y O,Eide D,Clark W G et al.The IRT1 protein from Arabidopsis thaliana is a metal transporter with a broad substrate range[J].Plant Mol.Biol.,1999,40:37-44.
[32]Solti A,Gáspár L,Mészáros I et al.Impact of iron supply on the kinetics of recovery of photosynthesis in Cd-stressed poplar(Populus glauca)[J].Ann.Bot.,2008,102:771-782.
