硫化氢在休克肠淋巴液致肝损伤中的作用与机制*
2013-12-01张立民陈立锋赵自刚李曙光牛春雨
韩 波, 张立民, 陈立锋, 赵自刚, 李曙光△, 牛春雨△
(1河北北方学院微循环研究所,河北张家口075029;2内蒙古自治区乌兰察布市中心医院,内蒙古乌兰察布012000)
肝脏是人体最大的内脏器官,在机体新陈代谢中发挥重要作用。创伤、失血、内毒素等严重致病因素引起的肝损伤,成为多器官衰竭发生的重要环节[1-4]。近年来,学者们开始关注淋巴系统与危重病发病机制的关系,认为危重状态下的肠淋巴液回流是导致机体重要器官结构损伤、功能障碍的关键因素[5-6]。我们的研究也表明,阻断肠淋巴液回流可减轻失血-脂多糖、重症失血性休克大鼠肝脏的组织学损伤[7-9],其机制还有待深入研究。研究表明,硫化氢(hydrogen sulfide,H2S)作为一种内源性气体分子,在炎症反应、信号转导、能量代谢、细胞增殖与凋亡、氧化还原状态等方面具有多种生物学活性[10],参与了失血性休克和内毒素休克后的炎症反应以及器官损伤[11-12]。H2S引起的炎症反应是否与肠淋巴液回流导致的肝细胞损伤有关,国内外尚无详细的报道。为此,本研究应用H2S合成酶胱硫醚γ-裂解酶(cystathionine γ-lyase,CSE)抑制剂 DL-炔丙基甘氨酸(DL-propargylglycine,PPG)和 H2S供体硫氢化钠(sodium hydrosulfide,NaHS)作用于行肠淋巴液引流的大鼠,探讨H2S在肠淋巴液引流减轻休克大鼠肝损伤中的作用,结合Toll样受体4(Toll-like receptor 4,TLR4)、白细胞介素(interleukin,IL)-10、IL-12 和肿瘤坏死因子 α(tumor necrosis factorα,TNF-α)的变化,探讨其作用机制。
材料和方法
1 动物与处理
30只健康、清洁级Wistar雄性大鼠,购自中国军事医学科学院实验动物中心[动物许可证号为SCXK(军)2007-004],体质量220~260 g。大鼠经过1周适应性饲养后,随机均分为:假手术组(sham)、休克组(shock)、休克+引流组(shock+drainage)、休克+引流+PPG组(shock+drainage+PPG)和休克+引流+NaHS组(shock+drainage+NaHS)。动物在实验前禁食12 h,自由饮水。休克+引流+PPG组大鼠于放血前0.5 h腹腔注射 PPG(Sigma,45 g/L,45 mg/kg),休克+引流+NaHS组大鼠于放血前0.5 h腹腔注射 NaHS(Sigma,28 mmol/L,28 μmol/kg),PPG和NaHS所用剂量参考文献[13-14];假手术组、休克组和休克+引流组大鼠于放血前0.5 h或相当时点腹腔注射与另外2组等量的生理盐水(1 mL/kg)。实验过程中动物处置符合动物伦理学标准。
2 复制失血性休克模型
大鼠经乙醚诱导麻醉后,肌肉注射1%戊巴比妥钠(50 mg/kg,德国/北京化学试剂公司分装)全身麻醉,休克组、休克+引流组、休克+引流+PPG组和休克+引流+NaHS组大鼠复制失血性休克模型[15-16]:(1)股部手术,分离股静脉和股动脉,右侧股静脉注射肝素钠(1 mL/kg,500 U/kg)全身抗凝后,连接WZF-250F2型输液泵(浙大医学仪器有限公司),备输液;右侧股动脉插管连接RM6240 BD型生物信号采集系统(成都仪器厂)监测平均动脉血压(mean artery pressure,MAP);左侧股动脉连接 NE-1000型抽注机(New Era Pump Systems),备放血;(2)腹部正中线作长4 cm纵切口,打开腹腔,轻轻推开肠管,暴露肠系膜根部,游离肠系膜上动脉,仔细分离与肠系膜上动脉相伴行的肠淋巴管;(3)术毕稳定30 min后,自股动脉匀速放血至40 mmHg,10 min完成;实验过程中,以调整放血量维持血压在(40±2)mmHg水平,60 min;(4)通过股静脉缓慢回输放出血液及林格氏液(1∶1),30 min完成;(5)休克+引流组、休克+引流+PPG组和休克+引流+NaHS组在低血压60 min、输液30 min结束后,用一次性采血针插入肠淋巴管,引流肠淋巴液。休克组动物仅剥离肠淋巴管,假手术组动物仅进行相同的手术操作,但不放血,不输液,不引流肠淋巴液,观察至与其它各组相对应的时点。各组大鼠在输液结束后3 h或相应时点,经腹主动脉取血,留取大鼠肝脏,用于下述指标的检测。
3 检测血浆生化指标
应用7600-110型全自动生化分析仪(日立),采用速率法检测血浆天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)和总胆汁酸(total bile acid,TBA)。
4 观察肝组织形态
选择固定位置肝组织,以4%多聚甲醛液固定,石蜡包埋、切片,苏木精-伊红(HE)染色,常规方法制备组织切片,光镜下观察肝脏组织学变化,并拍片。
5 检测肝组织H 2S含量
用不同浓度的NaHS标准液绘制标准曲线,其直线回归方程为:y=1532.5x+6.786,R2=0.995。选择固定位置肝组织,常规方法制备10%组织匀浆,检测H2S含量:在玻璃试管中加入10 g/L醋酸锌0.5 mL后,加入肝匀浆0.1 mL,振荡摇匀,再依次加入20 mmol/L对苯二胺盐酸盐0.5 mL和30 mmol/L三氯化铁0.5 mL,室温孵育20 min,再加入1 mL 10%三氯醋酸使蛋白沉淀,最后以蒸馏水补足5 mL,充分混匀后,6 000 r/min离心5 min,吸上清液,用722分光光度计在670 nm波长处测其吸光度,应用H2S标准曲线计算H2S含量(μmol/L)。考马斯亮蓝法定量肝匀浆总蛋白,肝匀浆H2S含量以μmol/(g protein)表示。
6 检测肝组织CSE含量
应用ELISA检测试剂盒(抗体由R&D生产、江苏镇江厚普生物科技有限公司合成),绘制标准曲线(y=0.227x -0.028x2+0.003x3,R2=0.9987)后,严格按照试剂盒说明书,检测各组肝组织匀浆CSE的含量。
7 检测肝组织炎症因子含量
应用ELISA法检测 TLR4、IL-10、IL-12和 TNF-α。TLR4标准曲线为:y=0.058x+0.005x2+0.00021x3,R2=0.9958;IL-10标准曲线为:y=0.025x+0.0004x2- 0.00000083x3,R2=0.9989;IL-12 标准曲线为:y=0.023x+0.003x2-0.00004x3,R2=0.9986;TNF-α标准曲线为:y=1.003x+0.0001x2+0.00000032x3,R2=0.9991。
8 统计学处理
数据以均数±标准差(mean±SD)表示,应用SPSS 16.0统计软件包处理。首先进行方差齐性检验,方差齐(P>0.10)的资料多组间比较采用单因素方差分析,两两比较用SNK-q检验,方差不齐(P≤0.10)的资料采用Kruskal-Wallis检验。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠肝组织H 2S含量的变化
休克组大鼠肝组织H2S含量显著高于假手术组(P<0.01);休克+引流组大鼠肝组织H2S含量与休克组相比出现了下降的趋势,有显著差异(P<0.05),但仍高于假手术组(P<0.01);加入PPG的休克+引流+PPG组大鼠肝组织H2S含量显著下降,低于休克组与休克+引流组(P<0.05或P<0.01);而加入NaHS的休克+引流+NaHS组大鼠肝组织H2S含量显著高于假手术组和休克+引流组(P <0.05,P <0.01),达到休克组水平,见图1。

Figure 1.Changes of hydrogen sulfide(H2 S)in rat liver tissues.Mean ± SD.n=6.**P < 0.01 vs sham group;#P<0.05,##P<0.01 vs shock group;△P<0.05 vs shock+drainage group.图1 各组大鼠肝组织H 2S含量的变化
2 各组大鼠肝组织CSE含量的变化
休克组大鼠肝组织CSE含量显著高于假手术组(P<0.05);休克+引流组、休克+引流+PPG组和休克+引流+NaHS组大鼠肝组织CSE含量均显著低于休克组(P<0.01),3组间无统计学差异(P>0.05),见图 2。
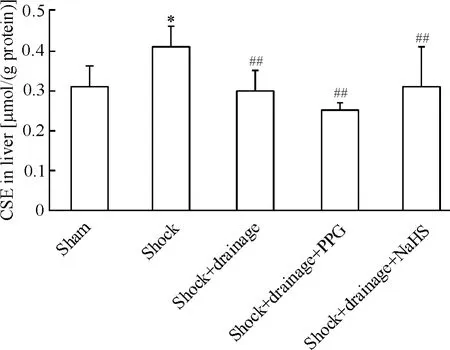
Figure 2.Changes of cystathionine γ-lyase(CSE)in rat liver tissues.Mean±SD.n=6.*P < 0.05 vs sham group;##P <0.01 vs shock group.图2 各组大鼠肝组织CSE含量的变化
3 各组大鼠肝功能生化指标的变化
休克组大鼠血浆AST、ALT和TBA水平显著高于假手术组(P<0.05),休克 +引流组大鼠血浆AST、ALT和TBA水平显著低于休克组(P<0.05),加入PPG的休克+引流+PPG组血浆AST、ALT和TBA水平显著低于休克+引流组(P<0.05或P<0.01),而加入NaHS的休克+引流+NaHS组血浆AST和 ALT水平显著高于休克 +引流组(P< 0.05),见表1。

表1 各组大鼠肝功能生化指标的变化Table 1.Changes of biochemical indexes of hepatic functions in rats(Mean±SD.n=6)
4 各组大鼠肝组织形态学变化
假手术组大鼠肝索呈放射状排列,血窦宽度基本正常,肝细胞核圆、核仁明显、核膜清晰,可见双核,胞浆染色嗜酸、均质,见图3A、B;休克组大鼠肝细胞排列稍紊乱,部分水肿,可见肝细胞坏死,见图3C、D;休克+引流组肝细胞排列稍紊乱,核大小一致、圆形、居中,核膜清晰,见图3E、F;休克+引流+PPG组肝索排列及肝细胞形态基本正常,肝小叶周边细胞可见轻度水肿,见图3G、H;休克 +引流+NaHS组肝细胞损伤程度明显重于休克+引流组,见图 3I、J。

Figure 3.Changes of hepatic pathomorphology in rats(HE staining;A,C,E,G,I,×100;B,D,F,H,J,×400).A,B:sham group;C,D:shock group;E,F:shock+drainage group;G,H:shock+drainage+PPG group;I,J:shock+drainage+NaHS group.图3 各组大鼠肝组织形态学变化
5 各组大鼠肝组织炎症因子的变化
如表2所示,休克组大鼠肝组织TLR4、IL-10、IL-12和TNF-α含量均显著高于假手术组(P<0.05或P<0.01),休克 +引流组大鼠肝组织 TLR4、IL-10、IL-12和TNF-α较休克组均出现了下降趋势,IL-10、IL-12和 TNF-α含量显著低于休克组(P<0.05),TNF-α含量显著高于假手术组(P<0.05);休克+引流+PPG组大鼠肝组织TLR4、IL-10、IL-12和TNF-α含量进一步下降,均显著低于休克组(P<0.05或P<0.01),TNF-α含量显著低于休克 +引流(P<0.05);而加入NaHS的休克+引流+NaHS组大鼠肝组织TLR4、IL-10、IL-12和TNF-α含量均显著高于假手术组(P<0.01),IL-10、IL-12和 TNF-α含量显著高于休克+引流组(P<0.05或P<0.01)。

表2 各组大鼠肝组织TLR4、IL-10、IL-12和TNF-α含量的变化Table 2.Changes of TLR4,IL-10,IL-12 and TNF-α in hepatic homogenate in rats[ng/(g protein).Mean ±SD.n=6]
讨 论
为了探讨H2S在肠淋巴液引流减轻休克大鼠肝损伤中的作用,本研究首先检测了各组大鼠肝组织中H2S的含量,发现休克组大鼠肝组织H2S含量显著升高,肠淋巴液引流则降低了H2S含量,PPG进一步加强了肠淋巴液引流的作用,而肠淋巴液引流的作用被NaHS废除。这些结果表明,肠淋巴液引流可降低肝组织H2S含量。一般来说,H2S由CSE以L-半胱氨酸为底物合成,由于CSE存在于血管内皮细胞、血管平滑肌细胞以及多个器官的组织细胞,故H2S可产生于机体的各个组织,发挥相应的生物学效应。因此,肝组织降低的H2S,既有来自于肠道产生的H2S随着肠淋巴液引流至体外而减少的原因,又有肠淋巴液引流降低了毒性物质引起血液循环系统以及肝脏本身产生H2S作用的因素。进一步研究发现,休克组大鼠肝组织CSE含量显著升高,肠淋巴液引流与PPG降低了休克组大鼠肝组织的CSE含量,而NaHS对肝组织CSE含量无显著影响,这说明肠淋巴液引流降低H2S的作用是通过抑制CSE活性实现的,而NaHS作为CSE的下游产物,在体内可直接生成H2S,故外源NaHS对CSE活性无影响。
为了进一步探讨抑制CSE活性、增加H2S含量是否影响了肠淋巴液引流减轻肝损伤的作用,本文观察了反映肝功能的生化指标以及组织形态变化,发现休克组大鼠AST、ALT和TBA显著升高,而肠淋巴液引流则抑制了这些指标的升高,从而减轻了肝损伤的程度;加入PPG使肠淋巴液引流的作用朝着更为有利的方向发展,相反加入NaHS的大鼠这些指标的变化与休克组相似,说明NaHS逆转了肠淋巴液引流的作用。同样的变化在肝组织形态学方面得到了证实。这些结果提示H2S具有降低肠淋巴液引流减轻失血性休克大鼠肝组织结构损伤的作用,在肠淋巴液引流减轻肝损伤的过程中发挥负面作用。
研究表明,内源性气体分子H2S促进了失血性休克动物模型全身炎症反应综合征的发生,PPG可降低血浆TNF-α、IL-1、IL-6和 IL-10的含量,降低肺组织髓过氧化物酶活性[11,17],提示H2S参与了失血性休克后器官损伤的发生。同样的研究表明,H2S在严重烧伤小鼠炎症反应启动的过程中具有重要意义[18],TLR4在失控的炎症反应发生过程具有重要意义[19-20],所以,本文从TLR4及其下游炎症因子的变化,探讨H2S在肠淋巴液引流减轻器官损伤中的作用。结果发现,休克组大鼠肝组织TLR4、IL-10、IL-12和TNF-α含量均显著升高,肠淋巴液引流则降低了IL-10、IL-12和TNF-α的含量,表明肠淋巴液引流减轻了肝组织的炎症反应;休克+引流组大鼠给予PPG后,进一步降低了肝组织TLR4、IL-10、IL-12和TNF-α的含量;H2S供体NaHS在增加休克+引流组大鼠肝组织TLR4含量的同时,增加了肝组织IL-10、IL-12和TNF-α含量,提示外源性H2S加剧了这些组织器官的炎症反应,成为组织器官损伤的重要发病机制。值得注意的是,在创伤、失血等因素导致的炎症反应过程中,表现为炎症介质的增高以及随后的抗炎反应增强,以至于表现为炎症反应与抗炎反应在高水平上的交替,这也成为失控的炎症反应、器官损伤的重要因素。在本研究中,失血性休克后抗炎细胞因子IL-10与炎症介质IL-12、TNF-α均出现了增高,提示此时机体处于炎症反应与抗炎反应互相竞争的阶段;而肠淋巴液引流均降低了肝组织炎症介质与抗炎因子的水平,这对于降低机体炎症反应是有利的;而PPG与NaHS对肠淋巴液引流后的作用也显示,作为前炎症气体信号分子的H2S在肠淋巴液引流降低肝组织炎症反应的过程中发挥负面作用。
应当指出,尽管休克肠淋巴液引流使肝组织TLR4含量有下降的趋势,但差异没有统计学意义,这可能与观察时间等因素有关;但给予CSE抑制剂PPG降低了肝组织的炎症反应,给予NaHS在增加TLR4的同时,亦导致了肝组织的炎症反应,结果说明H2S加重肝损伤的作用机制与炎症反应加剧有关。当然,这有待在以后的研究中进一步深入探讨。同时,由于Mok等[11]的研究已经证明了PPG可降低失血性休克大鼠血清的炎症介质水平,减轻肝的组织损伤,故本研究没有设置PPG对休克大鼠作用的休克+PPG组。
总之,休克肠淋巴液引流可减轻失血性休克大鼠肝脏的组织学损伤与功能障碍,其作用机制与降低H2S含量有关。以肠淋巴液和气体信号分子H2S作为干预靶点,对于防治失血性休克后的肝损伤具有重要意义。
