川芎嗪对CIA大鼠足爪组织MMP-13蛋白表达及血清VEGF、IL-17和IL-23水平的影响*
2013-12-01张松峰母传贤沈永杰
田 华, 张松峰, 芦 琨, 母传贤, 沈永杰
(商丘医学高等专科学校1生物化学与分子生物学教研室,2临床医学系,河南商丘476100)
类风湿性关节炎(rheumatoid arthritis,RA)是一种自身免疫性疾病,其主要病理特点是滑膜细胞增生,衬里层增厚,多种炎症细胞浸润,血管翳形成,以及软骨和骨组织破坏,最终导致关节畸形和功能丧失,但其确切机制目前未明。近年研究发现细胞因子[1]网络失衡和基质金属蛋白酶[2]在RA的发生、炎症迁延、关节的破坏中占有重要的地位。川芎嗪(tetramethylpyrazine,TMP)有抗肿瘤血管生成作用[3],并能抑制血管内皮细胞的增殖和抗炎作用早已得到证实,但是其机制还不甚清楚。本实验在成功地建立胶原性关节炎(collagen-induced arthritis,CIA)大鼠模型的基础上,通过检测大鼠血清中血管内皮生长因子(vascular endothelial growth factors,VEGF)、白细胞介素 17(interleukin 17,IL-17)和白细胞介素23(interleukin 23,IL-23)水平以及足爪皮下组织中基质金属蛋白酶13(matrix metalloproteinase 13,MMP-13)的表达,探讨TMP治疗 CIA大鼠的可能机制,为临床使用TMP治疗RA提供新的理论依据和实验数据。
材料和方法
1 动物
Sprague-Dawley(SD)大鼠50只,雌雄各半,重约(180±20)g,购自华中科技大学同济医学院实验动物中心,许可证号为SCXK(鄂)2012-0007。
2 主要试剂
磷酸川芎嗪片,无锡市第七制药厂生产,规格:50 mg×100片,批号为030201;地塞米松盐酸注射液(5 g·L-1)购自河南确山龙渊药业有限公司。弗氏完全佐剂和鸡Ⅱ型胶原由上海本草生物医学工程所提供;多聚赖氨酸,Sigma生产;冰醋酸,广州化学试剂二厂生产。VEGF、IL-17和IL-23试剂盒,南京建成生物工程研究所提供;MMP-13小鼠单克隆抗体免疫组化S-P试剂盒(北京中山公司),兔抗大鼠MMP-13单克隆抗体、兔抗大鼠GAPDH单克隆抗体、IP细胞裂解液和ECL化学发光试剂盒均为碧云天生物技术研究所产品。
3 主要方法
3.1 实验动物分组及用药 实验分组:实验用大鼠50只,按统计学方法随机分为正常对照组10只和CIA模型组40只。模型复制方法:将鸡Ⅱ型胶原15 mg 溶于7.5 mL 预先配制好的0.1 mol·L-1醋酸中,鸡Ⅱ型胶原浓度为2 g·L-1,共7.5 mL,于4 ℃过夜充分溶解。次日,与弗氏完全佐剂等体积于冰浴中混合并使之充分乳化,制成稳定的乳化剂15 mL(每mL含1 mgⅡ型胶原,置4℃冰箱保存备用)。在大鼠的左后肢足跖皮下注射0.1 mL致炎,第7天在大鼠尾、背多点皮下注射0.1 mL该胶原乳剂作为激发注射。正常对照组在同一部位同样方法注射0.1 mL生理盐水。造模后发现36只大鼠左足红肿明显,体积增大,说明造模成功,成功率为90%。将造模成功的36只大鼠随机分为模型对照组、地塞米松治疗组及 TMP 100 mg·kg-1及 50 mg·kg-1治疗组,每组 9只。TMP组大鼠于造模后第7~35天ig给予TMP 100 mg·kg-1和50 mg·kg-1,每天用药1 次;地塞米松治疗组ig给予2 mg·kg-1,每天用药1次;正常对照组和模型对照组ig给予2 mL·kg-1生理盐水,每天用药1次。
3.2 CIA大鼠体重测定 在致炎前(第0天)及致炎后第7、14、21、28和35天分别测量各组大鼠体重。3.3 血清细胞因子测定 实验第36天向CIA大鼠腹腔内注射3%巴比妥钠0.3~0.4 mL麻醉。剪开大鼠腹腔,10 mL注射器心脏取血,室温静置1 h,3 000 r/min离心15 min,吸取上层血清。用ELISA测定法(按试剂盒说明书进行操作)测定CIA大鼠血清中VEGF、IL-17和IL-23的含量。
3.4 病理切片 于制模第36天取下大鼠足跖部位的组织,用10%中性缓冲甲醛及时固定,石蜡包埋,切片,HE染色。
3.5 MMP-13 蛋白表达
3.5.1 免疫组化染色检测 (1)取大鼠左足跖部位的组织,依次进行10%中性缓冲甲醛固定、石蜡包埋、切片、贴片(载玻片预先用多聚赖氨酸浸泡,捞片后于60℃加热60 min,以使切片紧密贴附)及常规脱蜡至水后置 0.1 moL·L-1PBS(pH 7.4)中浸泡 5 min。(2)将切片浸入0.01 moL·L-1(pH 6.0)柠檬酸盐缓冲液中,于微波炉中加热至100℃、持续5 min,反复2次。室温自然冷却后,用0.1 moL·L-1PBS洗涤5 min×2次。(3)滴加封闭液羊血清置室温20 min,甩去多余的液体。(4)滴加1∶50羊抗MMP-13抗体,阴性对照以PBS代替Ⅰ抗,于4℃孵育过夜,以0.1 moL·L-1PBS洗涤5min×3次。滴加生物素标记Ⅱ抗,37℃孵育30 min,PBS冲洗5 min×2次。(5)滴加链霉抗生物素-过氧化物酶溶液、室温孵育10 min,同前述。(6)滴加试剂streptavidin-biotin complex(SABC),于37℃孵育30 min,用PBS冲洗5 min×3次。(7)二氨基联苯胺显色:使用DAB显色试剂盒,取1 mL蒸馏水,加试剂盒中试剂各1滴,混匀后加至切片。室温显色,镜下控制反应时间,自来水冲洗。(8)滴加苏木素轻度复染后,依次进行脱水、透明、中性胶封片及显微镜观察。
3.5.2 结果判断 以胞浆中出现淡黄至褐黄色细颗粒状着色者为阳性细胞。在光学显微镜下,每只动物随机计数500个细胞,计算每组的阳性表达率,同时记录染色强度,淡黄色为弱阳性(+),棕黄色为中等阳性(++),棕褐色为强阳性(+++),不着色为阴性(-)。
3.5.3 Western bloting检测 取0.1 g大鼠左足跖部位的组织加入1 mL裂解液匀浆,12 000×g离心5 min,取上清液测蛋白浓度。将上清液与6×loading buffer混合后,沸水浴加热5 min,离心取上清。于4℃凝胶电泳,电转移1 h至硝酸纤维膜,用5%脱脂奶粉溶液4℃封闭过夜,加入兔抗大鼠MMP-13抗体(工作浓度1∶1 000)室温孵育1.5 h,PBS/T 洗膜3 ×10 min,加入HRP标记的Ⅱ抗(工作浓度1∶5 000)室温孵育膜1 h,PBS/T洗膜4×15 min。曝光底片,扫描保存为电脑文件,用Gel-Pro Analyzer 4.0软件将条带的灰度值数字化。以GAPDH作内参照,目的条带与其相比得到相对量。
4 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 11.6统计软件进行分析,进行单因素方差分析,方差齐时,各组间两两比较采用LSD-t检验,方差不齐时,各组间两两比较采用Tamhance’s T2检验,以P<0.05为差异有统计学意义。
结 果
1 TMP对CIA大鼠体重的影响
CIA组大鼠于造模后第7天表现为食欲下降、体重减轻、活动减少、精神倦怠、明显消瘦,与正常组大鼠相比差异显著(P<0.01);TMP(100 mg· kg-1)和地塞米松给药14 d后可有效抑制CIA大鼠体重的减轻,与CIA组比较差异有统计学意义(P<0.01),而CIA+TMP(50 mg· kg-1)组与模型对照组比较无明显效果,见表1。

表1 TMP对CIA大鼠体重的影响Table 1.Effect of TMP on body weight of CIA rats(g.Mean±SD.n=9~10)
2 TMP对CIA大鼠血清VEGF、IL-17和IL-23含量的影响
CIA组血清VEGF、IL-17和IL-23的含量均较正常组大幅度上升,分别上升了50.00%、62.22%和82.41%(P <0.01);与 CIA 组比较 CIA+TMP(100 mg·kg-1)组血清 VEGF、IL-17和 IL-23的含量明显降低,分别降低了 33.33%、27.40%和 33.33%(P <0.01);与CIA组比较,地塞米松组血清VEGF、IL-17和IL-23的含量亦明显降低,分别降低了30.77%、30.14%和 37.25%(P < 0.01);而 CIA+TMP(50 mg·kg-1)治疗组与CIA组比较血清 VEGF、IL-17和IL-23的含量无明显变化,见表2。

表2 TMP对各组大鼠血清VEGF、IL-17和IL-23含量的影响Table 2.Effect of TMPon the content of serum VEGF,IL-17 and IL-23 in CIA rats(μg/L.Mean±SD.n=9~10)
3 TMP对CIA大鼠足爪组织病理改变的影响
正常组大鼠足爪皮下组织细胞排列规则,无炎症细胞浸润及血管新生;CIA组大鼠足爪皮下组织细胞排列紊乱,有大量炎症细胞浸润,血管增生明显;TMP(100 mg·kg-1)和地塞米松均能明显改善CIA大鼠足爪病理改变,皮下组织细胞排列较规则,亦明显抑制炎症细胞浸润及血管增生现象;CIA+TMP(50 mg· kg-1)组大鼠足部皮肤的病理状况无明显变化,见图1。
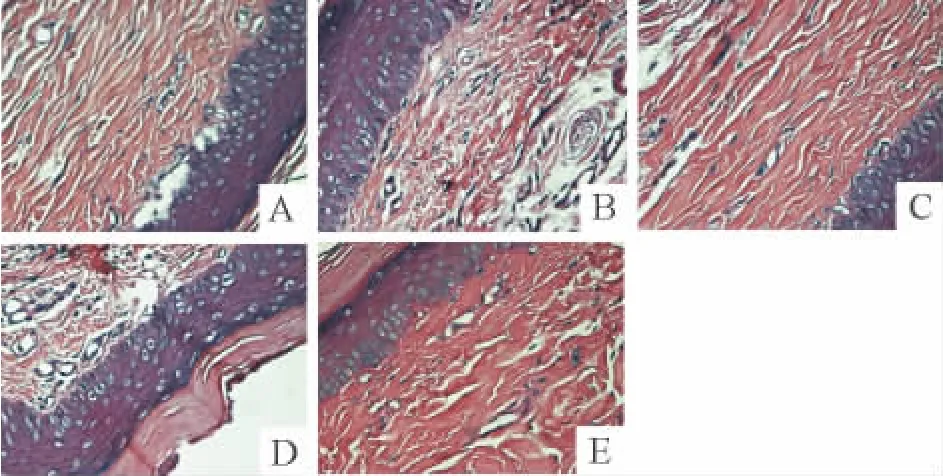
Figure 1.Effect of TMP on the histopathological changes of the paw tissues in CIA rats(×400).A:normal group;B:CIA group;C:CIA+dexamethasone group;D:CIA+TMP(50 mg· kg-1)group;E:CIA+TMP(100 mg·kg-1)group.图1 TMP对CIA大鼠足爪组织病理改变的影响
4 TMP对 CIA大鼠足爪组织中MMP-13蛋白表达的影响
4.1 免疫组化 MMP-13蛋白表达的阳性部位主要在胞浆中,在高倍镜下可见胞浆内有棕黄色的小颗粒。在正常组胞浆内几乎未见阳性染色区域;而CIA组胞浆染色呈棕黄色,MMP-13蛋白表达呈强阳性;CIA+TMP(100 mg·kg-1)和地塞米松组胞浆内略见棕黄色的小颗粒,与CIA组比较差异显著(P<0.05);CIA+TMP(50 mg·kg-1)组胞浆内 MMP-13阳性表达与CIA组相比无显著差异,见图2、表3。
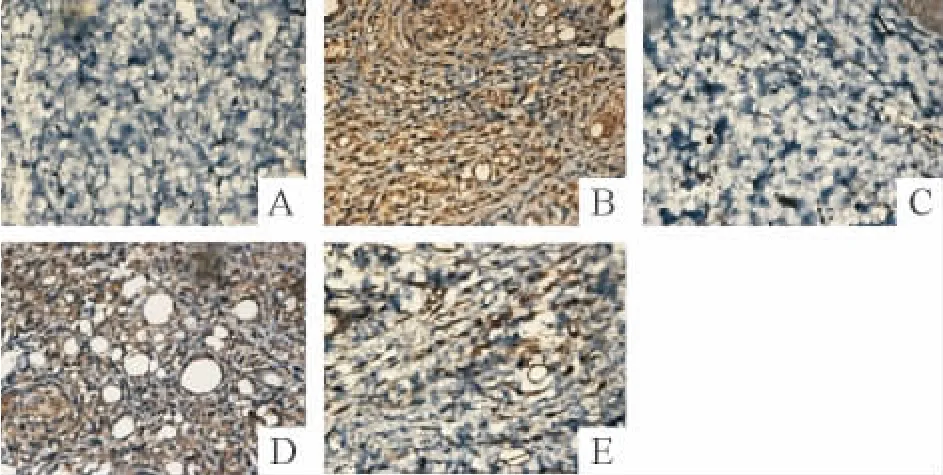
Figure 2.Effect of TMP on MMP-13 protein expression in the paw tissues of CIA rats(SABC,×400).A:normal group;B:CIA group;C:CIA+dexamethasone group;D:CIA+TMP(50 mg· kg-1)group;E:CIA+TMP(100 mg·kg-1)group.图2 TMP对CIA大鼠足爪组织中MMP-13表达的影响
4.2 Western blotting CIA组大鼠足爪组织MMP-13蛋白表达量约为正常组的2倍;与CIA组比较,CIA+TMP(100 mg·kg-1)组 MMP-13表达降低了31.82%(P < 0.01),而 CIA+TMP(500 mg·kg-1)组MMP-13表达基本上无变化;经地塞米松治疗后,MMP-13 表达降低了30.01%(P <0.01),见图3。

表3 各组大鼠足爪组织中MMP-13蛋白阳性表达率Table 3.Positive rates of MMP-13 expression in the paw tissues of CIA rats detected by immunohistochemistry(%.Mean±SD.n=9~10)

Figure 3.Effect of TMP on MMP-13 expression in the paw tissues of CIA rats determined by Western blotting assay.A:normal group;B:CIA group;C:CIA+dexamethasone group;D:CIA+TMP(50 mg· kg-1)group;E:CIA+TMP(100 mg·kg-1)group.Mean±SD.n=9~10.#P <0.05 vs normal group;△△P <0.01 vs CIA group.图3 TMP对CIA大鼠足爪组织MMP-13蛋白表达的影响
讨 论
本实验用Ⅱ型胶原诱导CIA大鼠模型,模型对照组大鼠逐渐出现食欲下降、体重减轻、活动减少、精神倦怠、明显消瘦等现象;TMP(50 mg·kg-1)治疗组用药后,CIA大鼠一般状况与模型对照组比较无明显减轻,而TMP(100 mg·kg-1)剂量能明显提高CIA大鼠食欲,增加CIA大鼠活动量,抑制CIA大鼠消瘦,增加其体重,改善CIA大鼠的精神状况,表明TMP(100 mg·kg-1)对CIA有一定的治疗效果。在此基础上我们进一步探讨了TMP治疗RA的可能机制。TMP是中药川芎的有效成分之一,属酰胺类生物碱,化学结构为四甲基吡嗪,有抗肿瘤血管生成、抑制血管内皮细胞的增殖、抗血小板聚集和抗炎等作用,目前已广泛应用于临床,是现代中西医治疗RA的常用药,但其作用机制尚不十分明确。
RA主要表现为关节滑膜的慢性炎症、滑膜血管翳形成,关节软骨破坏,最终导致关节畸形、功能丧失。关节局部炎症细胞的浸润及其分泌的炎症因子、酶等在RA关节炎性破坏中发挥重要作用[4]。
成纤维样滑膜细胞过度增殖以及滑膜血管新生是RA滑膜炎和关节破坏的最主要原因[5]。VEGF是促进血管形成最重要的细胞因子,不仅促进了RA滑膜血管翳形成,而且也是RA发病过程中的直接促炎因子。Nagashima等[6]发现,VEGF在巨噬样滑膜衬里细胞、血管平滑肌细胞和关节软骨细胞中均有表达。IL-23是新近发现的一种异源二聚体细胞因子,近期研究发现RA患者滑膜组织中IL-23 p19 mRNA和蛋白表达明显增高[7]。自然杀伤(natural killer,NK)细胞是机体重要的免疫细胞,参与一些自身免疫性疾病的发生,其表面有IL-23受体[8]。IL-23通过结合NK细胞膜表面IL-23受体复合物,通过胞内信号转导系统(如JAK2、STAT3)诱导细胞激活[8],活化的NK细胞可合成和分泌多种细胞因子,如TNF-α、TNF-β等,也可直接刺激 CD4+T细胞激活分泌IL-17等。IL-17是由促进关节炎症的免疫细胞产生的一种强大的前炎症细胞因子,也是炎症反应的微调因子,可以刺激成纤维细胞、角质细胞、上皮及内皮细胞释放 IL-6、IL-8、前列腺素 E2(prostaglandin E2,PGE2)、基质金属蛋白酶、单核细胞化学趋化蛋白和粒细胞集落刺激因子等细胞因子。IL-17还可诱导人成纤维细胞表达细胞间黏附分子1,促进T细胞增殖。IL-17能够与多种细胞因子产生协同作用,以放大炎症反应。在RA发病过程中,IL-17不仅可诱发人滑膜细胞产生GM-CSF和PGE2[9],还可以通过PI3K途径激活NF-κB,进而促进成纤维细胞释放大量炎症因子IL-6和IL-8[10],诱导滑膜细胞分泌VEGF、肝细胞生长因子等多种促进血管生成的细胞因子。我们的研究证实,TMP(100 mg· kg-1)可明显降低CIA大鼠血清中VEGF、IL-17和IL-23的含量。基质金属蛋白酶几乎能降解所有细胞外基质成分,还可激活其它基质金属蛋白酶,形成瀑布效应。MMP-13是基质金属蛋白酶的一种,又名间质胶原酶,可以降解细胞外基质中的Ⅰ、Ⅱ、Ⅲ、Ⅴ及Ⅺ型胶原纤维,而这些成分也是关节软骨的重要组成成分,在 RA 发病中起着重要作用[11]。同时,Kim 等[12]研究证实MMP-13在RA关节骨及软骨的破坏中发挥重要作用。而我们的实验同样证明,TMP(100 mg·kg-1)可明显下调CIA大鼠足爪皮下组织中MMP-13蛋白的表达,抑制CIA大鼠足爪皮下组织炎症细胞浸润剂血管增生。本研究中地塞米松与TMP(100 mg· kg-1)对CIA大鼠的治疗效果都比较理想,但地塞米松为糖皮质激素类药物,长期使用易导致患者对激素的依赖性,食欲亢进,体重增加,面部及颈背部皮下脂肪增厚,胃及十二指肠溃疡,胃肠出血,继发感染、高血压、糖尿病、肌肉无力、骨质疏松等全身的不良反应。而TMP药物毒性低,避免了诸多药物副作用。
