哮喘患儿外周血单个核细胞全基因组表达谱的差异研究*
2013-12-01黄花荣吴葆菁李雯静
孔 倩, 黄花荣, 吴葆菁, 李雯静, 陈 纯
(中山大学孙逸仙纪念医院儿科,广东广州510120)
支气管哮喘(以下简称哮喘)是气道的慢性炎症 性疾病,其发病机制主要为变应原作用于有遗传倾向的特应性体质,从而引起Th2型炎症反应[1]。目前临床上以联合应用糖皮质激素、β2受体激动剂、抗胆碱药、白三烯受体拮抗剂等治疗为主,但长期应用激素将带来不少副作用,且激素往往不能很好控制严重病例,少数患者甚至对激素无效。因此基因防治倍受人们关注。但基因防治哮喘仍存在诸多局限,最突出的问题是治疗靶向性不高。而全基因组表达谱芯片具有高通量、准确、高效等特点,能同时获得数以万计的基因活化模式,为临床上明确病因机制、早期诊断、疾病分型分期、寻找治疗靶点及提示预后等提供海量的信息[2]。因此,本研究拟通过全基因组芯片技术,分析哮喘患儿与对照组儿童的外周血单个核细胞基因表达谱的特征性改变,以期进一步明确哮喘的发病机制,寻找合适的治疗靶点。
材料和方法
1 材料与仪器
淋巴细胞分离液Ficoll购自Sigma;Trizol购自Invitrogen;PCR试剂购自TaKaRa;PCR引物由英潍捷基(上海)贸易有限公司合成;Roche NimbleGen全基因组表达谱芯片(Homo sapiens 12×135K Array)由上海康成生物有限公司提供。Roche LightCycler 480实时荧光定量PCR仪。
2 研究对象
选取2011年11月至2012年4月在中山大学附属孙逸仙纪念医院儿科综合区住院的哮喘患儿5例为病例组(A组),其中男3例,女2例,中位年龄3.17(1.96~3.96)岁。病例组患儿需符合以下全部入组标准:(1)年龄<14周岁;(2)符合2008年《儿童支气管哮喘诊断及防治指南(修订版)》中的哮喘诊断标准;(3)血清总IgE高于同年龄组正常范围;(4)皮肤点刺实验阳性。由于入组患儿年龄均较小,故未行肺功能检测及支气管激发实验。
选取同期小儿外科病区待行包皮环切术、腹部疝修复术等住院患儿5例为对照组(简称N组),其中男3 例,女2 例,中位年龄 2.80(1.90 ~3.52)岁。需要符合以下全部入组标准:(1)年龄<14周岁;(2)无过敏性疾病病史及症状(包括喘息、变应性鼻炎、特应性皮炎等);(3)血清总IgE在同年龄组正常范围内;(4)无哮喘家族史。
排除标准包括:(1)年龄≥14周岁;(2)发热(腋下体温>37.4℃);(3)C反应蛋白(C-reactive protein,CRP)>5 g/L和(或)降钙素原(procalcitonin,PCT)阳性;(4)既往30 d内使用过任何制剂的糖皮质激素药物;(5)任何急性感染或其它主要疾病。
2组儿童在年龄分布和性别构成上无明显差异(P>0.05)。本研究获得中山大学孙逸仙纪念医院伦理委员会批准,严格遵循伦理学标准,并征得全部患儿或父母的知情同意。
3 方法
3.1 标本采集 所有研究对象入院后,于治疗前分别采集外周静脉血4~5 mL,肝素钠抗凝,存于4℃冰箱。4 h内分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。
3.2 PBMC分离、储存 等量PBS稀释血标本,然后按稀释血∶Ficoll=1∶2,在Ficoll液面上加入稀释血标本,20℃、2 000 r/min离心30 min。吸取单核细胞层到新离心管,加等量PBS重悬混匀,20℃ 1 200 r/min离心10 min。弃上清,2~3 mL PBS重悬混匀后进行细胞计数。余下的细胞悬液,20℃、800 r/min离心8 min,弃上清,每106个细胞加1 mL Trizol,存于 -80 ℃。
3.3 总RNA的提取及质检 取出Trizol冻存的细胞,解融后室温静置5min,每1 mL Trizol加入0.2 mL氯仿,剧烈振荡15 s,室温静置5 min。4℃、12 000 r/min离心15min,取上层无色水,加入等体积异丙醇,混匀后室温静置10 min。4℃、12 000 r/min离心10 min,弃上清,加1 mL 75%乙醇洗涤,4℃、12 000 r/min离心5 min,弃上清。静置干燥后,加入20~30μL DEPC水。提取的RNA样本均进行紫外分光光度计浓度测定及琼脂糖凝胶电泳检测完整性。
3.4 cDNA探针的合成和标记、芯片的杂交、洗涤、扫描 本研究选用Roche NimbleGen全基因组表达谱芯片,芯片实验由上海康成生物有限公司完成。
3.5 基因芯片实验结果的荧光定量PCR(qRTPCR)验证 为验证芯片结果的可靠性,在10例RNA 样本中,针对 ADAM33、TNFSF14、Smad7、TNFSF13等4个基因和看家基因GAPDH,进行qRTPCR验证,引物序列见表1。取上述提取的RNA 500 ng,逆转录合成 cDNA。取 cDNA 2μL,每个样本3个复孔,终体积20μL,使用Quant SYBR Green PCR kit进行qRT-PCR。PCR反应条件:(1)预变性95℃ 30 s,20℃/s 1个循环;(2)PCR反应95℃ 5 s,20℃/s;65℃ 30 s,20℃/s 40个循环;(3)熔解曲线分析95℃ 0 s,20℃/s,1个循环;65 ℃ 15 s,20℃/s;95 ℃ 0 s,0.1 ℃ /s。以 GADPH 为内参照,用ΔCt法比较各样品基因的表达水平,绘制扩增曲线和熔解曲线,对照组基因表达量设为1,计算各样品基因相对表达量。

表1 引物序列Table 1.Sequences of the primers
3.6 生物学信息分析 芯片所有探针信号经均一化处理后,计算基因表达差异倍数。判断基因表达差异应同时符合以下标准:(1)P≤0.05;(2)基因表达差异变化≥2倍,即≥2为上调基因,≤0.5为下调基因。利用 GenePix Pro 6.0、NimbleScan 2.6、Agilent GeneSpring GX 11.5.1、MultiExperiment Viewer 4.8.1、DAVID Bioinformatics Resources 6.7(http://david.abcc.ncifcrf.gov/)等进行图形及数据分析。
4 统计学处理
非正态分布的计量资料以中位数和四分位数间距表示,计数资料用百分率或比表示;符合正态分布的两组均数比较采用独立样本t检验。数据采用SPSS 18.0统计软件分析。以P<0.05为差异有统计学意义。
结 果
1 病例资料特点
病例组及对照组病例资料特点见表2。

表2 病例资料特点Table 2.Characteristics of the cases
2 RNA质控
紫外分光光度计浓度测定结果显示,所有RNA样本的A260/A280比值在1.8~2.2之间,无 DNA或蛋白质残留,纯度较高。琼脂糖凝胶电泳检测显示,各标本的电泳图28S、18S和5S条带清晰明亮,无拖尾或弥散,且28S的亮度约为18S的2倍,说明RNA无降解,完整性较好,见图1。
3 芯片杂交结果
芯片扫描结果显示芯片信号强度均一、清晰,背景值均匀,结果可靠。绘制各组信号值的散点分布图,大部分基因位于Fold Change Lines以内,其差异无统计学意义。少数偏离Fold Change Lines,则为差异表达基因,见图2。
4 芯片数据筛选及层次聚类分析
按照设定的差异表达基因筛选标准,对两组样本进行非配对t检验,筛选出差异表达基因795个,其中未命名的基因37个,功能未明确的基因132个。已命名的758个基因中,上调基因345个,下调基因413个。已明确功能的626个基因中,上调241个,下调385个。基于全部795个差异表达基因的层次聚类分析结果提示,10例样本被聚为两大类,与病例组和对照组的区分一致,见图3。
已命名的758个差异表达基因中检索到40个基因与哮喘、气道炎症或气道重构有关,其中29个基因的变化趋势与文献报道一致,包括14个上调基因和15个下调基因。针对这29个相关基因(共31个转录本)进行层次聚类分析,10例样本被聚为两大类,与病例组、对照组的区分完全一致。31个基因转录本被划分为两大类,与上调、下调的区分完全一致。上调基因被聚为4类,下调基因则聚为5类,见图 4、表 3。

Figure 1.The integrity of RNA tested by denaturing agarose gel electrophoresis.1 ~5:group N;6 ~10:group A.图1 变性琼脂糖凝胶电泳验证RNA完整性

Figure 2.Scatter plot of gene expression.Genes above the top green line and below the bottom green line indicated more than 2-fold change of genes between group N and group A.图2 基因表达散点图

Figure 3.Excerpts of the hierarchical cluster analysis based on 795 differentially expressed genes.图3 基于795个差异表达基因的层次聚类分析图(节选)
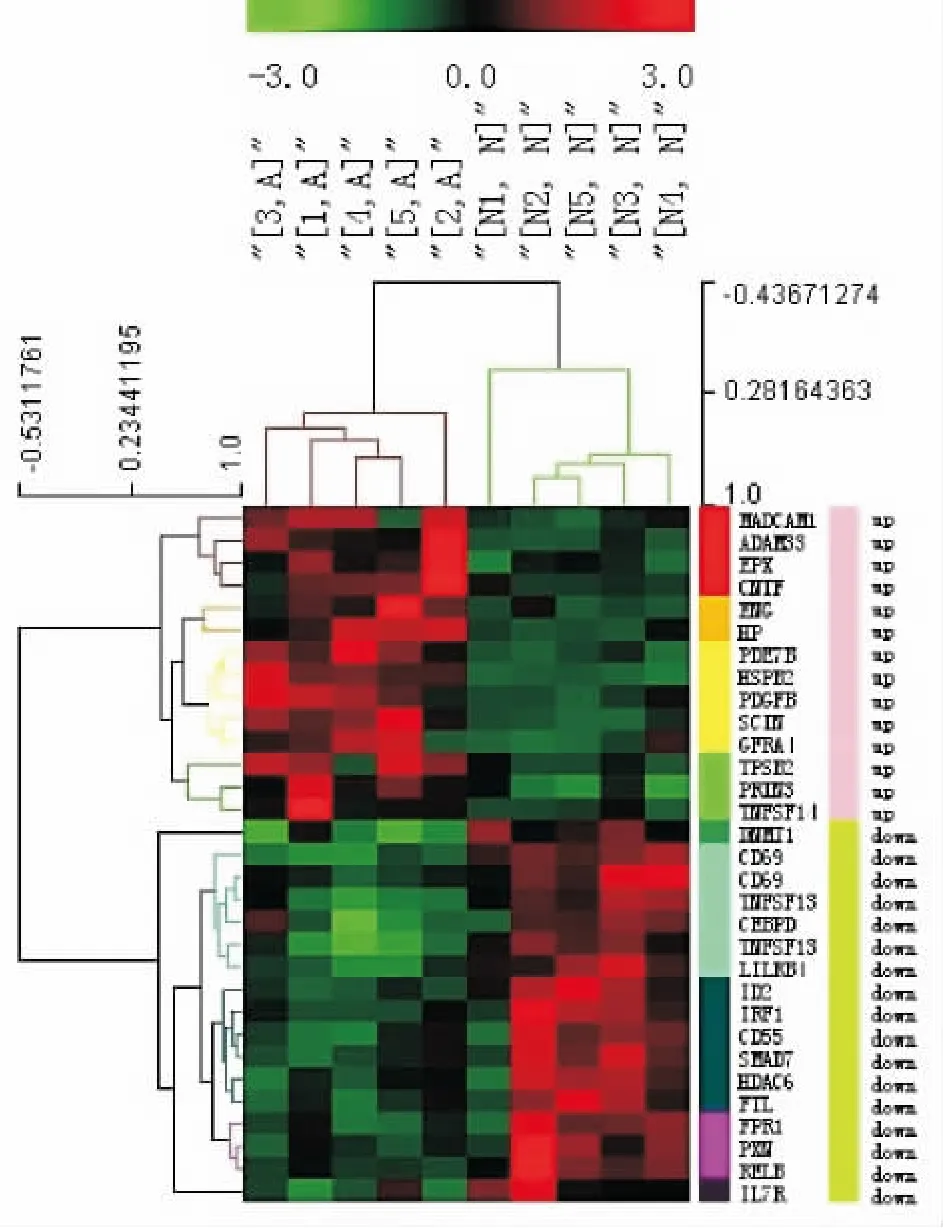
Figure 4.Hierarchical cluster analysis based on 29 differentially expressed asthma-related genes(31 transcripts).图4 基于29个哮喘相关差异表达基因(31个转录本)的层次聚类分析图
5 Gene Ontology功能分类分析
利用 DAVID Bioinformatics Resources 6.7,从758个已命名的基因中可得到614个基因注释,含上调基因237个,下调基因377个。其余144个基因主要为功能未明确的基因或相同基因的不同转录本。针对这614个基因进行Gene Ontology功能分类分析,我们发现在生物学过程(biological process)方面,这些差异表达基因主要与免疫反应、对外部刺激的反应、信号转导及分子功能的负性调节、细胞死亡、凋亡及其调节等有关,见表4。在细胞成分方面,差异基因主要与血小板α颗粒、囊泡腔、细胞外间隙、细胞膜表面等有关。在分子功能方面,主要与蛋白水解酶活性、蛋白结合、激酶活性、转录抑制物活性、催化活性等密切相关。
6 基因芯片结果的qRT-PCR验证
选取了Smad7、肿瘤坏死因子配体超家族成员13(tumor necrosis factor ligand superfamily member 13,TNFSF13)、解整合素样金属蛋白酶33(a disintegrin and metalloproteinase domain 33,ADAM33)和肿瘤坏死因子配体超家族成员14(tumor necrosis factor ligand superfamily member 14,TNFSF14)共4个基因,分别以GADPH为对照,针对两组共10例样本进行qRT-PCR检测。Smad7和TNFSF13在实验组表达下调,在对照组高表达;ADAM33和TNFSF14在实验组表达上调,在对照组低表达,见图5。上述qRT-PCR结果与芯片结果一致,提示基因芯片结果可靠。

表3 29个哮喘相关基因(31个转录本)的潜在基因功能Table 3.Potential functions of 29 asthma-related genes(31 transcripts)
讨 论
哮喘是由多种细胞及细胞组分参与的气道慢性炎症疾病。其发生机制复杂,大量流行病学及分子遗传学证据已表明,哮喘是由环境和遗传因素相互作用而形成的多基因遗传病,不少基因[2]或基因多态性[3-4]已证实在哮喘发病中发挥重要作用。全基因组表达谱芯片作为一种高通量、快速、平行的基因表达信息分析技术,能高效获取海量信息,适合大规模基因表达谱的分析,已用于多种疾病的相关基因筛选[5-7]。
近年来,学者们把芯片技术应用于小鼠[8]、马[9]或灵长类动物[10]的哮喘模型,或在临床研究中采用鼻黏膜细胞[11]、诱导痰[12]、纤支镜获取成人呼吸道上皮细胞[13]作为样本,筛选出与哮喘关系密切的差异基因。但上述临床研究主要针对成人哮喘患者,活检获取样本费用高、不适于儿童患者,而且取材部位各异,对实验结果干扰较大。而外周血细胞存在独特的基因表达谱型,能反映人体组织稳定的(遗传)和动态的(环境和疾病影响)变化[14]。目前公认哮喘是一种全身性疾病,哮喘患者的外周血淋巴细胞呈现高活性、高基因表达变化的特点。因此,本研究利用芯片技术分析外周血单个核细胞的基因变化,所选用的Roche NimbleGen全基因组表达谱芯片,含有45 033个基因,平均每个基因设计了3个长寡核苷酸探针,具有更可靠的统计学意义。层次聚类分析结果也显示,10个样本被划分为两类,与哮喘患儿及对照组儿童的分组完全一致;差异基因也被区分为两大类,与上调、下调的区分也完全一致,均说明了芯片筛选外周血单个核细胞所得到的差异表达数据灵敏、可信,对后续深入研究有较高参考意义。

表4 差异基因的生物学过程分类Table 4.The biological process classification of differential genes

Figure 5.Expression of 4 differentially expressed genes verified by qRT-PCR.Mean ± SD.n=5.*P < 0.05 vs group N.图5 qRT-PCR验证芯片结果
本研究针对29个哮喘、炎症、气道重构等相关基因进行层次聚类分析,上调基因被聚为4类,下调基因则归为5类。同时Gene Ontology功能分类结果显示,在生物学过程方面,差异表达基因主要与免疫反应、对外部刺激的反应、信号转导及分子功能的负性调节、细胞死亡、凋亡及其调节等有关。层次聚类中被归为同一类的基因具有相似的表达变化模式,因此以同类基因已知功能为出发点,可为功能尚未完全阐明的基因提供线索和思路,从而明确这些基因在哮喘中发挥的作用。
Smad家族是直接参与TGF-β信号转导的蛋白,其家族成员功能复杂,既促进Th17和Th9相关的免疫反应,也通过抑制Th1、Th2、B细胞和CTLs分化或促进Treg细胞功能来抑制机体免疫反应,还通过调节细胞外基质来参与气道重构。Smad7是位于胞内的I-Smad抑制型蛋白,可被TGF-β家族激活,并负向调控TGF-β信号转导,但具体机制及其在哮喘中发挥的作用尚未完全阐明。Luo等[15]通过过表达上皮细胞的Smad7,特异性阻断TGF-β信号,从而缓解哮喘症状。Crosby 等[16]和 Willis等[17]发现 Smad7可抑制TGF-β1,通过阻断上皮细胞间质转型(EMT)来逆转气道重构。Shi等[18]则发现哮喘患者气道上皮的Smad7水平与基底膜厚度及气道高反应性呈负相关。本研究的数据也显示,Smad7在实验组明显下降,提示Smad7很可能是哮喘的易感基因,有必要深入探讨TGF-β/Smad信号通路的机制,提高患儿的Smad7水平有望成为哮喘防治的有效策略。
TNFSF13(又名APRIL)是TNF超家族成员,参与B细胞的发育、类别转换、IgE的产生以及T细胞活化、增殖。针对TNFSF13在哮喘中的作用,研究结果不一。Moon 等[19]和 Bilsborough 等[20]发现抑制TNFSF13可减轻气道炎症及高反应性,并改善肺功能及减少糖皮质激素用量。然而,Xiao等[21]发现TNFSF13缺陷小鼠在哮喘诱导过程中表现为强烈炎症反应。BAFF则是TNF超家族中另一成员,其结构、分布、受体及生物学功能均与TNFSF13高度类似。Sutherland等[22]研究发现 BAFF能抑制 Th2介导的气道炎症,间接提示TNFSF13很可能具有类似作用。而在本研究的数据分析中,哮喘患儿外周血TNFSF13比对照组儿童下调2.71倍。虽然 TNFSF13在哮喘中的作用尚存争议,但其对机体免疫功能的显著影响提示TNFSF13与哮喘发病密切相关,很可能成为哮喘的治疗靶点。
ADAM33是与细胞增殖、分化、黏附、信号转导及凋亡相关的跨膜蛋白,主要分布在气道平滑肌及肺成纤维细胞,与气道重构、气道高反应性及IgE水平相关。Lee等[23]发现成年哮喘患者肺泡灌洗液中ADAM33水平与肺功能呈负相关。Foley等[24]发现中重度哮喘患者的支气管活检样本中ADAM33明显高于轻度哮喘及正常人群。Jie等[25]的数据表明在肺成纤维细胞中ADAM33受Th2的正向调控,并在小鼠哮喘模型中表现为明显的上皮下胶原沉积及气道缩窄。本研究芯片数据也显示,ADAM33在哮喘患儿组显著升高2.6倍。ADAM33作为哮喘的易感基因,其致病机制及调控网络并未阐明。深入研究ADAM33,对于改善难治性哮喘或反复哮喘所致气道重构有深远意义。
TNFSF14(又称LIGHT)是TNF家族配体,其受体为LTβR和 HVEM。Hastie等[26]的数据显示242例不同程度哮喘患者痰样本中的TNFSF14与肺功能呈负相关。Doherty等[27]认为TNFSF14是通过结合LTβR上调 TGF-β 水平,或结合 HVEM 上调 IL-13,从而导致气道重构。TNFSF14结合HVEM后还可刺激血管平滑肌细胞的增殖,TNFSF14-LTβR也能上调α-平滑肌肌动蛋白增殖,平滑肌细胞的畸形生长能导致肺功能下降,与重症或难治性哮喘有关。本研究发现TNFSF14在实验组明显上调。因此有必要进一步研究TNFSF14的致病机制,阻断TNFSF14与LTβR或HVEM的结合很可能成为改善气道纤维化、逆转气道重构的可行策略。
哮喘发病机制复杂,具体机制尚未完全阐明。本研究利用全基因组表达谱芯片,分析哮喘患儿与对照组儿童的外周血单个核细胞的特征性基因改变,并初步筛选出与哮喘、气道炎症、气道重构等有关的差异基因,但筛选适合作为临床哮喘防治靶点的基因有待进一步的数据挖掘和分析。
