衰老过程中线粒体顺乌头酸酶活性变化对能量合成的影响*
2013-12-01陈赛慧郝东杰曹建明吕建新
叶 薇, 陈赛慧, 郝东杰, 郑 屹, 曹建明, 吕建新△
(温州医学院 1检验医学与生命科学学院,2环境与公共卫生学院,浙江温州325035)
线粒体不仅是真核细胞能量合成和活性氧(reactive oxygen species,ROS)产生的主要场所,线粒体内DNA、蛋白质和脂质更易成为ROS作用的位点。ROS累积影响电子传递链复合体的活性,进而造成线粒体损伤[1-3]。目前研究发现,在衰老相关的疾病中,细胞ROS生成过多可引起线粒体能量代谢障碍,从而导致一些神经退行性疾病的发生或恶化。
线粒体中含有大量的铁硫蛋白,其中的铁硫簇被认为是细胞内ROS敏感的作用位点之一。线粒体顺乌头酸酶(mitochondrial aconitase,ACO2)是催化三羧酸循环的酶,催化柠檬酸经过顺乌头酸最终转化为异柠檬酸,是活细胞中心代谢途径中不可缺少的酶。ACO2是衰老过程中氧化损伤的主要靶标之一[4-5]。该酶是一个四结构域铁硫蛋白,在第3结构域内的铁硫簇([4Fe-4S]2+)是酶促反应的催化中心,[4Fe-4S]2+容易受到ROS的氧化作用失去Fe2+而形成[3Fe-4S]+,从而导致该酶失活[6-7]。铁硫簇的破坏不仅使酶失活,影响三羧酸循环,其释放的游离铁可能会进一步通过Fenton反应产生有害的氧自由基,加重细胞的氧化压力,引起线粒体中DNA及更多蛋白的氧化损伤。为进一步验证ACO2活性在衰老过程中是否由于ROS累积而下降,及其潜在的对于能量合成的影响,我们以SD大鼠和D-半乳糖(D-galactose,DGal)诱导细胞衰老为模型,观察自然衰老大鼠和细胞衰老模型的ACO2在活性及表达水平的变化,并分析线粒体膜电位及能量合成的水平,以了解在衰老过程中该酶的变化对于能量合成的影响。
材料和方法
1 动物和细胞
选用月龄为1月、8月、16月和24月SD雄性大鼠为实验动物,合格证编号为 SCXK(浙)2010-0044,由温州医学院实验动物中心提供。动物饲养符合国家清洁级环境,分笼饲养,每笼不超过5只,自由饮食,在自然条件下衰老。细胞选用MRC-5人胚肺成纤维细胞。
2 主要试剂
过氧化氢酶(catalase)、烟酰胺腺嘌呤二核苷磷酸(nicotinamide-adenine dinucleotide phosphate,NADP)、顺乌头酸(cis-aconitic acid)、吩嗪硫酸甲酯(phenazine methosulfate)、异柠檬酸脱氢酶(isocitrate dehydrogenase)、ATP、ADP和 AMP(HPLC 级别)均购自Sigma;BCA蛋白质定量试剂盒、SDS-PAGE凝胶配制试剂盒、JC-1线粒体膜电位检测试剂盒、辣根酶标记山羊抗兔IgG(H+L)、辣根酶标记山羊抗鼠IgG(H+L)和细胞色素C氧化酶Ⅳ亚基(cytochrome C oxidease subunitⅣ,COXⅣ)抗体均购自碧云天生物技术研究所;线粒体顺乌头酸酶Ⅰ抗购自Abcam;逆转录试剂盒和荧光定量PCR试剂盒均购自宝生物工程(大连)有限公司;Trizol和DEPC水购自Invitrogen。所用引物由宝生物工程(大连)有限公司设计合成,见表1。

表1 引物序列Table 1.Sequences of the primers
3 主要方法
3.1 细胞培养 用含10%胎牛血清、1%青霉素-链霉素溶液(100×)的高糖(25 mmol/L)DMEM培养液接种MRC-5人胚肺成纤维细胞,37℃、95%空气、5%CO2培养箱中培养,待细胞增殖并长满培养瓶表面后,胰蛋白酶37℃消化1 min左右,轻轻吹打使团状细胞分散,以需要的密度传代细胞。D-Gal处理细胞:24 h细胞帖壁后,换用含55 mmol/L D-Gal的DMEM培养72 h。
3.2 线粒体的分离 线粒体提取方法参照文献[8]的蔗糖密度梯度离心法,并对该方法进行了改进。
3.3 ACO2活性的检测 以柠檬酸钠为底物,偶联NADP+-异柠檬酸脱氢酶反应,通过340 nm处吸光度测定该反应过程中NADPH生成的量间接表示顺乌头酸酶活性的大小。酶活性定义为:每毫克蛋白每分钟所增加的吸光度。具体方法如下:取大鼠脑组织线粒体,裂解得线粒体蛋白,100μg线粒体沉淀加线粒体裂解液。充分混匀,冰上裂解30 min,15 000×g、4℃ 离心5 min。96孔板每孔加200μL酶反应底物,再加入离心后上清10μL,混匀,用酶标仪检测340 nm处吸光度。温度设定为37℃,每分钟测1次,共测20 min。蛋白浓度用碧云天BCA蛋白检测试剂盒检测。
体外氧化应激实验:(1)不同浓度 H2O2对酶活性的影响:1月龄大鼠所提取线粒体,用H Buffer悬浮后均等分到5个离心管中,12 000×g、4℃离心5 min,沉淀分别加 0 μmol/L、50 μmol/L、100 μmol/L、200μmol/L和400μmol/L H2O2200μL,充分混匀,冰上孵育30 min;(2)不同时间H2O2处理对酶活性的影响:1月龄大鼠所提取线粒体,用H Buffer悬浮后均等分到4个离心管中,12 000×g、4℃离心5 min,所得沉淀加50μmol/L的 H2O2200μL,充分混匀,分别处理0 min、30 min、1 h和2 h。经上述处理后,14 000 ×g、4 ℃离心 5 min。去除上清 H2O2,再加裂解液,离心取上清,测酶活性,方法同上。
3.4 ACO2蛋白表达量测定 分离线粒体,裂解后得到线粒体蛋白。用BCA法检测蛋白浓度,按1∶4体积比加loading buffer,95℃加热5 min使蛋白变性。制备12%分离胶,蛋白上样量为60μg,marker上样量为5μL。70 V电压,电泳30 min,然后用120 V,电泳1 h。转膜1.5 h,剪取蛋白条带,用5%脱脂奶粉TBST室温封闭2 h。4℃ Ⅰ抗孵育过夜,用TBST洗膜5 min,重复4次,室温孵育Ⅱ抗1 h,用TBST洗膜10 min,重复4次。以线粒体蛋白COXⅣ为内参照。
3.5 荧光定量PCR检测ACO2 mRNA表达水平采用Trizol抽提法提取脑组织和细胞总RNA,RNA浓度测定使用NanoDrop 2000超微量分光光度计(Thermo)。用逆转录试剂盒(TaKaRa PrimeScript®RT reagent Kit with gDNA Eraser)逆转录得到cDNA。Taqman实时荧光定量PCR检测ACO2 mRNA水平,以β-actin为内参照。按照TaKaRa说明书配制反应体系,扩增条件为:95℃变性30 s,95℃ 15 s,50℃10 s,72 ℃ 20 s,45 个循环。
3.6 大鼠脑组织总铁含量的测定 取大鼠大脑组织,加入5 mmol/L Tris-HCl(pH 7.4),1 mg组织加1 mL。用匀浆器充分匀浆,超声破碎,所得匀浆液加入等体积1.5 mmol/L HCl,85℃加热30 min;2 000×g室温离心10 min,将上清转移至新的离心管,加1/5体积的40%三氯乙酸,85℃加热15 min,12 000×g离心10 min取上清,加入10倍体积1.0 mmol/L菲咯嗪试剂(1.0 mol/L醋酸钠配制)充分反应,取220 μL上一步混合液于96孔板中,562 nm测吸光度。根据标准曲线计算铁含量。
3.7 细胞氧化还原状态分析 细胞SOD活性和MDA含量根据试剂盒(南京建成)提供的方法进行检测。细胞ROS水平检测:MRC-5细胞按2.5×108/L接种至6孔板,24 h细胞贴壁后将其分为对照组和D-gal处理组,分别按处理条件培养细胞72 h。按照1∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10μmol/L。去除细胞培养液,加入适当体积稀释好的DCFH-DA,6孔板的每个孔不少于1 mL。置37℃孵育20 min。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。488 nm激发波长、525 nm发射波长检测DCF的荧光。
3.8 JC-1检测线粒体膜电位 分离大鼠脑组织线粒体,用1 mL PBS溶解提纯的线粒体,取其中200 μL移入到1.5 mL的离心管内,加PBS至1.5 mL混匀后离心;取沉淀加入1.25 mL staining mixture,避光,37℃孵育3 min。去除 staining mixture,用1×staining solution洗涤液洗3次,用1 mL PBS重悬。准备酶标条,每孔加200μL上一步的悬液,平行设置5个孔。利用Varioskan Flash酶标仪(Thermo Scientific)测定590 nm和530 nm的荧光强度,两者比值反映线粒体膜电位。
MRC-5细胞按2.5×108/L接种至6孔板,24 h细胞贴壁后将其分为对照组和衰老组(D-Gal处理组)。培养72 h后按6孔板每孔1 mL的量加入JC-1染色工作液,颠倒数次混匀;细胞培养箱中37℃孵育30 min。用1×JC-1染色缓冲液洗涤细胞2~3次,激光共聚焦显微镜下观察并成像。
3.9 高效液相色谱检测ATP、ADP和AMP含量高效液相系统包括Agilent 1100高效液相色谱仪和C18反相高效色谱柱(4.6 mm×250 mm,5μm,pH 2~8)。流动相为15 mmol/L磷酸二氢钾和10%甲醇,流速0.8 mL/min,检测波长为254 nm,检测温度为25℃。所有标准品和样品在进样前均用0.22μm孔径滤器过滤,以防堵塞仪器管道。(1)标准品配制:称取ATP、ADP和AMP标准品各5 mg,用10 mL pH 9.0的磷酸盐缓冲液溶解于15 mL离心管,避光保存。用时取50μL标准品液,加超纯水950μL(稀释20 倍),再依次稀释成2、4、8、10、15 和 20 倍来制备标准曲线。(2)样品前处理:用在液氮罐中预冷的刀片切取大鼠脑组织大脑皮层约100 mg并称重,按每100 mg样品量加入1 000μL高氯酸溶液 (0.3 mmol/L),在冰上充分匀浆,取全部匀浆液于4℃、10 000 r/min离心10 min,取出上清液400μL,加0.5 mmol/L氢氧化钾200μL(终溶液 pH 7.6~7.8),于4℃、10 000 r/min离心5 min,取上清。(3)结果计算:以保留时间定性,色谱峰面积定量。ATP、ADP和AMP的计算公式为:X=C×K[X:ATP、ADP和m AMP的含量(mg/g组织净重);C:从标准曲线上查出的ATP、ADP和 AMP的量(μg);m:样品的质量(mg);K:样品组织匀浆稀释倍数]。能荷(energy charge,EC)计算公式为:)/(ATP+ADP+AMP)。
4 统计学处理
采用GraphPad Prism统计软件进行数据分析并作图,计量资料采用One-way ANOVA或独立样本t检验数据分析,数据以均数±标准差(mean±SD)表示,以P<0.05为差异有统计学意义。
结 果
1 ACO2活性和表达水平
1.1 自然衰老大鼠和衰老细胞ACO2活性的变化图1A显示随着大鼠月龄的增长,ACO2表现出很明显活性递减(P<0.01)。与1月龄相比,8月龄的酶活性下降了13.8%,16月龄下降了42%,24月龄的老龄鼠则下降了84.8%。而在衰老细胞中ACO2活性较对照组细胞降低(P<0.01),见图1B。
1.2 体外氧化应激下ACO2活性分析 以纯水处理为空白对照,H2O2处理后ACO2活性随H2O2浓度增加而降低(P<0.01),见图1C。用高浓度(400 μmol/L)H2O2处理时,酶活性下降尤为显著,酶活性下降了93.5%,若再提高H2O2的浓度,则导致酶完全失活。用50μmol/L H2O2处理所提取的线粒体,随着处理时间的延长,酶活性逐渐下降(P<0.01),见图1D。这些结果提示ACO2对氧化应激(H2O2)具有敏感性。

Figure 1.The results of ACO2 activity assay.A:ACO2 activity presented age-related decline;B:ACO2 activity in control and D-Galtreated cells;C:ACO2 activity presented dose-related decline with different H2 O2 concentrations;D:ACO2 activity present time-related decline with different H2O2 incubation time.Mean±SD.n=8.**P <0.01 vs 1 month;○○P <0.01 vs control;▲▲P<0.01 vs 0 μmol/L;△△P <0.01 vs 0 h.图1 ACO2活性检测结果
1.3 ACO2 mRNA和蛋白表达水平分析 荧光定量PCR和Western blotting的结果(图2A、B)均显示各月龄的大鼠ACO2 mRNA和蛋白表达水平没有明显差别(P>0.05);在细胞衰老模型中,在正常和衰老细胞ACO2 mRNA和蛋白表达水平均无明显差异,见图2C、D。

Figure 2.The mRNA(A,C)and protein(B,D)expression levels of ACO2 detected by fluorescence quantitative PCR and Western blotting,respectively.A,B:ACO2 expression in brain tissues from the rats at different ages;C,D:ACO2 expression in control and D-Gal-treated MRC-5 cells.Cytochrome C oxidase subunitⅣ(COXⅣ)served as mitochondrial loading control.Mean±SD.n=8.图2 ACO2表达水平的比较
2 大鼠脑组织非血红素铁含量测定
大鼠脑组织非血红素铁含量随着年龄增长逐渐增加。与1月龄大鼠相比,8月龄、16月龄和24月龄的大鼠脑非血红素铁的含量分别增加了14.7%、22.4%和38.5%,见图3。

Figure 3. Free iron content of whole rat brain at different months.Mean±SD.n=8.**P <0.01 vs 1 month.图3 不同月龄大鼠全脑铁含量的比较
3 衰老细胞氧化还原状态分析
D-Gal诱导的衰老细胞较对照组细胞SOD活性降低,且MDA含量显著增加(P<0.01),见表2。

表2 D-Gal诱导的MRC-5细胞与对照组细胞SOD活性及MDA含量的比较Table 2.Assessment of SODactivity and MDA content in D-Galtreated cells(Mean±SD.n=8)
4 线粒体膜电位检测结果比较
比较老龄鼠(21~25月龄大鼠)与2月龄大鼠的线粒体膜电位,结果显示老龄鼠的线粒体膜电位明显下降(P<0.05),见图4A。在细胞模型中,对照组细胞红色荧光强度高于D-Gal诱导的衰老细胞,而衰老细胞的绿色荧光强度高于对照组细胞,提示衰老细胞线粒体膜电位下降,见图4B。

Figure 4.Mitochondrial membrane potential in brain tissues from the rats at different ages(A)and in D-Gal-treated MRC-5 cells(B).Mitochondrial membrane potential was measured by JC-1 staining under laser scanning confocal microscope(×200).JC-1 monomer is green fluorescence(530 nm),and J-aggregate is red fluorescence(590 nm).Mean±SD.n=8.*P<0.05 vs 2 months.图4 线粒体膜电位的比较
5 HPLC检测大鼠脑组织ATP、ADP和 AMP含量及其能荷比较
对各月龄大鼠脑组织的ATP、ADP和AMP含量进行高效液相色谱分析。所得标准曲线回归方程分别为,ATP:y=1.7428x+0.967(R2=0.9996);ADP:y=1.3151x+7.2975(R2=0.9995);AMP:y=2.6214x+13.820(R2=0.9991)。经标准曲线计算得3种腺苷酸在脑组织中的含量见表3。ATP随月龄增加而下降,1月龄和8月龄大鼠脑组织ATP比较下降不明显(P>0.05),24月龄大鼠与1月龄相比,其含量降低了约42%。ADP随月龄增加有所升高,其升高幅度没有AMP大,与1月龄相比,24月龄大鼠的ADP含量约上升了39%,而AMP的含量升高了117%。各月龄的能荷呈逐渐降低的趋势,差异显著(P<0.01),见图5A。细胞衰老模型的结果显示衰老细胞的ATP含量和能荷较对照组显著降低(P<0.05),见表 4、图 5B,AMP 含量升高(P <0.05),ADP含量无明显差别。

Figure 5.Energy charge in brain tissues from the rats at different ages(A)and in D-Gal-treated MRC-5 cells(B).Mean±SD.n=8.**P <0.01 vs1 month;△△P <0.01 vs control.图5 不同月龄大鼠脑组织和D-Gal诱导的MRC-5细胞能荷的测定

表3 不同月龄大鼠ATP、ADP和AMP含量的比较Table 3.ATP,ADP and AMP content in brain tissues from the rats at different ages(mg/g.Mean±SD.n=8)
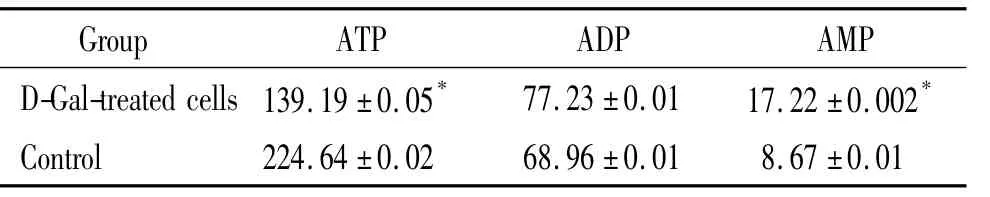
表4 D-gal诱导的MRC-5细胞ATP、AMP和AMP含量的比较Table 4.The content of ATP,ADP and AMP in D-Gal-treated MRC-5 cells(μg/g.Mean±SD.n=8)
讨 论
线粒体不仅是细胞能量代谢的中心和机体产生ROS的主要场所,还是ROS攻击的目标,因此线粒体功能的退化成为细胞衰老的核心事件。线粒体功能障碍主要表现为ATP合成下降、ROS增加、Ca2+代谢紊乱和细胞凋亡[9],其中氧化应激是引起线粒体功能损伤的主要原因[10]。ACO2是氧化应激敏感的酶,是参与三羧酸循环所有酶中表现出最明显的增龄性活性下降的酶[5,12-13],而其活性下降可能与细胞内氧化水平升高有关。以往对小鼠肾脏和骨骼肌的研究中[5,12],发现线粒体三羧酸循环的所有酶中仅α-酮戊二酸脱氢酶和ACO2的活性随增龄下降,其中ACO2活性下降更为明显。将家蝇的ACO2和柠檬酸合成酶活性进行比较,结果显示随生长时间增加ACO2的活性呈现明显的下降趋势,柠檬酸合成酶活性无明显改变[13]。
本研究结果显示,大鼠脑组织ACO2的活性表现出增龄性递减,与1月龄大鼠相比,8月龄的酶活性下降了13.8%,16月龄下降了42%,24月龄的老龄鼠则下降了84.8%。利用H2O2模拟体内氧化应激状态,结果显示ACO2活性随着H2O2处理浓度和时间的增加而呈现明显的下降趋势,提示ACO2对氧化应激反应的高度敏感。而在对不同月龄大鼠ACO2的mRNA和蛋白水平分析结果显示,各月龄大鼠ACO2表达水平无明显差异。通过对不同月龄大鼠ACO2活性比较和体外氧化应激下ACO2活性分析,结合ACO2的表达水平变化,可以认为无论在体内还是体外,氧化应激均使ACO2活性下降,其内在原因是ROS攻击ACO2活性中心的[4Fe-4S]2+,使其失去一个Fe2+而成为[3Fe-4S]+,导致ACO2活性下降,即ACO2活性下降是由于蛋白结构域受影响,而非基因表达下调所致。因此在衰老过程中,由于ROS的不断累积导致ACO2活性逐渐下降,而表达水平不变。
线粒体在含铁蛋白的生物合成和铁平衡中起着重要的作用。以往研究发现衰老细胞内出现铁累积现象。本研究对不同月龄大鼠脑组织的非血红素铁含量进行测定,发现衰老大鼠的脑铁含量高于年轻大鼠,这表明衰老过程中伴随着铁的积累。尽管目前衰老与细胞铁代谢的相关性尚不明确,且ACO2仅为众多铁硫蛋白之一,而在衰老细胞中ACO2被过多的ROS攻击后释放出的Fe2+可能也是导致细胞铁增加的原因之一。而过多的游离Fe2+通过Feton反应产生更多的超氧阴离子,加重细胞氧化应激水平。
本研究用高效液相色谱法检测不同月龄大鼠脑组织ATP、ADP和AMP的结果显示,能荷随月龄增加而减小。对膜电位的研究结果显示,衰老大鼠线粒体膜电位下降。线粒体的主要功能体现在线粒体能量合成方面。在三羧酸循环中,ACO2催化柠檬酸转变为异柠檬酸,而ACO2活性下降可能导致三羧酸循环的效率下降,同时引起还原当量(NADH)减少,线粒体膜电位下降。线粒体膜电位对电子传递链的顺利进行是至关重要的,线粒体膜电位下降反映了线粒体膜两端的电势差和氧化磷酸化效率的降低,最终造成线粒体的能量合成下降。
此外我们利用D-Gal诱导细胞衰老,发现在衰老细胞中ACO2活性、膜电位和能量合成水平明显下降,一方面是由于D-Gal代替葡萄糖后,细胞获取能量的主要途径从糖酵解转变为氧化磷酸化途径[14],然而高浓度的D-Gal导致电子传递链过量产生ROS,引起细胞氧化应激和呼吸功能受损,影响了ATP的合成效率,加重细胞氧化压力,最终导致细胞衰老。另一方面,过量的ROS攻击ACO2致其失活,引起三羧酸循环效率下降进而影响ATP的产率。所以,在细胞衰老过程中,随着ROS不断产生积累以及清除的减少,在对细胞线粒体功能产生影响的同时,更会加速衰老的进程。该细胞模型同时也验证了以上对于自然衰老过程中ACO2活性变化及其对能量合成影响的推测。
