左、右归丸及其拆方对骨髓间充质干细胞成骨分化的影响*
2013-12-01何文智王智民任艳玲
宋 囡, 何文智, 王智民, 任艳玲△
(辽宁中医药大学1基础医学院,2药学院,3第一临床学院,辽宁沈阳110032)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一种多潜能细胞,可分化为多种细胞,通过诱导其分化为成骨细胞后,促进骨形成,是骨组织工程中的重要部分[1]。传统中医学认为,肾藏精,精生髓,髓养骨,而BMSCs主要来自于骨髓中,与中医学“肾主骨”理论有相似之处[2-3]。左、右归丸为中医补肾经典方剂,分别具有滋补肾阴和温补肾阳之功,虽然既往有左、右归丸均能促进BMSCs成骨分化的研究[4-5],但未见到两方对BMSCs成骨诱导的比较研究。本文旨在通过观察左、右归丸及其拆方含药血清对BMSCs成骨分化的影响,探讨以“滋补肾阴”和“温补肾阳”立法的方药对BMSCs成骨分化的影响机制。
材料和方法
1 动物
SPF级SD大鼠70只,2月龄,体重(210±10)g,雌雄各半,购买于辽宁长生生物技术有限公司,许可证号为SCXK(辽)2010-0001,用于制备含药血清。提取和培养骨髓间充质干细胞采用上述同种雄性大鼠2只。
2 药物
中药饮片购买于辽宁中医药大学附属第一医院,左归丸(成分:熟地黄24 g、炒山药12 g、枸杞子12 g、山茱萸12 g、鹿角胶12g、菟丝子12 g、牛膝9 g、龟板胶12 g)、右归丸(成分:熟地黄24 g、炒山药12 g、枸杞子12 g、山茱萸12 g、鹿角胶12 g、菟丝子12 g、当归 9 g、肉桂 6 g、杜仲 9 g、附子 6 g)、共同药方(成分:熟地黄24 g、炒山药 12 g、枸杞子12 g、山茱萸12 g、鹿角胶12 g、菟丝子12 g)、滋阴药方(熟地黄24 g、炒山药 12 g、枸杞子 12 g、山茱萸 12 g、龟板胶12 g)和补阳药方(肉桂6 g、杜仲9 g、附子6 g、鹿角胶12 g、菟丝子12 g),以上5种药方自制成水煎剂,生药量为1 g·mL-1;戊酸雌二醇片(补佳乐;Delpharm Lille S.A.S,国药准字 J20080036)。
3 试剂与仪器
改良型α-MEM培养液和胎牛血清(fetal bovine serum,FBS)(HyClone);胰酶(Sigma);CD29抗体、CD45抗体、CD11b/c抗体和CD90抗体(Biolegend);Anti-CollagenⅠ抗体(博奥森);Anti-GAPDH抗体(中杉金桥);Anti-Cbfα1/Runx2抗体(Abcam);realtime RT-PCR试剂盒(TaKaRa);引物委托TaKaRa公司设计合成,Cbfα1上游引物5'-ATGACGGTAACCACAGTCCCATC-3',下游引物 5'-ATGACGGTAACCACAGTCCCATC-3',扩增长度为86 bp;ColⅠ上游引物5'-AGCAGACGGGAGTTTCACCTC-3',下 游 引 物 5'-TGTCTTCTTGGCCATGCGTCA-3',扩 增长度为 193 bp;GAPDH上游引物5'-TGTGTCCGTCGTGGATCTGA-3',下游引物 5'-TTGCTGTTGAAGTCGCAGGAG-3',扩增长度为150 bp。3111二氧化碳培养箱(Thermo),FACSCalibur流式细胞仪(BD),BioSpec-nano型紫外可见分光光度计(岛津),Mx3000P型Real-Time PCR仪(Agilent)。
4 主要方法
4.1 含药血清制备与实验分组 将70只大鼠随机分为7组:左归丸组(ZGW)、右归丸组(YGW)、共同药组(GTY)、滋阴药组(ZYY)、补阳药组(BYY)、补佳乐组(BJL)和空白对照组,每组10只,雌雄各半。按每kg体重大鼠的给药量为人的6.3倍计算,并且每天给大鼠灌胃量为正常人用药量的2倍,每天早晚各灌胃1次,空白对照组灌服蒸馏水。于第4天给药2 h后,腹腔注射10%水合氯醛麻醉,采用大鼠腹主动脉取血,静置2 h 后,2 500 r·min-1、4 ℃离心20 min,收集血清,56℃水浴灭活30 min,分装后,-86℃保存。实验分为8组:ZGW+YDJ组、YGW+YDJ组、GTY+YDJ组、ZYY+YDJ组、BYY+YDJ组、BJL+YDJ组、YDJ组和 control组,见表1。

表1 实验分组Table 1.Experimental groupsing
4.2 BMSCs分离培养 将2月龄大鼠脱颈处死后,75%乙醇浸泡15 min后,移入超净台,在无菌条件下取下双侧股骨和胫骨,剪掉骨的两端,暴露骨髓腔后,用5 mL含青、链霉素的α-MEM培养液反复冲洗骨髓腔至平皿中,直至骨的颜色变白,收集平皿中液体到离心管中,1 000 r·min-1离心 3 min,倒掉上清液,用含10%FBS的α-MEM培养液重悬细胞后,转入25 cm2培养瓶,再移到CO2培养箱培养,传至第4代细胞,用于以下实验。
4.3 BMSCs鉴定 第4代细胞经PBS洗3遍,胰酶消化,再用1 mL PBS重悬后转入1.5 mL EP管中,1 500 r·min-1离心 5 min,1 mL PBS 重悬,细胞浓度为1×109cells·L-1,分别加入 CD29抗体、CD45 抗体、CD11b/c抗体和 CD90抗体,避光,4℃孵育30 min,再用PBS清洗1次,0.3 mL PBS再次重悬,上流式细胞仪检测。
4.4 碱性磷酸酶(alkaline phosphatase,ALP)染色采用改良钙钴法,P4细胞经胰酶消化后,以5×107cells·L-1接种于 24 孔培养板(1 mL/well),4 d(根据前期绘制生长曲线的情况)后饥饿培养,24 h后弃饥饿液,分别加入8种干预液1 mL,每组3复孔,继续培养9 d后,弃原培养液,95%乙醇固定15 min,干燥后;加入ALP孵育液,于37℃孵育4 h;流水洗10 min;2%硝酸钴作用5 min;蒸馏水洗片刻;1%硫化铵水溶液(现配用)处理1 min;蒸馏水冲洗。显微镜观察。
4.5 矿化结节观察 采用茜素红染色法,接种细胞同方法4.4项,培养14 d(每3d换液1次)后弃孔中的培养液,PBS洗2次,95%乙醇固定10 min;PBS洗3次;0.1%茜素红-Tris-HCl 37℃孵育30 min;自来水冲洗,室温干燥。显微镜观察。
4.6 核心结合因子α1(core binding factor alpha 1,Cbfα1)和Ⅰ型胶原(collagen typeⅠ,ColⅠ)mRNA检测 采用RT-PCR法,第4代BMSCs接种于8个25 cm2培养瓶,4 d后饥饿,24 h后加各组培养液6 mL,9 d(每3 d换液1次)后将细胞用 PBS洗3遍后,每瓶中加入500μL RNAiso Plus,刮取细胞,吸入预冷的1.5 mL EP中,用RNAiso Plus试剂盒提取细胞总RNA,紫外分光光度计检测RNA纯度A260/A280在1.8~2.2之间。去除基因组DNA,反转录RT反应和染料法(SYBR Green I)相对定量分析,反转录按如下条件反应:37℃ 15 min,85℃ 5 s,4℃保存。实时定量PCR仪中按如下条件反应:95℃ 2 min,95 ℃ 30 s,60 ℃ 30 s,40个循环。
4.7 Cbfα1和ColⅠ蛋白检测 采用 Western blotting法,细胞接种及含药血清干预同方法4.6项,9 d后,弃培养液,4℃预冷的PBS洗3遍,甩干;每瓶细胞加入裂解液100μL,细胞刮至瓶底一角,冰上静置30 min;收集至预冷的离心管中,12 000 r·min-1、4℃ 离心10 min,取上清;BCA试剂盒测定蛋白浓度,蛋白变性后,每孔上样20μL,电泳后转膜3 h,Ⅰ抗孵育1 h后,4℃过夜,次日Ⅱ抗孵育1 h后,暗室中加入ECL发光液,曝光30 min,扫描图像并分析结果,计算目的蛋白与内参照GAPDH条带的吸光度比值,再各组比较。
5 统计学处理
采用SPSS 13.0软件处理,数据以均数±标准差(mean±SD)表示,组间均数比较用One-way ANOVA,方差齐采用LSD检验,方差不齐采用 Tamhane's方法,以P<0.05为差异有统计学意义。
结 果
1 BMSCs形态学观察
细胞接种于培养瓶后,24 h后可见部分细胞贴壁,呈圆形较多,透亮,3 d后可见大部分细胞已贴壁,有突触伸出,细胞多呈菱形或多角形,可进行首次换液,10~12 d细胞达80%融合,可进行首次传代,第4代细胞多呈纺锤形生长,排列为漩涡状,见图1。
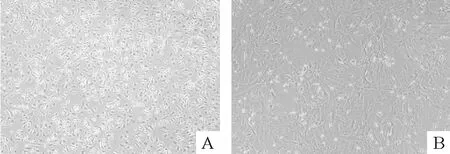
Figure 1.Morphology of BMSCs(×100).A:P0 BMSCs at 10 d;B:P4 BMSCs at 5 d.图1 BMSCs的形态
2 BMSCs的流式细胞术鉴定
经流式细胞术检测,CD90(70.61%)和 CD29(98.38%)表达为阳性,CD11b/c(11.23%)和 CD45(7.64%)表达为阴性,见图2。
3 左、右归丸及其拆方含药血清对BMSCs ALP活性的影响
与control组比较,其它组ALP活性均增强,差异有统计学意义(P<0.05)。与YDJ组比较,ZGW+YDJ和ZYY+YDJ组ALP活性增强,BYY+YDJ和BJL+YDJ组ALP活性降低,差异有统计学意义(P<0.05)。与 ZGW+YDJ组比较,YGW+YDJ、GTY+YDJ、BYY+YDJ和 BJL+YDJ组 ALP活性降低,差异有统计学意义(P<0.05),见图3。

Figure 2.Identification of BMSCs by flow cytometry.A:PerCP/Cy5.5 anti-CD90;B:APCanti-CD29;C:PE anti-CD11b/c;D:PE anti-CD45.图2 BMSCs的流式细胞术鉴定
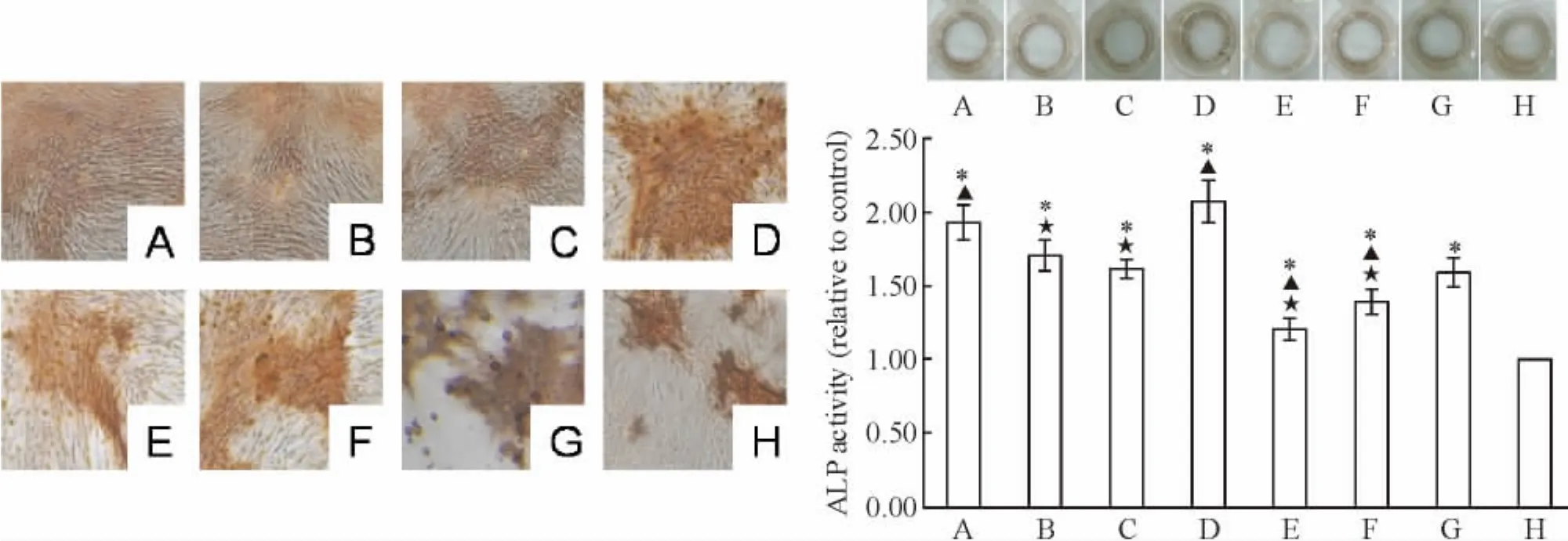
Figure 3.The ALP activity in BMSCs induced by sera containing Zuogui pill,Yougui Pill and their disassembled prescriptions(×100).A:ZGW+YDJ;B:YGW+YDJ;C:GTY+YDJ;D:ZZY+YDJ;E:BYY+YDJ;F:BJL+YDJ;G:YDJ;H:control.Mean ±SD.n=3.*P <0.05 vs control;▲P <0.05 vs YDJ;★P <0.05 vs ZGW+YDJ.图3 左、右归丸及其拆方含药血清对BMSCs ALP活性的影响
4 左、右归丸及其拆方含药血清对BMSCs矿化结节的影响
与control组比较,其它组矿化结节均有增加,差异有统计学意义(P<0.05)。与YDJ组比较,ZGW+YDJ和ZYY+YDJ组矿化结节均有增加,BYY+Y DJ和BJL+YDJ组矿化结节减少,差异有统计学意义(P<0.05)。与 ZGW+YDJ组比较,YGW+YDJ、GTY+YDJ、BYY+YDJ和 BJL+YDJ组矿化结节均有减少,差异有统计学意义(P<0.05),见图4。
5 左、右归丸及其拆方含药血清对BMSCs Cbfα1 mRNA表达的影响
与control组比较,其它组Cbfα1 mRNA表达均上调,差异有统计学意义(P<0.05)。与YDJ组比较,ZGW+YDJ、YGW+YDJ、GTY+YDJ 和 ZYY+YDJ组Cbfα1 mRNA表达均上调,差异有统计学意义(P<0.05)。与ZGW+YDJ组比较,YGW+YDJ、GTY+YDJ、BYY+YDJ和 BJL+YDJ组 Cbfα1 mRNA表达均下调,差异有统计学意义(P<0.05),见图5。

Figure 5.Cbfα1 mRNA expression in BMSCs induced by sera containing Zuogui pill,Yougui pill and their disassembled prescriptions.A:ZGW+YDJ;B:YGW+YDJ;C:GTY+YDJ;D:ZZY+YDJ;E:BYY+YDJ;F:BJL+YDJ;G:YDJ;H:control.Mean ± SD.n=3.*P <0.05 vs control;▲P <0.05 vs YDJ;★P <0.05 vs ZGW+YDJ.图5 左、右归丸及其拆方含药血清对BMSCs Cbfα1 mRNA表达的影响
6 左、右归丸及其拆方含药血清对BMSCs ColⅠmRNA表达的影响
与control组比较,除BYY+YDJ组外,其它组均能上调ColⅠmRNA表达,差异有统计学意义(P<0.05)。与YDJ组比较,ZGW+YDJ和ZYY+YDJ组能上调ColⅠmRNA表达,BBY+YDJ和 BJL+YDJ组下调ColⅠmRNA表达,差异有统计学意义(P<0.05)。与 ZGW+YDJ组比较,YGW+YDJ、GTY+YDJ、BYY+YDJ和 BJL+YDJ组下调 ColⅠmRNA 表达,差异有统计学意义(P<0.05),见图6。
7 左、右归丸及其拆方含药血清对 BMSCs的Cbfα1蛋白表达的影响
与control组比较,除 BYY+YDJ组外,其它组Cbfα1蛋白表达升高,差异有统计学意义(P<0.05);与YDJ组比较,ZGW+YDJ和 ZYY+YDJ组Cbfα1蛋白表达升高,差异有统计学意义(P<0.05)。与 ZGW+YDJ组比较,YGW+YDJ、GTY+YDJ、BYY+YDJ和 BJL+YDJ组 Cbfα1 蛋白表达降低,而ZYY+YDJ组Cbfα1蛋白表达升高,差异有统计学意义(P<0.05),见图7。

Figure 6.ColⅠmRNA expression in BMSCs induced by sera containing Zuogui pill,Yougui pill and their disassembled prescriptions.A:ZGW+YDJ;B:YGW+YDJ;C:GTY+YDJ;D:ZZY+YDJ;E:BYY+YDJ;F:BJL+YDJ;G:YDJ;H:control.Mean ±SD.n=3.*P <0.05 vs control;▲P <0.05 vs YDJ;★P <0.05 vs ZGW+YDJ.图6 左、右归丸及其拆方含药血清对BMSCs ColⅠmRNA表达的影响
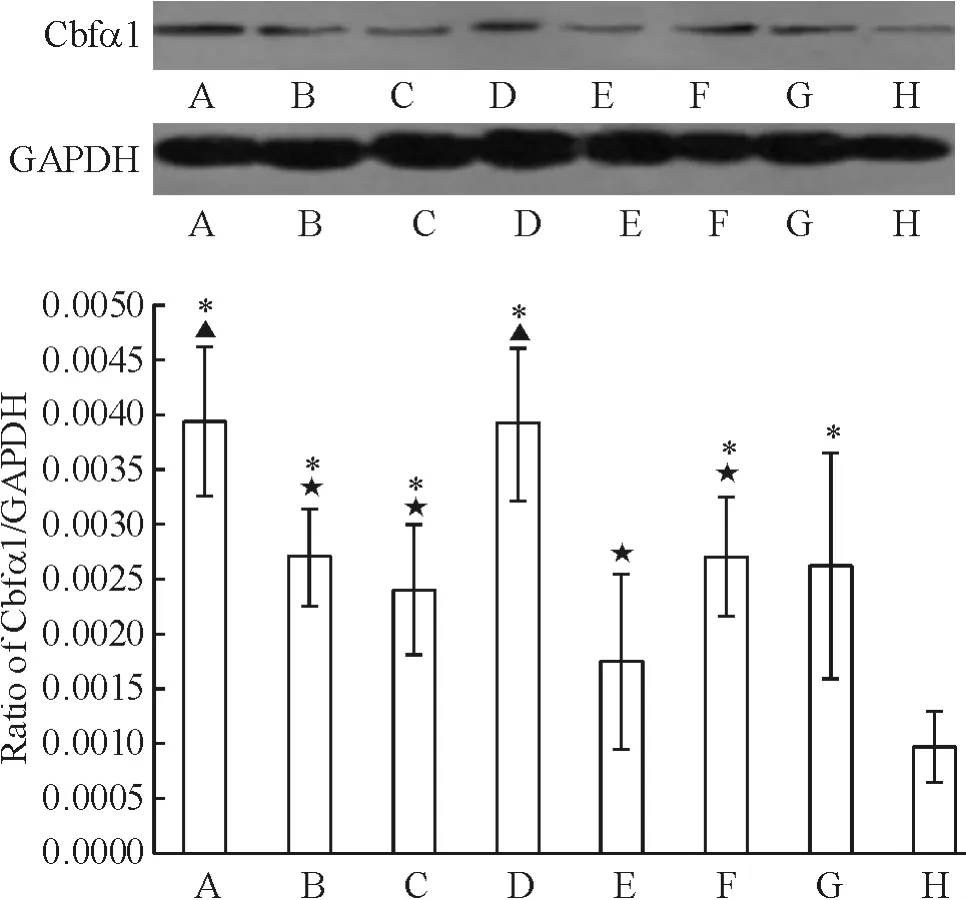
Figure 7.Cbfα1 protein expression in BMSCs induced by sera containing Zuogui pill,Yougui pill and their disassembled prescriptions.A:ZGW+YDJ;B:YGW+YDJ;C:GTY+YDJ;D:ZZY+YDJ;E:BYY+YDJ;F:BJL+YDJ;G:YDJ;H:control.Mean ± SD.n=3.*P <0.05 vs control;▲P <0.05 vs YDJ;★P <0.05 vs ZGW+YDJ.图7 左、右归丸及其拆方含药血清对BMSCs Cbfα1蛋白表达的影响
8 左、右归丸及其拆方含药血清对BMSCs ColⅠ蛋白表达的影响
与control组比较,除 BYY+YDJ组外,其它组Col 1蛋白表达升高,差异有统计学意义(P<0.05)。与YDJ组比较,ZGW+YDJ和ZYY+YDJ组Col 1蛋白表达升高,BYY+YDJ组ColⅠ蛋白表达降低,差异有统计学意义(P<0.05)。与ZGW+YDJ组比较,GTY+YDJ、BYY+YDJ和 BJL+YDJ组 ColⅠ蛋白表达降低,差异有统计学意义(P<0.05),见图8。
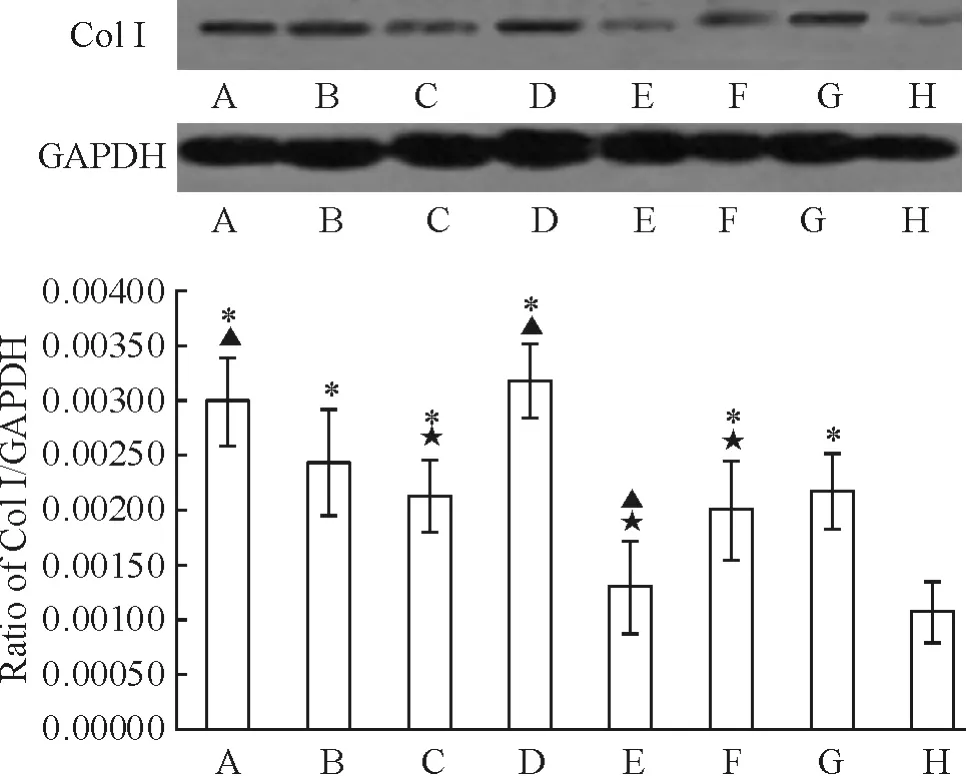
Figure 8.ColⅠprotein expression in BMSCs induced by sera containing Zuogui pill,Yougui pill and their disassembled prescriptions.A:ZGW+YDJ;B:YGW+YDJ;C:GTY+YDJ;D:ZZY+YDJ;E:BYY+YDJ;F:BJL+YDJ;G:YDJ;H:control.Mean ± SD.n=3.*P <0.05 vs control;▲P <0.05 vs YDJ;★P <0.05 vs ZGW+YDJ.图8 左、右归丸及其拆方含药血清对BMSCs ColⅠ 蛋白表达的影响
讨 论
中医理论认为,“肾生骨髓”,“肾充则髓实”(《素问·阴阳应象大论》)。肾藏精,精生髓,髓养骨,这是“肾主骨”的理论基础[6]。精是构成人体生命活动的有形精微物质,是构成人体和维持人体生命活动的最基本物质。BMSCs是一种多潜能细胞,主要存在于骨髓中,在个体发育成熟过程的特定状态下及组织修复过程中起着重要的作用,其功能不足则会导致生长发育障碍。目前研究认为肾精与BMSCs存在一定的相关性[7],BMSCs对骨的生长发育及功能的维持起着非常重要的作用。左、右归丸是中医补肾益精法经典代表方,均出自《景岳全书·新方八阵》。左归丸用于肝肾精血虚损,从《内经》“精不足者,补之以味”而立法,《素问·阴阳应象大论》云:“形不足者,温之以气;精不足者,补之以味。”方中熟地黄、山药、山茱萸补肝肾益阴血,龟板胶、鹿角胶合用可峻补精血,调和阴阳,再加菟丝子、枸杞子平补肝肾,牛膝以壮腰膝;右归丸治命门火衰,真阳虚弱,在附子、肉桂、鹿角胶、菟丝子、杜仲等温补肾阳之中,又用大量的熟地黄配合山药、山茱萸、枸杞子滋阴补肾,填精补髓,于阴中求阳,滋阴生气。同时,现代研究发现左、右归丸可以作为“补肾”的代表方促进BMSCs的成骨分化。但由于2方补肾填精的机制不同,所以2方在促进BMSCs成骨分化方面是否有不同之处值得探讨。补佳乐戊酸雌二醇片是临床常用的一种雌激素,可以抑制骨的吸收以促进骨的形成[8],而现代研究发现左、右归丸也可以通过发挥其类雌激素样的作用促进骨形成[9-10],故本实验选用补佳乐为阳性对照药,与左、右归丸及其拆方分别诱导BMSCs成骨分化。
本实验首先对体外分离培养的BMSCs进行鉴定,BMSCs因其有贴壁性的特点,传至第4代后细胞纯化,表达多种细胞的表面标志[11-13],如 CD29、CD90、CD71、CD44、CD105、CD106 等,以上均是 BMSCs的重要表面标志物,同时又由于它属于非造血类细胞,不表达 CD34、CD45、CD11b、CD14 等表面抗原,经流式细胞术检测CD29和CD90表达阳性,CD11b/c和CD45表达阴性,故 BMSCs得以鉴定。目前对于BMSCs的成骨分化研究很多,这一过程受诸多因素的影响[14-15],如ALP是成骨细胞所分泌的一种酶蛋白,ALP活性的高表达是成骨细胞分化的标志,矿化结节的形成也是成骨的另一标志[16-17],Cbfα1是间充质干细胞向成骨细胞分化的特异性转录调节因子,它的表达是成骨细胞开始分化的标志[18-19]。ColⅠ是矿化骨中唯一的胶原类型,代表成骨过程中有机基质的形成[20-21]。实验结果表明左归丸组和滋肾阴药组均可协同诱导剂诱导BMSCs成骨分化,显著促进 ALP生成,矿化结节的形成,上调Cbfα1 和 ColⅠmRNA,促进 Cbfα1 和 ColⅠ蛋白的高表达,且优于诱导剂组,而左归丸组和滋肾阴药组之间无显著差异;同时,我们发现右归丸组、2方共同药组、补肾阳药组和补佳乐组对于以上的成骨指标的检测均不如左归丸组。由此可见,左归丸组和滋肾阴药组协同诱导剂诱导BMSCs成骨分化为佳,进一步说明了其对BMSCs成骨分化的协同作用,以“滋补肾阴”立法的左归丸组和滋肾阴药组优于以“温补肾阳”立法的右归丸组和补肾阳药组,但二者对于BMSCs成骨分化过程中是否作用于不同的信号转导通路有待进一步研究。
