miR-155-5p在宫颈癌血清中的表达及其对宫颈癌细胞的影响*
2013-12-01车玉传苏运钦温旺荣
车玉传, 苏运钦, 温旺荣
(暨南大学附属第一医院临床医学检验中心,广东广州510630)
宫颈癌是世界女性中仅次于乳腺癌和结直肠癌的第3个常见的恶性肿瘤,严重威胁女性健康和生命,因此对宫颈癌的早期诊断具有重要意义。微小核糖核酸(microRNA,miRNA)是近年来热点研究的一类高度保守的内源性、非编码单链小分子RNA,主要通过与特定靶基因mRNA的3'端非翻译区(untranslated region,UTR)完全或不完全互补配对而在转录后水平负调控靶基因表达。近年来研究发现,部分miRNA的异常表达与宫颈癌发生和发展密切相关[1-4]。miR-155-5p是最早发现的具有促癌活性的 miRNA,在宫颈癌[5]、子宫内膜癌[6]、乳腺癌[7]、大肠癌[8]、胰腺癌[9]、肺癌[10]等恶性肿瘤组织中表达上调,并与肿瘤的发生、发展及预后密切相关。血清中也存在miR-155-5p,其能够对抗核糖核酸酶的降解而保持稳定性,然而miR-155-5p在宫颈癌患者血清中的表达及功能研究尚未见报道,本研究拟采用实时荧光定量PCR方法检测miR-155-5p在宫颈癌患者血清中的表达情况,并通过miR-155-5p mimic或inhibitor上调或抑制宫颈癌细胞miR-155-5p的表达,观察miR-155-5p对宫颈癌细胞增殖、细胞周期和凋亡的影响,了解miRNA在宫颈癌发生发展中的作用机制,探讨miR-155-5p在宫颈癌早期诊断和治疗中的临床应用价值。
材料和方法
1 研究对象
收集暨南大学附属第一医院2012年1月至2013年5月初诊的宫颈癌患者15例,宫颈上皮内瘤样病变(cervical intraepithelial neoplasia,CIN)患者15例和慢性宫颈炎患者12例,收集同期体检的健康对照女性血清标本15例。排除标准:非初诊患者,即已接受过手术、放疗、化疗等不同治疗的患者;伴有心、肝、脑、肾、肺等器官及血液系统疾病。所有血清标本收集立即置于-80℃冰箱保存。宫颈癌HeLa和SiHa细胞由中山大学附属肿瘤医院实验中心馈赠。
2 主要仪器
LightCycler 1.5 Instrument(Roche);Prism 7000荧光定量 PCR仪 (ABI);荧光倒置显微镜(Olympus);Biophotometer生物分光光度计(Eppendorf);高速冷冻离心机(Eppendorf);酶标仪(Bio-Rad);凝胶成像系统(Alpha);生物安全柜(ESCO)。
3 主要试剂
miRcute miRNA提取分离试剂盒(北京天根生化科技有限公司);脂质体LipofectamineTM2000(Invitrogen);Trizol试剂(Invitrogen);逆转录试剂盒与SYBR Green荧光定量PCR检测试剂盒(TaKaRa);miR-155-5p及内参照U6 snRNA特异逆转录及qRTPCR引物、miR-155-5p mimic和 inhibitor(广州市锐博生物科技有限公司);DMEM高糖培养基(Gibco);1×105U/L青霉素和100 mg/L链霉素溶液(Gibco);无支原体胎牛血清(杭州四季青生物工程材料有限公司);无血清培养基 Opti-MEMⅠ(Gibco);CCK-8检测试剂盒(日本同仁化学研究所);细胞周期检测试剂盒(Sigma);凋亡检测试剂盒(南京凯基生物科技发展有限公司);其它常规化学试剂均为分析纯产品。
4 血清miRNA和细胞总RNA的提取
4.1 血清 miRNA提取 取450μL血清,严格按miRcute miRNA提取分离试剂盒说明书操作提取,将提取的miRNA用15μL DEPC处理水溶解,-80℃保存备用。
4.2 细胞总RNA提取 常规Trizol法提取细胞的总RNA。加入50μL DEPC水溶解RNA,反复吹打混匀,65℃烤箱助溶10 min,冰上冷却5 min,-80℃保存备用。
4.3 RNA纯度及浓度的测定 取10μL总RNA,加0.1%DEPC 处理水 90μL稀释 10倍,以 0.1%DEPC处理水做空白对照,超微量紫外分光光度计测定RNA在波长260 nm与280 nm的吸光度值,RNA溶液的A260/A280在1.8~2.1为纯度合格。样品RNA浓度(mg/L)=A260×40×样本稀释倍数。
5 实时荧光定量PCR检测miR-155-5p的表达
5.1 miR-155-5p逆转录反应 反应体系为10μL,包括5 × PrimeScript® Buffer 2 μL,PrimeScript® RT Enzyme Mix I 0.5 μL,特异性逆转录引物(5 μmol/L)0.2 μL,总 RNA 5 μL,RNase-Free dH2O 2.3 μL。反应条件为42℃ 15 min,85℃ 5 s。内参照U6 snRNA逆转录反应参数同上。反应设1复孔。逆转录产物cDNA保存于-20℃冰箱备用。
5.2 miR-155-5p qRT-PCR 反应体系为20μL,包括SYBR® Premix Ex TaqTMII(Tli RNaseH Plus)(2×)10 μL,上、下游引物(5 μmol/L)各1.6 μL,ROX Reference Dye(50 ×)0.4 μL,cDNA 模板2 μL,0.1%DEPC处理水4.4μL。反应条件:95℃预变性30 s,95℃ 5 s、60℃ 31 s,40个循环。阴性对照以0.1%DEPC处理水代替逆转录产物。设置熔解曲线判断是否存在引物二聚体和非特异性扩增。内参照U6 snRNA qRT-PCR参数同上。
6 细胞株的培养及转染
HeLa和SiHa细胞株接种于含10% 胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM高糖培养基,37℃、5%CO2条件下培养。实验时取对数生长期细胞,以(2~4)×105cells/well种6孔板。转染前1 d,每孔中加入1 000μL不含抗生素的培养基继续培养,细胞生长至70% ~90% 融合度时,严格按照LipofectamineTM2000和广州锐博生物科技有限公司miR-155-5p mimic和inhibitor使用说明书的条件进行转染。转染4 h后,更换新鲜的完全培养基,37℃、5%CO2条件下继续培养。miR-155-5p mimic转染分6组:空白组、脂质体组、50 nmol/L mimic组、100 nmol/L mimic组、200 nmol/L mimic组和negative control组。miR-155-5p inhibitor转染分5组:空白组、脂质体组、100 nmol/L inhibitor组、200 nmol/L inhibitor组和negative control组。阴性对照是经过生物信息学分析与人miRNA具有最小同源性的线虫miRNA,适用于人miRNA实验的阴性对照。各自阴性对照终浓度为100 nmol/L。
7 CCK-8法检测各组细胞的增殖情况
按前述方法将miR-155-5p mimic和inhibitor转染HeLa和SiHa细胞24 h后,经胰酶消化收集细胞,在离心管内将各组细胞悬液充分打匀,按HeLa细胞3×104cells/well、SiHa细胞 2 ×104cells/well接种于96孔板中,每孔加液量100μL,37℃、5%CO2条件下继续培养。于 24 h、48 h、72 h、96 h,每组分别取 3个平行孔进行检测,将培养液去除,每孔加入100μL无血清培养基和10μL CCK-8试剂,在37℃、5%CO2条件下继续培养1 h后,用酶标仪检测波长为490 nm时的吸光度(A)。
8 流式细胞术检测miR-155-5p对宫颈癌HeLa和SiHa细胞周期和凋亡的影响
8.1 PI单染法检测宫颈癌HeLa和SiHa细胞周期 以适量胰酶消化、收集转染48 h后的宫颈癌细胞,2 000 r/min离心5 min,并用预冷磷酸盐缓冲液洗涤、重悬细胞2次,弃上清,加入预冷的70%乙醇2 mL,混匀,于4℃固定过夜。第2天以1 500 r/min离心5 min收集细胞,1 000μL预冷磷酸缓冲液再次洗涤后加入400μL 50 mg/L碘化丙啶(propidium iodide,PI)和100μL 100 mg/L RNase A,4℃ 避光孵育30 min,以50μm尼龙网膜过滤细胞,流式细胞术检测细胞DNA含量。结果用细胞周期拟和软件ModFit分析。每组重复3次。
8.2 Annexin V/PI双染法检测宫颈癌HeLa和SiHa细胞凋亡 以适量不含EDTA胰酶消化、收集转染48 h后的宫颈癌HeLa和SiHa细胞,用磷酸盐缓冲液洗涤、重悬细胞2次。以2 000 r/min离心5 min,收集(1~5)×105个细胞,离心沉淀,加入 500μL binding buffer悬浮细胞,向悬液中加入5μL Annexin V-FITC混匀染色,随后加入5μL PI混匀染色,室温下避光反应15 min,流式细胞仪检测细胞凋亡率。实验重复3次。
9 数据处理与统计学分析
qRT-PCR以U6 snRNA为内参照,对目标基因进行归一化处理。采用相对定量法,样品目的基因的相对定量(relative quantification,RQ)采用 ΔΔCt方法计算,ΔCt待测样本=(CT样本miR-155-5p- Ct样本U6snRNA)的均 数 ± 标 准 差,ΔCt对照样本= (Ct对照miR-155-5p-Ct对照U6snRNA)的均数 ± 标准差,ΔΔCt=(ΔCt待测样本-ΔCt对照样本)±标准差。RQ=2-ΔΔCt的均数 ± 标准差,表示实验组miR-155-5p相对于对照组的相对表达量。
数据均采用SPSS 13.0统计软件处理,miR-155-5p在宫颈癌、CIN、宫颈炎和健康对照组血清中的相对表达量 2-ΔΔCt经单样本 Kolmogorov-Smimov检验,符合正态分布(Z=1.064,P=0.208 >0.10),以均数±标准差(mean±SD)表示。经Levene法检验符合方差齐性条件(P=0.313>0.10),因此两个样本均数比较采用Independent-Sample T test进行检验,多个样本均数比较采用One-way ANOVA分析。以P<0.05为差异有统计学意义。
结 果
1 实时荧光定量PCR熔解曲线
miR-155-5p和U6 snRNA的熔解曲线为单峰,未见杂峰信号,表明引物扩增的特异性较好,产物单一,无明显非特异产物。miR-155-5p和U6 snRNA的熔解温度非常接近,在82℃左右,见图1。血清miR-155及U6 snRNA扩增曲线呈标准S型。阴性对照产生的微弱非特异扩增信号明显滞后于实验组血清样本的扩增信号。
2 miRNA的cDNA扩增及电泳检测鉴定
对miR-155-5p和内参照U6 snRNA的2次扩增产物用4%琼脂糖凝胶电泳,在100 bp左右出现明显的亮带,且与所推断的目的片段大小范围大致相符,为有效扩增。产物条带单一,无非特异性扩增条带,见图2。

Figure 1.Melting curves for miR-155-5p and U6 snRNA.图1 miR-155-5p和U6 snRNA熔解曲线
Figure 2.Electrophoresis results for miR-155-5p and U6 snRNA PCR products.M:TaKaRa 20 bp DNA ladder marker;1~3:U6 snRNA amplification products;4~6:miR-155-5p amplification products;NC1:U6 snRNA negative control;NC2:miR-155-5p negative control.图2 miR-155-5p和U6 snRNA扩增产物电泳

表1 miR-155-5p在宫颈癌、CIN、宫颈炎和健康对照组血清中的表达差异Table 1.Differential expression of serum miR-155-5p in cervical cancer,CIN,cervicitis and healthy control group(Mean±SD)

Figure 3.The red fluorescence distribution of HeLa cells and SiHa cells 24 h after transfection(×100).A:HeLa cells,phase-contrast;B:HeLa cells,fluorescence;C:SiHa cells,phase-contrast;D:SiHa cells,fluorescence.图3 HeLa细胞和SiHa细胞红色荧光分布
3 miR-155-5p在宫颈癌、CIN、宫颈炎和健康对照组血清中的表达差异情况
qRT-PCR检测miR-155-5p在宫颈癌、CIN、宫颈炎和健康对照组血清样本中相对于U6 snRNA的表达。经 One-way ANOVA检验,可认为4组血清中miR-155-5p的相对表达量不同(P<0.05)。经多个样本均数间两两比较的SNK检验,宫颈癌组血清中miR-155-5p的相对表达量高于宫颈炎组和健康对照组(P<0.05),CIN组和宫颈癌组血清中miR-155-5p的相对表达量差异无统计学意义(P<0.05),CIN组、宫颈炎组和健康对照组血清中miR-155-5p的相对表达量差异也无统计学意义(P>0.05),见表1。
4 宫颈癌HeLa细胞和SiHa细胞转染效率观察
转染前1 d,接种适当数量的细胞至6孔板中,每孔中加入1 mL不含抗生素的培养基,使转染时的细胞密度能够达到70% ~90%。以100 nmol/L终浓度将带Cy3标记的miRNA mimic阴性对照转染HeLa细胞和SiHa细胞。转染后24 h,荧光倒置显微镜下观察并计数红色荧光细胞的百分比例,结果显示95%以上的HeLa细胞和SiHa细胞内可见红色荧光分布,细胞转染效率可达95%以上,见图3。
5 miR-155-5p mimic和inhibitor转染HeLa和Si-Ha细胞后miR-155-5p表达量的变化
转染miR-155-5p mimic后,2种细胞中miR-155-5p相对表达量明显上调,且随着时间的推移,miR-155-5p mimic在细胞内的降解逐渐加快,但其上调miR-155-5p的作用至少可以持续到转染后96 h,见表2。miR-155-5p mimic在SiHa细胞中的降解速度比在HeLa细胞中快。由于miR-155-5p inhibitor竞争性抑制的作用机制,即与miR-155-5p高效稳定结合,减弱内源性miR-155-5p对下游靶基因的调控作用,所以对细胞内miR-155-5p相对表达量的下调并不明显,见表3。

表2 miR-155-5p mimic转染细胞后miR-155-5p表达量的动态性改变Table 2.The expression changes of miR-155-5p after transfected with miR-155-5p mimic(2 -ΔΔCt)

表3 miR-155-5p inhibitor转染细胞后miR-155-5p表达量的动态性改变Table 3.The expression changes of miR-155-5p after transfected with miR-155-5p inhibitor(2 -ΔΔCt)
6 miR-155-5p对宫颈癌HeLa和SiHa细胞增殖的影响
从图4、5可见,用CCK-8法检测miR-155-5p表达的上调或下调对转染后不同时点细胞增殖的影响发现,与空白细胞组、脂质体组、阴性对照组相比,分别以 50 nmol/L、100 nmol/L、200 nmol/L 转染 miR-155-5p mimic和以 100 nmol/L、200 nmol/L转染miR-155-5p inhibitor,HeLa细胞和SiHa细胞在转染后24 h、48 h、72 h和96 h的增殖差异均无统计学意义(P>0.05),无时间和剂量依赖性。

Figure 4.The growth curves of HeLa and SiHa cells after transfected with miR-155-5p mimic.Mean ±SD.n=3.图4 miR-155-5p mimic转染后HeLa和SiHa细胞生长曲线
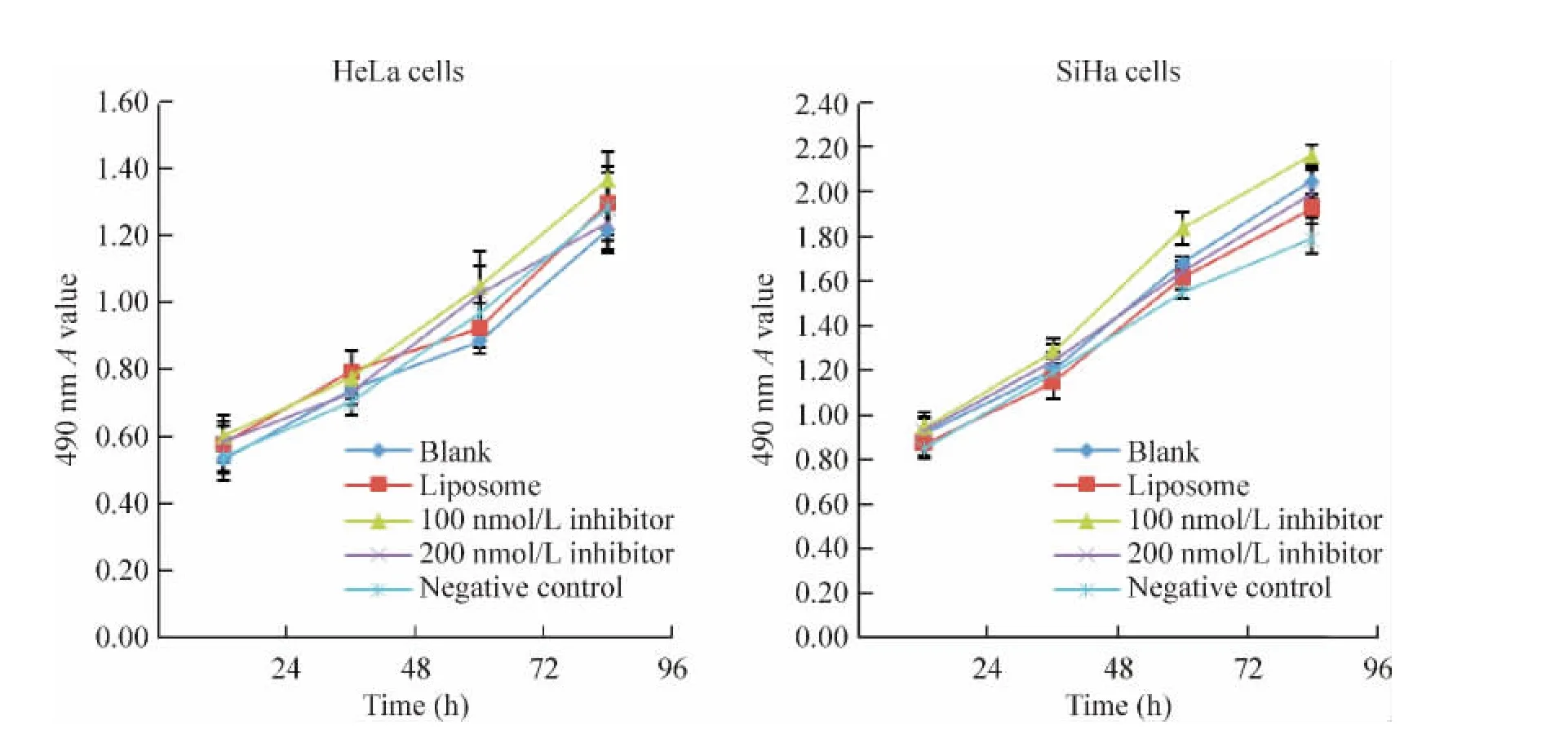
Figure 5.The growth curves of HeLa and SiHa cells after transfected with miR-155-5p inhibitor.Mean ± SD.n=3.图5 miR-155-5p inhibitor转染后HeLa和SiHa细胞生长曲线
7 miR-155-5p对宫颈癌HeLa和SiHa细胞周期和凋亡的影响
用Levene法进行方差齐性检验,不同组别HeLa和SiHa不同细胞周期阶段和凋亡的百分率符合方差齐性条件(P>0.10)。经完全随机设计资料的方差分析,发现转染不同浓度miR-155-5p mimic对Si-Ha细胞凋亡的影响不同(P<0.05)。与空白组、脂质体组和阴性对照组相比,转染100 nmol/L和200 nmol/L miR-155-5p mimic的SiHa细胞中,S期细胞比例升高,凋亡细胞比例降低(P<0.05)。与空白组、脂质体组和阴性对照组相比,转染50 nmol/L、100 nmol/L和200 nmol/L miR-155-5p mimic以及转染100 nmol/L和200 nmol/L miR-155-5p inhibitor对HeLa细胞的细胞周期和凋亡的影响差别均无统计学意义(P>0.05)。另外,转染100 nmol/L和200 nmol/L miR-155-5p inhibitor的 SiHa细胞中,G2/M期细胞比例明显增高(P<0.05),下调SiHa细胞miR-155-5p表达可能诱导G2/M期阻滞。转染100 nmol/L和200 nmol/L miR-155-5p inhibitor对SiHa细胞凋亡的影响与空白组、脂质体组和阴性对照组相比,差别也均无统计学意义(P>0.05),见表4、5。

表4 miR-155-5p mimic对HeLa和SiHa细胞周期和凋亡的影响Table 4.The effects of miR-155-5p mimic on cell cycle and apoptosis of HeLa and SiHa cells 48 h after transfection(%.Mean±SD.n=3)

表5 miR-155-5p inhibitor对HeLa和SiHa细胞周期和凋亡的影响Table 5.The effects of miR-155-5p inhibitor on cell cycle and apoptosis of HeLa and SiHa cells 48 h after transfection(%.Mean±SD.n=3)
讨 论
miRNA是一种内源性转录后调控因子,在mRNA水平调节靶基因的表达。血清miRNA主要来源于凋亡或坏死的细胞、组织细胞的主动分泌以及循环细胞的裂解。因此,miRNA在血清和组织中的表达具有较高的相似性。内源性血清miRNA多数不是以游离形式存在,成熟后常与蛋白等构成沉默复合体,因被蛋白保护而具有良好的抗RNase降解能力,尽管血清中miRNA丰度较组织中低得多,但是miRNA在血清中高度稳定,这一特点为血清miRNA发挥生物学功能、作为肿瘤标志物提供了基础[11]。
宫颈癌相关miRNA异常表达的临床应用研究已成为热点。多种miRNA的异常表达与宫颈癌的发生、发展密切相关[12]。通过对宫颈癌相关miRNA进行鉴定和功能分析,发现宫颈癌中有明确靶基因的 miRNA 差异表达谱,如 miR-21、miR-29、miR-34、miR-143、miR-214、miR-372、miR-519、miR-17-5p 等,可能用于监测宫颈癌发生、发展。另外,Ke等[13]发现,相比于对放射治疗较敏感的宫颈癌组织和细胞,在对放射治疗不敏感宫颈癌组织和细胞,miR-181a表达上调。进一步功能研究发现过表达miR-181a能靶向负调控促凋亡蛋白激酶PRKCD(protein kinase C delta)基因的表达,抑制辐射诱导的细胞凋亡和减少G2/M阻滞,进而抑制宫颈癌细胞放疗敏感性,相反下调miR-181a能增加宫颈癌细胞PRKCD的表达,进而提高宫颈癌细胞放疗敏感性。因此,宫颈癌miR-181a表达水平可为评价宫颈癌患者放疗敏感性提供有价值的参考指标,同时靶向结合抑制miR-181a可能是增强宫颈癌放射治疗敏感性的一种新方法。
本文研究的miR-155-5p定位于人染色体21q21,由 B细胞整合簇(B-cell integration cluster,BIC)基因第3个外显子高度保守区编码,在宫颈癌[5]、子宫内膜癌[6]、乳腺癌[7]、大肠癌[8]、胰腺癌[9]、肺癌[10]等恶性肿瘤组织中表达上调,并与肿瘤的发生、发展及预后密切相关。本实验采用Stem-Loop SYBR GreenⅠ实时荧光定量PCR法检测血清、HeLa和SiHa细胞中miR-155-5p的表达水平,设计具有茎环结构的特异性逆转录引物,只检测成熟的miR-155-5p,并且能延长逆转录产物cDNA,解决了因miRNA片段短而难于检测的问题。熔解曲线和扩增产物的电泳分析结果证明了反应的特异性。
本研究发现宫颈癌患者血清中miR-155-5p相对于慢性宫颈炎和健康对照者表达升高,与李莉等[14]、Wang等[15]等在宫颈癌组织中发现miR-155-5p高表达相一致,说明miR-155-5p在宫颈癌患者血清和组织中的表达具有较高的相似性,miR-155-5p可能参与宫颈组织的恶变进程,但在宫颈癌患者血清中miR-155-5p的丰度较低。另外,血清miR-155-5p含量在宫颈癌与CIN组之间无统计学差异,是否与样本例数有关有待进一步证实。实验用Cy3标记的100 nmol/L miR-155-5p mimic阴性对照转染HeLa和SiHa细胞,在荧光倒置显微镜下观察转染率,95%以上细胞可见红色荧光。本研究采用qPCR检测转染不同浓度miR-155-5p mimic和inhibitor后HeLa和SiHa细胞中miR-155-5p的相对表达量,证实miR-155-5p mimic能有效上调miR-155-5p的表达。miR-155-5p mimic是运用化学方法合成的双链RNA,能模拟细胞中内源性成熟miR-155-5p的高水平表达,以增强内源性miR-155-5p的调控作用,进行功能获得性研究。相反,由于miR-155-5p inhibitor竞争性抑制的作用机制,即通过与成熟miR-155-5p分子特异性结合,削弱内源性miR-155-5p的基因调控作用,进行功能缺失性研究,所以对HeLa和SiHa细胞内miR-155-5p的表达量的下调并不明显。本研究采用CCK-8法检测细胞增殖,与常用的MTT法相比,还原后的Formazan是水溶性的,不需要添加有机溶剂溶解,步骤少,重复性好,是一种更加简便而准确的细胞增殖和毒性检测方法,为进一步研究相关miRNA的体内抗肿瘤作用奠定了基础。本实验通过CCK-8法检测发现miR-155-5p对人宫颈癌HeLa和SiHa细胞的增殖无明显作用,呈非时间剂量依赖方式。流式细胞术检测miR-155-5p mimic处理后SiHa细胞,发现S期细胞比例增多,且表现出对细胞凋亡的抑制作用,呈非剂量依赖方式,但与CCK-8检测细胞增殖结果不一致。分析其原因,可能与miR-155-5p mimic在细胞内环境中不稳定,容易被降解有关;也可能与细胞周期和凋亡信号通路网络的互补作用有关。进一步的研究应该通过构建miR-155-5p前体高表达载体或miR-155-5p抑制剂表达载体,能较长时间维持miR-155-5p在细胞内的高水平或抑制状态,以进行miRNA功能获得性或缺失性研究。miR-155-5p inhibitor对SiHa细胞的作用主要表现为G2/M期细胞比例增多,G2/M期阻滞使细胞无法进入下一增殖周期,且呈非剂量依赖方式,这可能是其抗肿瘤机制的另一方面。另外,miR-155-5p对HeLa细胞和SiHa细胞周期和凋亡的影响不同,分析其差异的原因可能与miR-155-5p在HeLa细胞和SiHa细胞中的含量不同有关,前期研究发现miR-155-5p在SiHa细胞中的表达要比HeLa细胞高。
miR-155-5p在宫颈癌患者组织、细胞和血清中表达的上调受上游哪些因素调控,以及下游调控哪些信号通路中的哪种靶基因是下一步重点研究方向。此次miR-155-5p与宫颈癌的相关性研究仅为初步探讨,样本量较小,有待增加样本量进一步研究,为宫颈癌的早期诊断以及判断miR-155-5p是否可能作为“癌基因”参与宫颈癌的发生、发展提供更有力的实验依据。
