选择性富集分离虎杖中白藜芦醇苷的分子印迹聚合物的制备及分子识别性能研究
2013-11-28向海艳范银洲卓冬梅
向海艳,范银洲,李 曼,卓冬梅,谢 扬*
(1.南方医科大学 药学院,广东 广州 510515;2.南方医科大学 中医药学院,广东 广州 510515)
分子印迹聚合物(Molecularly impriting polymer,MIP)是近年发展起来的对特定目标分子(即模板分子)具有高度亲和性的聚合物材料,是一种人工合成的具有分子识别功能的介质。在聚合物制备过程中,待分析检测的分子(目标分子)通过离子键、氢键等作用确定分子印迹聚合物基质孔穴的形状、大小以及聚合物功能基团取向,使聚合物分子结构中有许多作用位点,对目标分子保持特殊的“记忆”,从而具有预定识别的高度选择性。与传统生物化学识别体系相比,MIP具有专一性高、制备简单、稳定性好、可重复使用等优点,已广泛应用于样品前处理、固相萃取、色谱分析、传感器等领域[1-7]。近年来以天然活性成分为模板分子,制备分子印迹聚合物并将其应用于中药(如长春碱[8]、青蒿素[9]、甘草酸[10]、吲哚生物碱[11]等)提取物分离分析方面的文献报道不断增多,但尚未见白藜芦醇苷分子印迹聚合物的相关报道。
白藜芦醇苷(Polydatin,POL),又称虎杖甙,即3,4',5-三羟基芪3-O-β-D葡萄糖苷(3,4',5-Trihydroxystilbene-3-β-D-glucopyranoside),为羟基二苯乙烯类化合物,亦是芪类化合物,是从我国传统中药虎杖中分离得到的化学成分,具有明显的抗菌、抗炎、抗肿瘤、抗高血脂症、抗脂质过氧化、抗血栓形成等多种活性[12-14]。白藜芦醇苷和白藜芦醇的活性相似,均为虎杖芪类成分中的主要活性成分。白藜芦醇苷在肠道中糖苷酶的作用下可释放出白藜芦醇。
本课题组曾以白藜芦醇为模板分子制备分子印迹聚合物,研究其结合选择性能并用于虎杖提取液中白藜芦醇的分离纯化,效果良好[15]。在虎杖提取物中,白藜芦醇苷的含量远远高于白藜芦醇,为进一步揭示分子印迹聚合物的分子识别效应,本实验以白藜芦醇苷为模板分子,通过选择不同的功能单体,采用本体聚合法制备分子印迹聚合物,研究分子印迹聚合物的分子识别性能,并将其应用于虎杖提取物中白藜芦醇苷的固相萃取分离,为分子印迹聚合物在中药复杂样品中的研究及应用提供了一定的实验基础。
1 实验部分
1.1 仪器与试剂
TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);KQ3200DE型数控超声波清洗器、DF-101S集热式恒温加热磁力搅拌器、201升降恒温水浴锅、DZF6010真空干燥箱、TG-16G型冷冻离心机(巩义市予华仪器有限公司);DHG-9140A型电热恒温鼓风干燥箱(上海浦东丰科学仪器有限公司);JA2003型电子天平(上海上天精密仪器有限公司)。
虎杖(Polygonum cuspidatum Sieb.et Zucc.,广州中药材公司);白藜芦醇苷(POL,中国药品生物制品鉴定所);白藜芦醇(RES,Sigma公司 );4-乙烯基吡啶(4-VP,Sigma公司)、甲基丙烯酸羟乙酯(HEMA)、甲基丙烯酸(MAA)、二甲基丙烯酸乙二醇酯(EGDMA)均购自梯希爱(上海)化成工业发展有限公司;偶氮二异丁腈(AIBN,上海试四赫维化工有限公司),使用前用甲醇重结晶;双酚 A(BPA)、丙烯酰胺(AM)、四氢呋喃(THF)、N,N-二甲基甲酰胺(DMF)、乙腈、甲醇均为分析纯试剂;实验用水为二次蒸馏水。
1.2 分子印迹聚合物的制备
聚合物的合成采用本体聚合方法,以POL为模板分子,分别以AM、4-VP、HEMA、MAA为功能单体,AIBN为引发剂进行自由基引发聚合。称取0.195 g(0.5 mmol)POL和3 mmol功能单体充分溶解于3 mL THF或DMF中,于安培瓶中超声10 min后,放置3 h,使模板分子与功能单体充分发生作用,再加入3 g(15 mmol)交联剂EGDMA和0.033 g引发剂AIBN,充分混溶后,通N2脱氧10 min,在真空状态下密封。将密封好的安培瓶于60℃下聚合24 h,所得的棒状聚合物用研钵磨碎并过75 μm孔筛,用10%(体积分数)乙酸的甲醇溶液置于索氏提取器中提取,除去模板分子及未反应的化合物,直至萃取液中检测不到模板分子。然后用乙醇洗涤除去残留的乙酸,聚合物颗粒经丙酮反复沉降,除去细粒后,60℃下真空干燥至恒重,即为白藜芦醇苷分子印迹聚合物MIPs。
除不加模板分子POL外,其余步骤同上制备非分子印迹聚合物NIPs。
1.3 结合实验
称取40 mg聚合物于离心管中,向其中加入4 mL 0.2 mmol/L的POL乙腈溶液后,于室温下振荡12 h,将振荡后的样品高速离心后移取出上层清液,用乙腈稀释至一定倍数后,用紫外可见分光光度计于305 nm处测定其中游离POL的浓度,根据吸附前后底物溶液浓度的变化,计算印迹聚合物的平衡吸附量Q(μmol/g)。
1.4 选择性实验
分别以POL、RES、BPA为底物,在0.2 mmol/L的乙腈溶液中进行平衡吸附实验,用紫外-可见分光光度计分别测定上清液中各底物的浓度。根据结合前后底物的浓度变化,计算印迹聚合物对各底物的平衡吸附量Q。
1.5 固相萃取小柱的制备及虎杖提取液的制备
取两支SPE商品柱,倒空其中的吸附剂,分别加入500 mg干燥的MIP1和NIP1,盖紧筛板,用10 mL甲醇平衡。称取1 g虎杖粗粉,加入100 mL 80%乙醇回流提取2 h,过滤,滤液减压浓缩至干,用甲醇溶解,取上清液,即得虎杖提取液。
1.6 分子印迹固相萃取分离虎杖提取物中的POL
取1 mL虎杖提取液上样于填充有MIP1和NIP1的SPE柱中,依次用5 mL甲醇淋洗、5 mL甲醇-冰醋酸(9∶1,体积比)洗脱,流速为0.2 mL/min。流出液收集后用氮气吹干,残留物用流动相溶解后进行HPLC分析。色谱条件:色谱柱为Agilent C18柱(250 mm×4.6 mm,5 μm),流动相为乙腈-水(23∶77),进样量为10 μL,流速为1.0 mL/min,检测波长为303 nm。
2 结果与讨论
2.1 MIP的制备
由于氢键是聚合中配合物形成的主要作用力,因此需要考虑溶剂对模板分子与功能单体形成氢键的影响。采用乙腈为溶剂制备白藜芦醇分子印迹聚合物,但实验发现,由于POL含有多个酚羟基以及葡萄糖基,具有较大的极性,使得其在乙腈中的溶解性有限,无法以乙腈为溶剂进行本体聚合;虽然POL在甲醇中的溶解性优于在乙腈中的溶解性,但甲醇是质子型极性溶剂,会干扰模板分子与功能单体的氢键作用;经反复实验发现,POL在THF中有较好的溶解性,可用于聚合反应。
为考察不同的功能单体对聚合物识别性能的影响,实验分别以碱性4-VP、中性HEMA、丙烯酰胺以及酸性MAA为功能单体,制备分子印迹聚合物,除4-VP因在THF中不能完全溶解而选择以DMF为溶剂外,其余聚合物均以THF为溶剂进行聚合,分子印迹聚合物的聚合条件见表1。
2.2 分子印迹聚合物的吸附特性及选择性
使用静态平衡结合法,考察了4种聚合物在4 mL 0.2 mmol/L的POL乙腈溶液中的结合量。同时,选择与POL分子结构相似的RES和BPA为底物(分子结构如图1所示),考察了印迹聚合物对结构类似物的结合量,实验结果见表2。从表中可以看出,分子印迹聚合物对模板分子的结合量大于非印迹聚合物,并且印迹聚合物对模板分子的结合量大于其对结构类似物的结合量。为进一步说明印迹聚合物的印迹效应,引用两个参数α和ε[16],其中α为模板分子在MIP上的结合量与模板分子在NIP上的结合量之比,用以表征MIP中存在印迹孔穴,α值越大,印迹效应越好;ε是MIP对模板分子的结合量与MIP对结构类似物的结合量之比,用以表征MIP中印迹孔穴对模板分子的选择性,ε值越大,聚合物的选择性越好。从表2可以看出,4种印迹聚合物都有较大的α值,表明在印迹聚合物中存在印迹孔穴,因此相对于非印迹聚合物对模板分子的吸附量要大;同时,4种聚合物的ε值均大于1,表明印迹聚合物中的印迹孔穴对模板分子具有选择性。
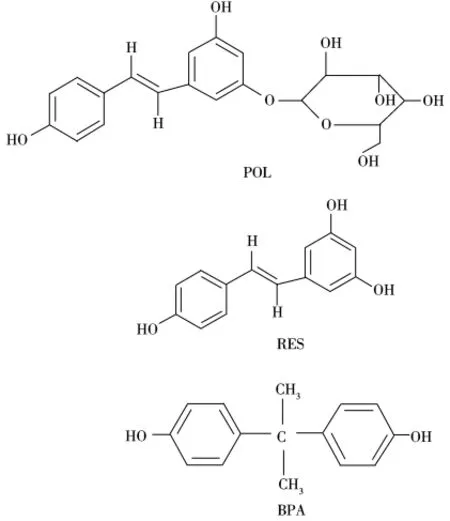
图1 POL、RES、BPA的分子结构式Fig.1 Molecular structures of POL,RES and BPA
通过进一步比较发现,4种印迹聚合物对模板分子的结合量大小顺序为:MIP1>MIP2>MIP3>MIP4,α值及ε值也有相似的规律,表明以AM为功能单体所得MIP1对模板分子的吸附量及选择性最好,其次是以4-VP为功能单体所得的 MIP2,以HEMA和MAA为功能单体的MIP3和MIP4的吸附量及选择性较差。从白藜芦醇的结构可以看出,与功能单体发生相互作用的基团主要是酚羟基。研究表明,在极性溶剂中酰胺比羧酸能形成更强的氢键[17]。4-VP呈弱碱性,与POL之间除了氢键作用力外,还有离子键作用力,但由于在DMF溶剂中聚合,部分削弱了氢键作用力;MAA呈酸性,与酚羟基作用力最弱,所以识别能力最差,说明功能单体与模板分子之间的相互作用力强弱对MIP的识别能力有较大的影响。功能单体与模板分子的相互作用力越强,所合成出的分子印迹聚合物对模板分子的识别性能越好,反之亦然。
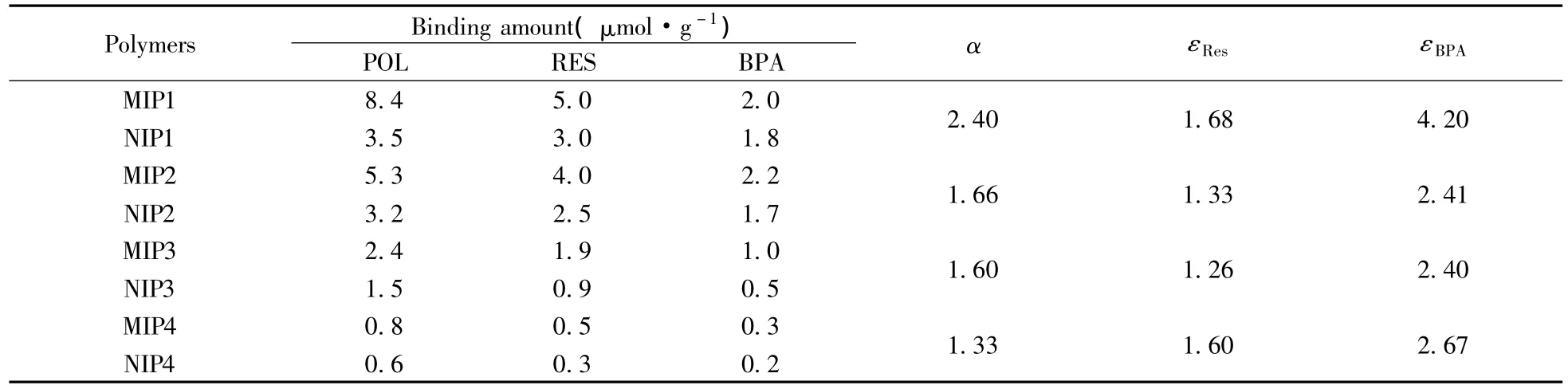
表2 聚合物对POL、RES及BPA的结合能力Table 2 Binding capabilities of imprinted polymers to POL,RES and BPA

图2 分子印迹聚合物及非分子印迹聚合物的吸附等温线Fig.2 Adsorption isotherms of MIP1 and NIP1
2.3 分子印迹聚合物吸附等温线及Scatchard分析
上述实验表明,MIP1具有最好的结合性能和选择性能,为了进一步研究MIP1的吸附特性,使用静态平衡结合法,分别测定MIP1及NIP1对不同浓度POL的结合量,以Q对C0作图,得到MIP1及NIP1对POL的吸附等温线,如图2所示。从图2可知,MIP1对模板分子的吸附量大于NIP1对模板分子的吸附量。表明与化学组成相同的相应非模板聚合物相比,MIP1对POL有较大的吸附性能和高度的选择性。这种分子识别特性来自于该聚合物的结合基团与模板分子的功能基之间的氢键作用和空穴的几何选择性。
进一步采用Scatchard模型评价分子印迹聚合物的结合特性,Scatchard方程如下:Q/C=(Qmax-Q)/Kd,其中,Kd为结合位点的平衡离解常数,Qmax代表结合位点的最大结合量,C表示底物在上清液中的平衡浓度。以Q/C对Q作图,可以得到聚合物的平衡离解常数Kd及最大表观结合位点数Qmax。对上述吸附实验结果进行Scatchard分析,结果如图3所示。从图3看出,Scatchard曲线分为两段,2条不同斜率的直线分别呈现良好的线性,说明在所研究的模板分子浓度范围内,聚合物主要形成2种不同的结合位点,即高亲和力位点和低亲和力位点。由斜率和截距可求出:高亲和力结合位点离解常数Kd1=7.43×10-5mol/L,饱和结合位点数 Qmax1=10.40 μmol/g;低亲和力结合位点离解常数 Kd2=3.70×10-3mol/L,饱和结合位点数 Qmax2=111.93 μmol/g。
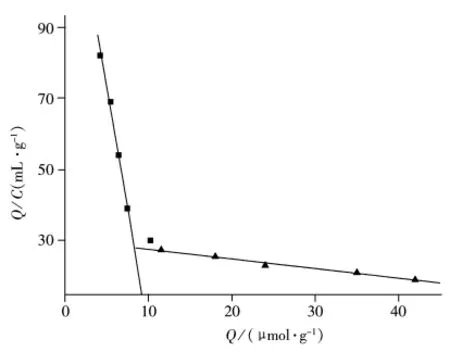
图3 分子印迹聚合物MIP1的Scatchard曲线Fig.3 Scatchard plots of MIP1
2.4 分子印迹聚合物对混合底物的选择结合性能
研究了MIP1对白藜芦醇苷、白藜芦醇和双酚A混合底物的选择结合性能,结果见表3。从表3可见,在混合底物中,MIP1对模板分子POL的结合量大于NIP1对POL的结合量,且MIP1对模板分子POL的结合量大于其它两种结构类似物RES和BPA的结合量,表明MIP1对模板分子产生了明显的印迹效应,对模板分子POL具有选择性识别作用。同时,由于RES在结构上与模板分子POL具有相似性,所以MIP1对RES也有较大的结合量;BPA的结构与POL相差较大,因此MIP1对BPA的结合量较小,表明结构类似物的结构与模板分子结构差别越大,MIP对模板分子的选择性识别性能越好。从文献[15]所报道RES分子印迹聚合物的识别性能也能得到这一结论。另外,对比表3的数据发现,MIP1对混合底物的吸附量小于对单个底物的吸附量,原因可能是在混合底物中,聚合物的结合性能受到竞争性吸附的影响。
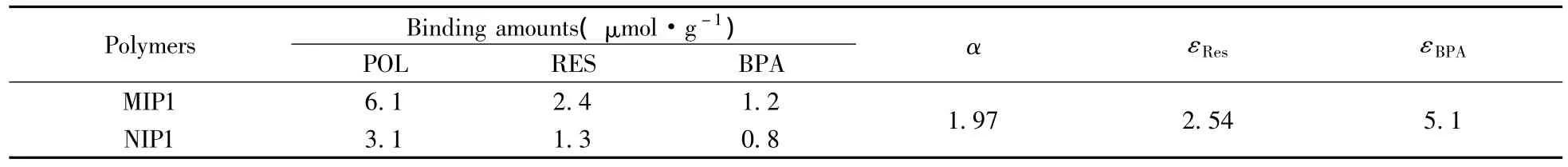
表3 分子印迹聚合物对POL、RES及BPA混合底物的结合能力Table 3 Binding capability of molecularly imprinted polymers to mixed substrates of POL,RES and BPA
2.5 分子印迹固相萃取分离虎杖提取物中POL
采用固相萃取小柱对POL标准溶液进行分离。取1.0 mL 0.2 mmol/L的POL甲醇溶液加入柱中,以5 mL甲醇淋洗,5 mL甲醇-冰醋酸(9∶1)洗脱,流速为0.2 mL/min,流出液经HPLC分析测定含量,结果见表4。从表4可见,对于MIP1-SPE柱,在上样流出液及淋洗液中,POL含量很少,表明大部分POL被萃取柱吸附,而在洗脱液中,POL含量较高,表明被萃取柱吸附的POL可被洗脱液洗脱下来,即MIP1-SPE柱可实现对POL的良好分离。而对于NIP1-SPE柱,POL在淋洗液中即被大部分洗下来,而在洗脱液中的含量很低,表明NIP1-SPE柱对POL不具有选择性吸附分离效果。
将上述的MIP1-SPE柱用于虎杖提取液中POL的分离。取1.0 mL虎杖提取液上样于填充有MIP1的SPE柱中。分别对虎杖提取液、上样流出液以及洗脱液进行HPLC分析,从HPLC图看出,虎杖提取物中含有POL、RES等成分(见图4),通过MIP柱后,POL被吸附,在上样流出液中未检测到POL,同时RES也被部分吸附(见图5A);在甲醇淋洗液中,未检测到POL的信号(见图5B),而在甲醇-冰醋酸(9∶1)的洗脱液中能观察到POL的色谱峰及少量RES色谱峰(见图5C)。同样,将虎杖提取物吸附在NIP1上,几乎所有成分在甲醇淋洗液中均能检测到,其色谱图与虎杖提取物的色谱图无明显差异。而在洗脱液中也未检测到POL,以上结果说明,MIP1能特异性地吸附虎杖提取物中的POL,可用于虎杖提取物复杂样品中POL的分离富集。

表4 POL在上样流出液、淋洗液及洗脱液中的含量百分比Table 4 Percentages of POL collected from the loading solution,washing solution and eluting solution
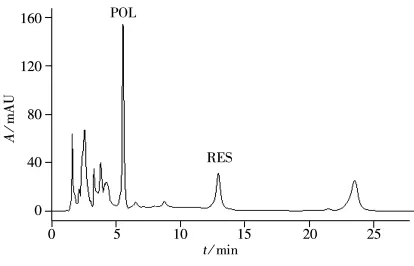
图4 虎杖提取液的色谱图Fig.4 Chromatogram of the Polygonum cuspidatum Sieb.et Zucc.extracts
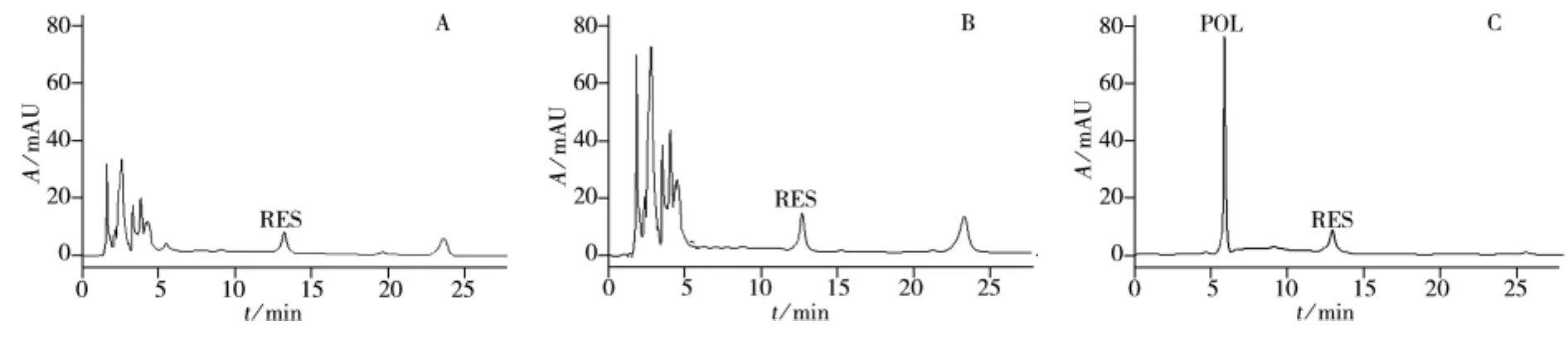
图5 上样流出液(A)、淋洗液(B)及洗脱液(C)的色谱图Fig.5 Chromatograms of MIP1-SPE loading(A),washing(B)and eluting(C)solutions
3 结论
本文以白藜芦醇苷为模板分子,分别以AM、4-VP、HEMA、MAA为功能单体,EGDMA为交联剂,AIBN为引发剂,采用本体聚合法制备了白藜芦醇苷分子印迹聚合物,采用静态平衡结合实验研究了聚合物的识别能力。研究表明,以AM为功能单体合成的聚合物对模板分子的识别性能最好,其次是以4-VP为功能单体合成的MIP2,以HEMA为功能单体的MIP3以及以MAA为功能单体的MIP4的识别性能较差。功能单体与模板分子主要通过离子键和氢键发生作用,这种相互作用力的强弱对MIP的识别能力有较大的影响。对聚合物MIP1的吸附特性及选择性的进一步考察也表明,MIP1分子印迹聚合物对模板分子呈现较好的结合能力和选择能力,将MIP1作为固相萃取柱吸附剂,能有效富集分离虎杖提取物中的白藜芦醇苷。
[1]Hu X G,Li G K.Chin.J.Anal.Chem.(胡小刚,李攻科.分析化学),2006,34(7):1035-1041.
[2]Tang K J,Gu X H,Tao G J,Qin F,Tang J,Xia Y M.J.Instrum.Anal.(汤凯洁,顾小红,陶冠军,秦芳,汤坚,夏咏梅.分析测试学报),2009,28(12):1401-1404.
[3]Alizadeh T,Ganjali M R,Zare M,Norouzi P.Food Chem.,2012,130(4):1108-1114.
[4]Lü Y K,Wang L M,Yang L,Zhao C X,Sun H W.J.Chromatogr.A,2012,1227(2):48-53.
[5]Saumya V,Prathish K P,Rao T P.Talanta,2011,85(2):1056 -1062.
[6]Liu X F,Yao B,Liu G Y,Cai C Y.J.Instrum.Anal.(刘晓芳,姚冰,刘国艳,柴春彦.分析测试学报),2010,29(11):1121-1125.
[7]Xiang H Y,Li W G.Electroanalysis,2009,21(10):1207 -1210.
[8]Huang D D,Li L,Yin Y G,Zhu Q H.Sci.China B(黄丹丹,李莉,殷勇冠,朱全红.中国科学B辑),2010,40(6):794-800.
[9]Li X Y,Tong H J,Lei F H,Pang J,Feng J,Li M.China Tradit.Herbal Drugs(李小燕,仝海娟,雷福厚,庞洁,俸吉,李梅.中草药),2012,43(4):795-798.
[10]Cirillo G,Curcio M,Parisi O I,Puoci F,Iemma F,Spizzirri U G ,Restuccia D,Picci N.Food Chem.,2011,125(3):1058-1063.
[11]Lopez C,Claude B,Morin P,Max J P,Pena R,Ribet J P.Anal.Chim.Acta,2011,683(2):198-205.
[12]Zhou J J.Northwest Pharm.J.(周建军.西北药学杂志),2000,15(2):86-88.
[13]Miao Q,Wang S W,Miao S,Wang J B,Xie Y H,Yang Q.Phytomedicine,2011,19(1):8-12.
[14]Zhang H F,Dou C G,Liu X H,Gu F F.Prog.Pharm.Sci.(张海防,窦昌贵,刘晓华,顾菲菲.药学进展),2003,27(4):230-233.
[15]Xiang H Y,Zhou C S,Zhong S A,Lei Q F.Chin.J.Appl.Chem.(向海艳,周春山,钟世安,雷启福.应用化学),2005,7:739-743.
[16]Cirillo G,Iemma F,Puoci F,Parisi O I,Curcio M,Spizzirri U G.J.Drug Target.,2009,17(1):72–77.
[17]Yu C,Mosbach K.Anal.Lett.,1997,62:21 -22.
