喉癌患者血清HMGB1水平检测及临床意义
2013-11-24汤夏冰沈晓辉陈国千
汤夏冰,李 蕾,沈晓辉,陈国千*
(1.南京医科大学附属无锡人民医院 耳鼻咽喉科,江苏 无锡214023;2.南京医科大学附属无锡人民医院 医学检验科,江苏 无锡214023;3.南京医科大学附属鼓楼医院 耳鼻咽喉科,江苏 南京210008)
研究表明,高迁移率族蛋白B1(HMGB1)作为一种核内非组蛋白,在肿瘤的发生、发展及转移中起着重要的作用。HMGB1在结肠癌、乳腺癌、前列腺癌、非小细胞肺癌、胰腺癌等人类恶性肿瘤组织中,均出现过度表达,并与肿瘤发生、发展以及患者预后等密切相关[1]。新近有研究显示,血清HMGB1水平在胃癌、肝癌、非小细胞肺癌、宫颈癌中升高,可以作为血清标志物,为评估肿瘤的进展和预后提供重要价值[2-5],但在喉癌中尚未见报道。本研究通过检测喉癌患者血清HMGB1水平,探讨HMGB1在喉癌发生、发展中的作用,为喉癌的临床诊断、治疗提供实验室检测标志物及理论依据。
1 材料与方法
1.1 临床资料
选取2011-01—2011-11南京市鼓楼医院耳鼻咽喉科31例喉癌患者血清标本,患者术前未经任何治疗。术后病理证实为鳞状上皮细胞癌。其中男30例,女1例,平均年龄61.6±7.2岁;声门上型16例,声门型13例,声门下型2例;TNM分期(UICC 2002)T1-2期为12例,T3-4期为19例;临床分期:Ⅰ+Ⅱ期7例,Ⅲ+Ⅳ期24例;颈部淋巴结转移15例;病理学分级:低分化4例,中分化19例,高分化8例。同时选取15例喉部癌前病变声带白斑患者血清标本,其中男12例,女3例,平均年龄58.9±6.2岁;30例健康志愿者血清标本作为对照组,其中男27例,女3例,平均年龄59.7±5.7岁。
1.2 检测方法
血清HMGB1浓度测定:采用酶联免疫吸附试验(ELISA)检测[6],血液标本采集后<3h分离血清,并于-80℃ 冰箱保存,人HMGB1ELISA试剂盒为日本Shino-Test公司产品,按产品使用说明书进行分析定量。
1.3 统计学处理
应用SPSS18.0统计软件进行数据分析。两组间比较采用双侧t检验分析,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 喉癌患者等血清HMGB1水平的分析
31例喉癌患者、15例声带白斑患者、30例健康对照者血清HMGB1水平比较,差异具有统计学意义;喉癌患者、声带白斑患者血清HMGB1水平明显高于健康对照者(P<0.01);喉癌患者血清HMGB1水平明显高于声带白斑患者(P<0.01)。见表1。
表1 喉癌、声带白斑患者血清HMGB1水平(±s)
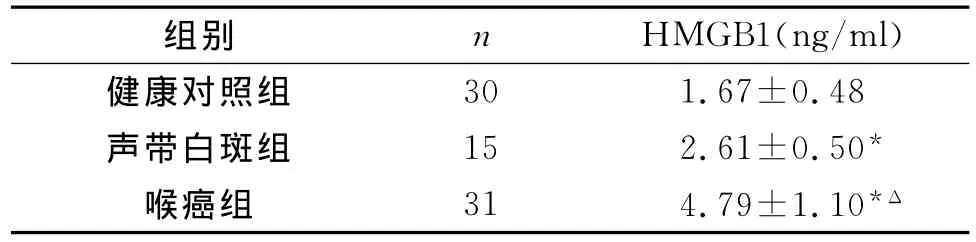
表1 喉癌、声带白斑患者血清HMGB1水平(±s)
注:与健康对照组比较,*P<0.01;与声带白斑组比较,ΔP<0.01
组别 n HMGB1(ng/ml)30 1.67±0.48声带白斑组 15 2.61±0.50*喉癌组 31 4.79±1.10*Δ健康对照组
2.2 喉癌患者血清HMGB1水平与临床病理特征的关系
喉癌患者血清HMGB1水平与临床病理特征的关系,见表2。血清HMGB1水平在T3和T4期明显高于T1和T2期(P<0.01);血清HMGB1水平在Ⅲ和Ⅳ期明显高于Ⅰ和Ⅱ期(P<0.01);血清HMGB1水平在淋巴结转移组明显高于无淋巴结转移组(P<0.01)。但血清HMGB1水平与肿瘤的原发部位、分化程度均无关(P值均>0.05)。
3 讨论
高迁移率族蛋白(HMG)为一类核内非组蛋白,因其在聚丙烯酰胺凝胶电泳中迁移速度快而得名,HMGB1是其中重要的成员之一。HMGB1最初被认为是染色质的结构成分,功能局限在核内,主要参与稳定核小体结构、调节基因转录、参与DNA修复、DNA重组及调控类固醇激素等生命活动。1999年,Wang等[7]首先发现HMGB1可以释放到胞外并介导炎症反应,是一种重要的晚期炎症介质。近年胞外HMGB1测定的临床应用研究已引起广泛关注,HMGB1在结肠癌、乳腺癌、前列腺癌、非小细胞肺癌、胰腺癌等人类恶性肿瘤中,均出现过度表达,并与肿瘤发生、发展以及患者预后等密切相关。肿瘤标志物的测定往往可提供一种低成本、非侵入的手段,用于肿瘤患者的疗效监测及预后评估,也常用于高危人群的筛查。在某些肿瘤中,通过检测患者血清中肿瘤标志物的含量及其变化可以反映肿瘤的发生、发展和增殖情况。新近有研究显示,血清HMGB1水平在胃癌、肝癌、非小细胞肺癌、宫颈癌中升高,为评估肿瘤的进展和预后提供重要价值,但血清HMGB1水平在喉癌中的变化目前未见报道。
表2 喉癌患者血清HMGB1水平与临床病理特征的关系(±s)
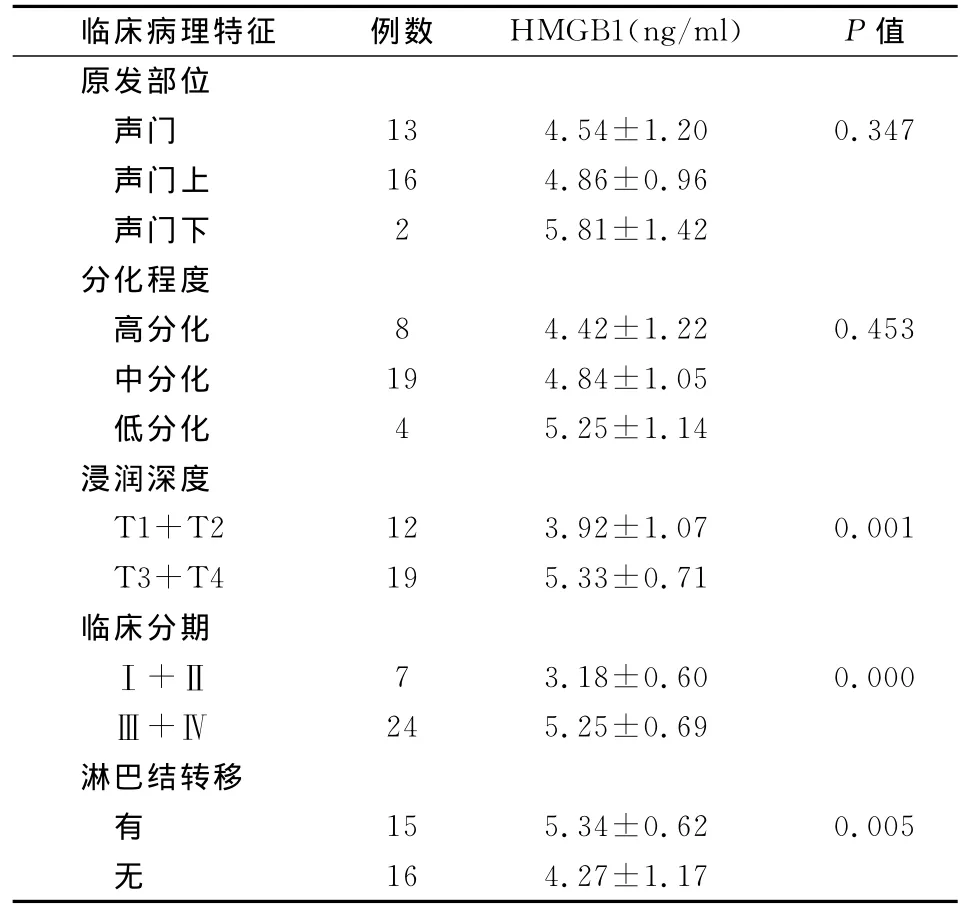
表2 喉癌患者血清HMGB1水平与临床病理特征的关系(±s)
临床病理特征 例数 HMGB1(ng/ml) P值原发部位声门 13 4.54±1.20 0.347声门上 16 4.86±0.96声门下 2 5.81±1.42分化程度高分化 8 4.42±1.22 0.453中分化 19 4.84±1.05低分化 4 5.25±1.14浸润深度T1+T2 12 3.92±1.07 0.001 T3+T4 19 5.33±0.71临床分期Ⅰ+Ⅱ 7 3.18±0.60 0.000Ⅲ+Ⅳ 24 5.25±0.69淋巴结转移有15 5.34±0.62 0.005无16 4.27±1.17
在我们前期的研究中显示,HMGB1在喉癌组织及癌旁正常组织中阳性表达率分别为78.7%和18.0%。本研究通过检测血清HMGB1水平发现,喉癌患者、声带白斑患者血清HMGB1水平明显高于健康对照者,喉癌患者血清HMGB1水平明显高于声带白斑患者,血清HMGB1水平升高可能由于坏死的肿瘤细胞被动释放或免疫细胞主动分泌到胞外或血浆。说明HMGB1在喉癌的发生中起重要作用,且有利于区分喉癌前病变、喉癌患者。研究结果表明,喉癌患者血清HMGB1水平与临床病理特征的关系密切,血清HMGB1水平在T3和T4期明显高于T1和T2期;血清HMGB1水平在Ⅲ和Ⅳ期明显高于Ⅰ和Ⅱ期;血清HMGB1水平在淋巴结转移组明显高于无淋巴结转移组。提示HMGB1在喉癌的发展、浸润及转移中起着重要的作用。Taguchi等[8]报道,HMGB1可通过与糖基化终末产物受体RAGE结合,激活p38、JNK及ERK1/2等丝裂原活化蛋白激酶信号通路,继而激活MMP-2、MMP-9,后二者是纤维蛋白溶酶激活级联的下游目标,能引起细胞外基质降解,从而促进肿瘤的浸润及转移,HMGB1在喉癌中作用的具体机制有待进一步研究。本研究未发现血清HMGB1水平与肿瘤的原发部位、分化程度有关。由于本研究中研究样本量相对较少,可能与真实分布情况有一定的误差,对于其临床应用价值需要通过扩大样本量进一步研究。
本实验研究结果表明,喉癌患者血清HMGB1水平升高,血清HMGB1水平检测可作为评价喉癌前病变、喉癌患者病情变化的生物学指标,有望成为喉癌诊断和治疗的一个新靶点。
[1]Sims GP,Rowe DC,Rietdijk ST,et al.HMGB1and RAGE in inflammation and cancer[J].Annu Rev Immunol,2010,28:367.
[2]Chung HW,Lee SG,Kim H,et al.Serum high mobility group box-1(HMGB1)is closely associated with the clinical and pathologic features of gastric cancer[J].Journal of Translational Medicine,2009,7:38.
[3]Cheng BQ,Jia CQ,Liu CT,et al.Serum high mobility group box chromosomal protein 1is associated with clinicopathologic features in patients with hepatocellular carcinoma[J].Digestive and Liver Disease,2008,40(6):446.
[4]Shang GH,Jia CQ,Tian H,et al.Serum high mobility group box protein 1as a clinical marker for non-small cell lung cancer[J].Respir Med,2009,103(12):1949.
[5]Sheng X,Du X,Zhang X,et al.Clinical value of serum HMGB1 levels in early detection of recurrent squamous cell carcinoma of uterine cervix:comparison with serum SCCA,CYFRA21-1,and CEA levels[J].Croat Med J,2009,50(5):455.
[6]Yamada S,Inoue K,Yakabe K,et al.High mobility group protein 1(HMGB1)quantified by ELISA with a monoclonal antibody that does not cross-react with HMGB2[J].Clin Chem,2003,49(9):1535.
[7]Wang H,Bloom O,Zhang M,et al.HMG-1as a late mediator of endotoxin lethality in mice[J].Science,1999,285(5425):248.
[8]Taguchi A,Blood DC,del Toro G,et al.Blockade of RAGE-amphoterin signaling suppresses tumour growth and metastases[J].Nature,2000,405(6784):354.
