血清MMP-13及TIMP-1检测对原发性肝癌的早期诊断价值
2013-11-24张建忠朱建云包海燕邵玲玲钱引坤黄书明
张建忠,朱建云,包海燕,邵玲玲,徐 燃,钱引坤,黄书明
(1.如东县人民医院,江苏 如东226400;2.南通市第三人民医院,江苏 南通226001)
肝癌是我国常见恶性肿瘤之一,早期诊断及治疗对其预后具有重要意义。传统血清诊断标志物AFP及γ-谷氨酰转肽酶同工酶Ⅱ(GGT-Ⅱ)虽有较好的敏感性,但仍存在一定的假阳性[1],故寻找新的肝癌早期诊断标志物具有重要临床意义。基质金属蛋白酶-13(MMP-13)及其天然抑制剂基质金属蛋白酶组织抑制因子-1(TIMP-1)的表达存在明显的相关性,其与肝病的关系逐渐成为研究热点[2],本文采用ELISA法检测慢性肝炎、肝硬化以及原发性肝癌(PHC)患者血清中 MMP-13、TIMP-1水平,探讨其对早期肝癌的诊断价值。
1 资料与方法
1.1 一般资料
收集2010年1月-2011年12月南通市第三人民医院住院肝病患者共198例,其中慢性肝炎患者66例,男性42例,女性24例,年龄25-68岁;肝硬化患者76例,男性53例,女性23例,年龄26-69岁;原发性肝癌患者56例(TNM分期[3]:Ⅰ期14例,Ⅱ期16例,Ⅲ期13例,Ⅳ期13例),男性43例,女性13例,年龄30-66岁。慢性肝炎、肝硬化的诊断符合2000年9月中华医学会传染病与寄生虫病学分会于西安联合修订的《病毒性肝炎防治方案》的标准[4],原发性肝癌的诊断符合2001年9月中国抗癌协会肝癌专业委员会修订的《原发性肝癌的临床诊断与分期标准》[5]。所有病例HBsAg阳性并持续6个月以上,无合并甲、丙、丁、戊型等其他病毒性肝炎,无酒精性、药物性、自身免疫性或代谢性肝病,均除外其他 MIMP-13、TIMP-1增高的因素,如肿瘤、肺纤维化等。对照组60例为我院体检健康者(既往无肝病史,近期肝肾功能及腹部B超检查均为正常,血清 HBV标志物阴性),男性32例,女性28例,年龄26-68岁。
1.2 方法
1.2.1 标本采集 清晨空腹采集静脉血3ml,室温静置分离血清后置-80℃冰箱保存。
1.2.2 血清 MMP-13、TIMP-1测定 按试剂盒说明书ELISA法检测血清 MMP-13、TIMP-1(武汉博士德生物工程有限公司)含量。
1.2.3 血清AFP测定 采用化学发光法,仪器与试剂为美国雅培i2000全自动化学发光分析仪及其配套试剂。
1.2.4 统计学处理SigmaPlot 12.0统计软件对数据进行分析,计量资料经Kolmogorov检验符合正态分布并以(±s)表示,单因素方差分析比较各组间差异;率的比较采用χ2检验,当理论频数小于5时,采用Fisher确切概率法;Pearson相关分析各指标间相关性,ROC曲线确定各指标诊断界值。
2 结果
2.1 各组血清中 MMP-13、TIMP-1检测结果
MMP-13、TIMP-1在各组中水平依次为:原发性肝癌组>肝硬化组>慢性肝炎组>健康对照组,组间差异均有统计学意义(P<0.05)。原发性肝癌组TIMP-1/MMP-13的比值小于肝硬化组的比值(表1)。

表1 血清 MMP-13、TIMP-1水平在各组间的比较
2.2 ROC曲线分析 MMP-13、TIMP-1对原发性肝癌的诊断价值
根据ROC曲线(图1),确定 MMP-13(曲线下面积=0.93)及TIMP-1(曲线下面积=0.88)对良、恶性肝病的诊断界值分别为326μg/L及196.5 μg/L。以此为诊断界值,MMP-13及 TIMP-1对原发性肝癌的诊断敏感性、特异性分别为86%、82%及79%、84%。两者平行联合试验的敏感性、特异性分别为97%及69%,系列联合试验的敏感性、特异性分别为68%及97%(表2)。
2.3 MMP-13、TIMP-1对微小肝癌及不同 AFP水平肝癌的诊断价值
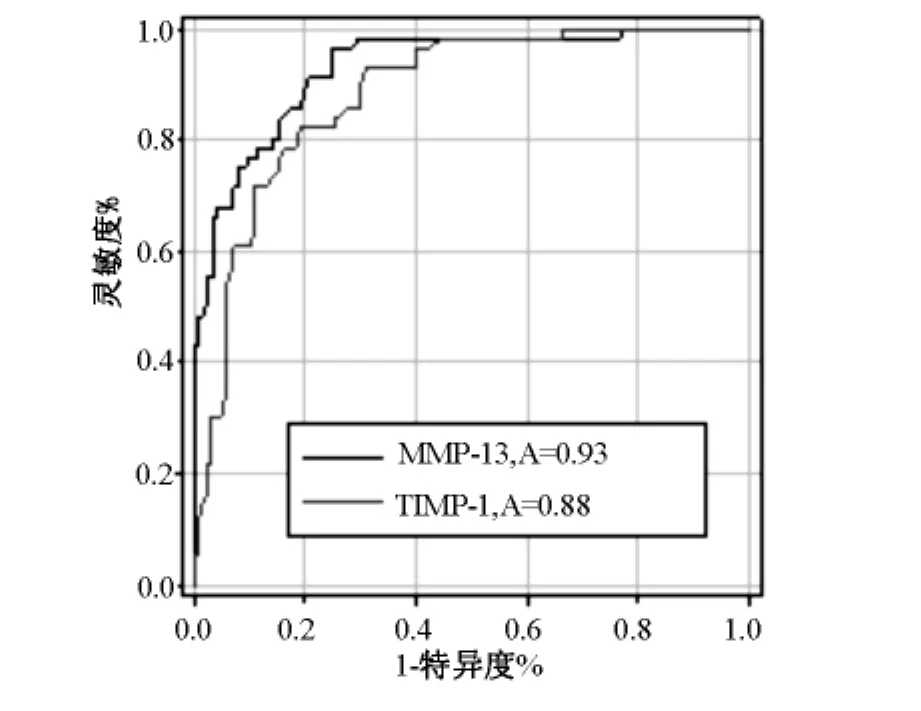
图1 血清MMP-13和TIMP-1诊断原发性肝癌的ROC曲线
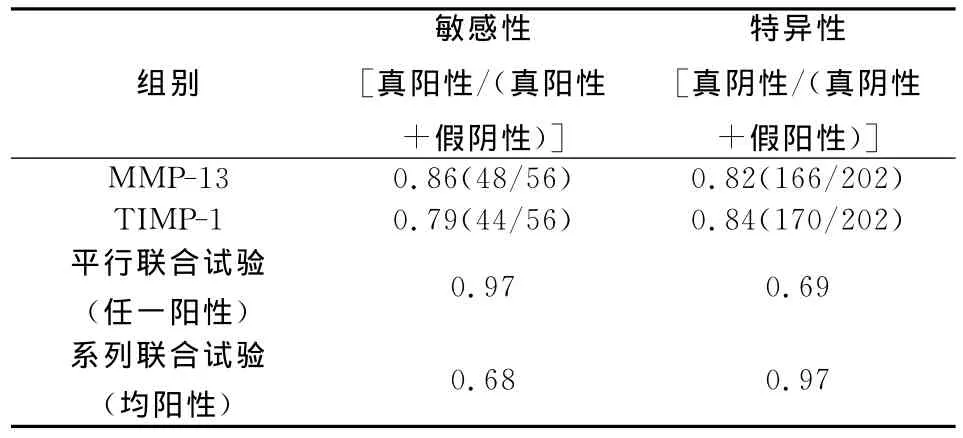
表2 血清MMP-13及TIMP-1对PHC的诊断敏感性及特异性(%)
各指标(其中AFP以≥200μg/L的两组总和计算)在微小肝癌(≤2cm)和>2cm肝癌组间比较差异均无统计学意义(P均 >0.05),MMP-13、TIMP-1单项或联合检测对不同大小肝癌的诊断敏感性均大于 AFP(P均<0.01,表3)。MMP-13、TIMP-1单项或联合检测在不同TNM分期、AFP组间比较差异均无统计学意义(P均>0.05,表4、表5)。

表3 MMP-13、TIMP-1及 AFP对微小肝癌的诊断价值 [μg/L;n(%)]
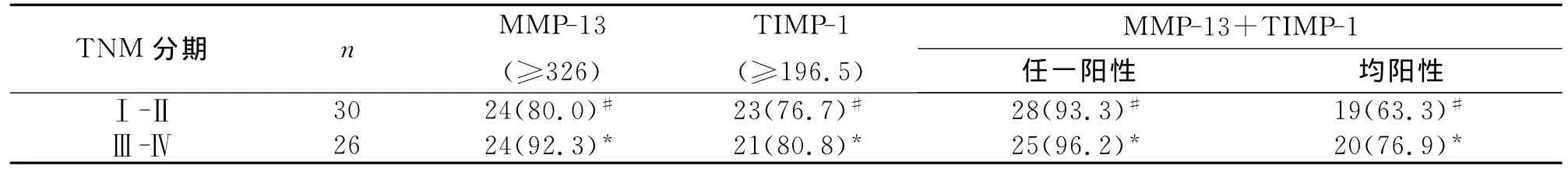
表4 MMP-13、TIMP-1对不同TNM 分期肝癌的诊断价值 [μg/L;n(%)]

表5 MMP-13、TIMP-1对不同 AFP水平肝癌的诊断价值 [μg/L;n(%)]
2.4 PHC患者 MMP-13、TIMP-1与AFP三者之间的相关性分析
MMP-13、TIMP-1之间的相关系数r为0.442(P<0.01);MMP-13与 AFP之间的相关系数r为0.241(P>0.05);TIMP-1与 AFP之间的相关系数r为0.039(P>0.05)。
3 讨论
MMP-13作为MMP家族的一员,其作用底物极为广泛,几乎可降解细胞外基质(matracellular matrix,ECM)的所有成分,其分解明胶的能力比MMP-1 和 MMP-8 强 40 倍[6]。MMP-13 在 乳 腺癌、头颈部鳞状上皮癌、皮肤癌、软骨瘤等其它肿瘤中均有高表达,并与肿瘤的侵袭和转移相关[7]。TIMP-1可抑制 MMPs及其酶原活化,从而造成MMPs降解活性降低、胶原纤维降解减少,是肿瘤发生恶变与转移的抑制因素[8]。
本研究中,原发性肝癌组 MMP-13及TIMP-1水平高于其他各组(P<0.01),说明随着疾病进展,MMP-13、TIMP-1水平呈上升趋势且原发性肝癌组MMP-13水平相对于TIMP-1上升的幅度比肝硬化组高。ROC曲线下面积越大,说明诊断价值越大,准确性越高,曲线下面积为0.5-0.7时,表示诊断的准确性较低;0.7-0.9时,中等;0.9以上时,准确性较高[9]。本研究显示 MMP-13及 TIMP-1ROC 曲线下面积分别为0.93、0.88,表明两者对PHC均有较高诊断价值且MMP-13优于TIMP-1。
MMP-13、TIMP-1的平行联合试验的敏感性、特异性分别为0.97、0.69;系列联合试验分别为0.68、0.97。在临床实际应用中,作为肝癌诊断性试验必须要有较高特异性[10],可选择系列联合试验,而在患者筛检以及动态观察时可选择平行联合试验以提高检测敏感性。
AFP对肝癌诊断阳性率仅60%左右,且存在一定的假阳性[11],故选择合适的互补诊断指标具有重要意义。本研究中MMP-13及TIMP-1单项或联合检测对在不同大小肿瘤的诊断阳性率均明显优于AFP(P<0.05),且其阳性率在肿瘤直径≤2cm及>2cm两组间以及不同TNM分期组间差异均无统计学意义(P>0.05)(表3、表4),表明对PHC诊断价值优于AFP且对微小肝癌、早期肝癌均有较高的诊断价值。此外从表5可以看出,MMP-13及TIMP-1单项或联合检测阳性率在不同AFP浓度组差异均无统计学意义(P>0.05),这进一步表明MMP-13及TIMP-1与AFP间无明显相关性,可作为AFP之外的肝癌血清诊断标志物。
影像学对微小肝癌有较高检出率[12],但局限性在于肿瘤已形成,不能作出预警,血清 MMP-13、TIMP-1联合检查利于疾病动态监测,由于 MMP-13、TIMP-1在良、恶性肝病中的差异表达,其动态检测有助于了解疾病的进展。血清 MMP-13、TIMP-1可望成为一种新的肝癌标志物,其在肝癌手术前后的变化及对复发的诊断价值尚需进一步研究。
[1]倪润洲,杨 磊,肖明兵,等.血清 HS-AFP GGT-II对肝癌患者手术预后判断的价值[J].中国肿瘤临床,2007,34(4):204.
[2]Cong M,Liu T,Wang P,et al.Suppression of tissue inhibitor of metalloproteinase-1by recombinant adeno-associated viruses carrying siRNAs in hepatic stellate cells[J].Int J Mol Med,2009 ,24(5):685.
[3]F.L.格林尼,D.L.佩基,I.D.弗莱明,等.AJCC癌症分期手册[M].第六版.沈阳:辽宁科学技术出版社,2005:133.
[4]中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎防治方案[J].中华传染病杂志,2001,19(1):56.
[5]中国抗癌协会肝癌专业委员会.原发性肝癌的临床诊断与分期标准[J].中华肝脏病杂志,2001,9(6):324.
[6]Gottschalk C,Malberg K,Arndt M,et al.Matrix metalloproteinases and TACE play a role in the pathogenesis of endometriosis[J].Adv Exp Med Biol,2000,477:483-486.
[7]Leeman MF,Curran S,Murray GI.The structure,regulation,and function of human matrix metalloproteinase-13[J].Crit Rev Biochem Mol Biol,2002,37(3):149.
[8]侯元婕,薛克修.基质金属蛋白酶及其抑制因子与组织纤维化的研究进展[J].新乡医学院学报,2006,23(2):204.
[9]陈卫中,倪宗瓒,潘晓平,等.用ROC曲线确定最佳临界点和可疑值范围[J].现代预防医学,2005,32(7):729.
[10]林果为,沈福民.现代临床流行病学[J].第2版.上海:复旦大学出版社,2008:49.
[11]方青青,倪润洲,肖明兵,等.肝癌组织和血清中半乳糖血凝素-3的表达及其意义[J].中华肝脏病杂志,2011,19(7):527-531.
[12]陈文军,程 明,王恩锋,等.多层螺旋CT对微小肝癌的诊断研究[J].哈尔滨医科大学学报,2011,45(1):67.
