抑癌基因IL-24在乳腺癌细胞中的表达及意义
2013-11-24李正祎郭素红孙可欣袁忠海
李正祎,李 艳,郭素红,孙可欣,李 欣,袁忠海
(吉林医药学院 检验系,吉林 吉林132013)
随着我国生活水平的不断提高,近年来乳腺癌增长趋势明显,并且出现了低龄化趋势[1]。乳腺癌发展的最终结果是出现全身的系统性转移,是导致乳腺癌患者死亡的主要原因,也是目前临床上的治疗难点。如何抑制乳腺癌的细胞生长,阻断癌细胞的侵袭与转移,是目前乳腺癌治疗研究的热点之一。癌症的发生发展是一个多步骤,多基因参与的过程,包括原癌基因的活化,抑癌基因的失活等许多相关基因的突变。近些年基因治疗已取得了较大成就,它被看成是对先天和后天基因疾病有效治疗的新途径[2]。
IL-24基因最初是从IFN和MEZ诱导分化的人黑色素瘤细胞中克隆来的,最初命名为 MDA-7(melanoma differentiation-associated antigen,MDA-7)[3]。人IL-24定位于1号染色体的1q32.2-q41。IL-24全长cDNA约为117kb,有一个编码206个氨基酸的完整开放读码框架,分子量为23.8 kD[4]。IL-24是一种既可特异抑制肿瘤细胞生长和血管形成,并靶向诱导肿瘤细胞凋亡,同时SU等[5]采用一系列方法深入研究还发现IL-24具有抗肿瘤旁杀伤效应。研究表明恶性乳腺癌组织IL-24基因呈显著性低转录和低表达,其降低程度与病理恶变程度相关[6]。本研究将IL-24基因转入 MDA-MB-231细胞中,以探寻其对乳腺癌细胞生长、侵袭转移及血管生成等方面的抑制作用。
1 材料与方法
1.1 材料
人乳腺癌细胞株 MDA-MB-231为本室保存;穿梭质粒pDC316-EGFP购自北京本元正阳基因技术有限公司,含有目的基因IL-24片段的穿梭质粒pDC316(pDC316-hIL-24-EGFP)由本室合成;质粒抽提和纯化试剂盒购自杭州博日科技有限公司;转染试剂脂质体Lipofectamine2000、Trizol试剂盒购自Invitrogen公司;新生小牛血清购自杭州赛乐生物科技公司;IL-24抗体购自abcam公司;PCR扩增的上下游引物由上海生工生物技术有限公司合成。
1.2 细胞转染
转染前24h将人乳腺癌MDA-MB-231细胞分别以每孔4×104、2×105接种到24、6孔板上,培养液为含10%胎牛血清的1640培养基。待细胞生长70%-80%时,按照转染试剂盒说明书,加入适量重组质粒进行转染,以空质粒pDC316-EGFP和未转染的细胞作为空白对照。
1.3 IL-24基因高表达的检测
1.3.1 倒置荧光显微镜 转染48h后24孔板观察细胞表达增强型绿色荧光蛋白(EGFP)的情况,判断转染效率。
1.3.2 RT-PCR检测IL-24、MMP-2、MMP-9基因的转录 转染48h后从6孔培养板收集各组细胞,用Trizol法分别抽提总RNA,分别用IL-24、MMP-2、MMP-9及内参 GAPDH 引物进行 RT-PCR,检测转染后外源性 IL-24 基因、内源性 MMP-2、MMP-9基因和内参GAPDH基因在 MDA-MB-231细胞中的转录。IL-24 引 物 为:上游 5′-GCACTCGAGCCATGAATTTTCAACAGAGGCTGCA-3′,下游5′-GCTTCT AGATCAGAGCTTGTAGAATTTCTG -3′,扩增片段长度620bp。MMP-2引物为:上游5′-GAATACCATCGAGACCATGCG-3′,下游 5′-GCCATACTT CACACGGACCAC-3′,扩增片段长度405bp。MMP-9引物为:上游5′-ACCTT CACTCGCGTGTACAGC-3′,下游 5′-GCGGAGTAGGATTGGCCTTG-3′,扩增片段长度439bp。GAPDH 引物为:上游5′-TGATGACATCAAGAAGGTGGTGAA-3′,下游5′-TCCTTGGAGGCCATGTGGGCC-3′,扩增片段长度240bp。
1.3.3 Western blot检测IL-24基因的表达 收集6孔板中转染后48h及空白对照组(PBS组)的细胞于EP管中。1 500r/min离心,PBS洗涤2-3次,各组细胞在裂解缓冲液中裂解。蛋白样品在10%SDS-PAGE胶中分离,再将凝胶蛋白转印到NC膜(硝酸纤维膜)上,经5%脱脂奶粉封闭1h后,分别加入鼠抗IL-24抗体(1∶1 000),37 ℃、2 h,然后加入辣根过氧化物酶标记的羊抗鼠IgG二抗,再用TBST洗膜5min×3次,最后加化学发光底物(ECL Plus),保鲜膜包裹后,于暗室内将该硝酸纤维素膜压于装有胶片的暗盒内,曝光、显影和定影。
1.4 结晶紫染色观察pDC316-hIL-24-EGFP对乳腺癌细胞的细胞毒性
将 MDA-MB-231细胞铺于24孔板,铺9孔。24h后加入适量重组质粒进行转染(pDC316-EGFP、pDC316-hIL-24-EGFP),37℃继续培养4天后吸净培养基,每孔加入500μl结晶紫染色液(2%结晶紫溶于20%甲醇溶液)染色15min,在净水中将多余的染液洗净,拍照。
1.5 ELISA测定 VEGF、Ang-1浓度
用pDC316-EGFP、pDC316-hIL-24-EGFP分别转染 MDA-MB-231细胞48h后,1 000r/min离心收集细胞培养上清,同时设细胞对照组。按ELISA试剂盒说明书测定各组细胞培养上清中VEGF、Ang-1的浓度。
1.6 统计学处理
实验重复至少3次,数据用±s表示,经SPSS11.0统计学软件分析,多组间差异显著性检验采用单因素方差分析,两组间比较采用t检验,*P<0.05为差异有统计学意义。
2 结果
2.1 基因转染结果
2.1.1 转染后EGFP 的表达 根据pDC316-EGFP的特点,转染pDC316-EGFP的细胞可表达EGFP,转染重组载体pDC316-hIL-24-EGFP 可 表 达IL-24及EGFP蛋白。荧光显微镜下观察,转染后各时段均可见绿色荧光,48h后约60%-70%的细胞发出绿色荧光。转染pDC316-EGFP的细胞荧光相对明亮,转染pDC316-IL-24-EGFP的细胞荧光较弱(见图1)。
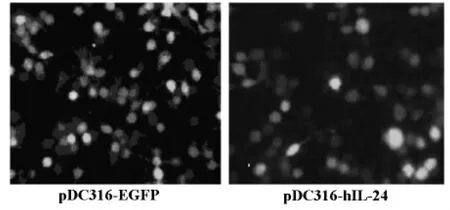
图1 pDC316转染MDA-MB-231细胞荧光照片(×100)
2.1.2 RT-PCR 检测IL-24基因转录 转染48h后从6孔培养板收集各组细胞,提取各组总RNA。用IL-24引物进行RT-PCR,经琼脂糖凝胶电泳后显示,pDC316-hIL-24组的IL-24、GAPDH 出现阳性条带;空载体组和PBS组均只有GAPDH出现阳性条带(见图2);说明pDC316-hIL-24中的目的基因IL-24能在 MDA-MB-231乳腺癌细胞中有效转录。

图2 RT-PCR 检测IL-24mRNA 表达
2.1.3 Western bolt检测IL-24基因在 MDA-MB-231细胞中的表达 MDA-MB-231乳腺癌细胞转染质粒48h后,分别收集3组细胞做Western blot分析,结果显示各组都见有内参照条带β-actin,但只有pDC316-hIL-24组在相对分子质量为24 000左右处有特异性条带(见图3)。
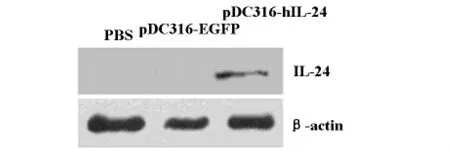
图3 各组 MDA-MB-231细胞系IL-24蛋白表达
2.2 细胞毒性实验结果
结晶紫是一种能够对正常细胞染色而不能对死亡或凋亡细胞染色的试剂。从图4可以看出,24孔板中转染了pDC316-hIL-24的 MDA-MB-231乳腺癌细胞比转染空质粒组(pDC316-EGFP)及细胞对照组的结晶紫着色浅很多,说明pDC316-hIL-24对肿瘤细胞的毒性作用比pDC316-EGFP强。而pDC316-EGFP 空载体对 MDA-MB-231乳腺癌细胞几乎无毒性作用。
2.3 IL-24诱导乳腺癌细胞侵袭和转移相关基因转录水平的变化
pDC316-hIL-24转染 MDA-MB-231细胞72h后,与细胞对照PBS组和pDC316-EGFP组相比(见图5),pDC316-IL-24组的 MDA-MB-231细胞中的MMP-2、MMP-9基因表达明显下调。
2.4 IL-24对血管形成素 Ang-1、血管内皮生长因子VEGF表达的影响
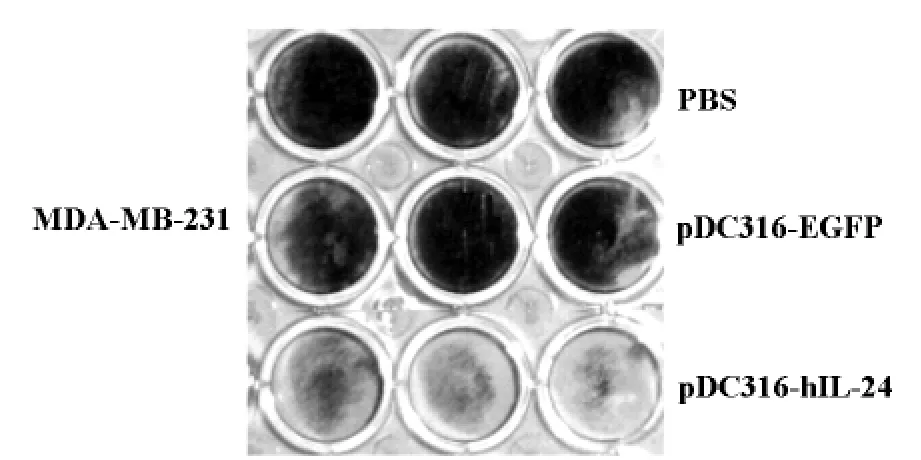
图4 IL-24对 MDA-MB-231细胞的作用
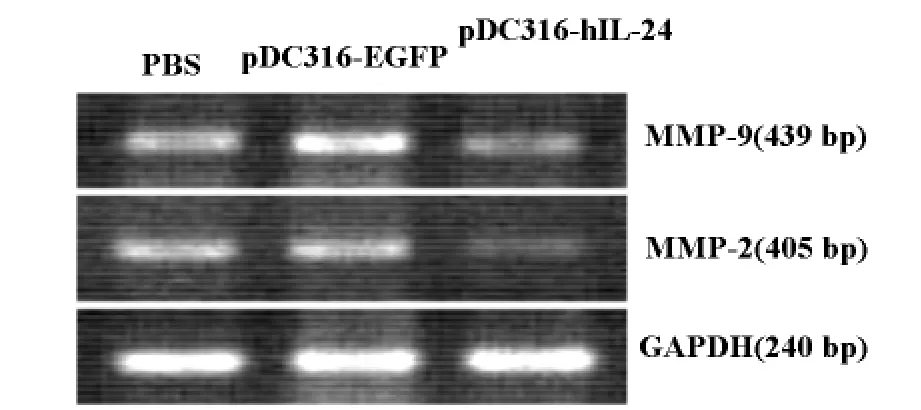
图5 RT-PCR分析 MDA-MB-231乳腺癌细胞MMP-2和 MMP-9的 mRNA转录水平
MDA-MB-231细胞分别用pDC316-EGFP、pDC316-hIL-24转染处理48h后收取培养上清,经ELISA检测,结果显示(见图6):pDC316-hIL-24组MDA-MB-231乳腺癌细胞 Ang-1分泌表达(pg/ml)为(205.6±50.7)与 PBS 组 (457.1±75.6)及pDC316-EGFP组(440.6±68.3)比较,培养上清中血管形成素Ang-1的水平显著减少(*P<0.05)。而PBS组及pDC316-EGFP组比较Ang-1表达水平差异不明显(P>0.05)。VEGF分泌表达(pg/ml)为(1823±325)与 PBS组(3550±509)及pDC316-EGFP组(3627±524)比较,培养上清中VEGF的水平显著减少(*P<0.05)。而PBS组与pDC316-EGFP组比较VEGF表达水平差异不明显(P>0.05)。
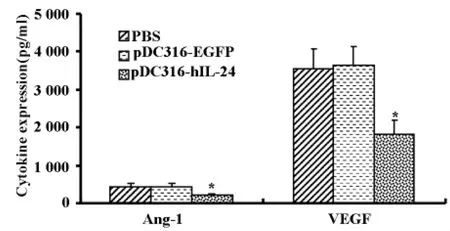
图6 IL-24作用48h对 MDA-MB-231细胞分泌 Ang-1、VEGF的影响
3 讨论
Mda-7/IL-24抑制肿瘤细胞主要表现在两方面。一方面,Mda-7/IL-24具有抑制肿瘤细胞生长的潜能,并且此抑制活性不依赖于这些细胞中其他肿瘤抑制基因(p53,Rb,或p16)的状态;另一方面除具有的促调亡功能外,mda-7/IL-24 还具有潜在的旁观者效应、提高放射疗效、诱导免疫调节反应[7],其作为细胞因子参与免疫活化和选择性诱导肿瘤细胞凋亡的双重特性使mda-7/IL-24的基因转染成为肿瘤基因治疗的一个有效策略。
本实验选用的穿梭质粒pDC316能在细胞基因组外扩增并表达目的基因,具有多拷贝、强启动、操作方便等优点,它在体外转染细胞效率较高。细胞毒性实验结果表明,pDC316介导的IL-24基因表达具有明显的抑制乳腺癌细胞生长的作用(参见图4)。肿瘤的浸润和转移是恶性肿瘤的主要生物学特征,也是恶性肿瘤患者的主要死因。人们通过对肿瘤浸润和转移的机制进行广泛研究后发现细胞外基质(Extracellular matrix,ECM)在肿瘤的的浸润和转移过程中起着关键的作用[8]。肿瘤细胞在侵袭和转移过程中必须破坏ECM,而参与破坏细胞外基质的酶类中基质金属蛋白酶类 (Matrix metalloproteinases,MMPs)起主要作用,尤其是 MMP-2、MMP-9与肿瘤的侵袭和转移关系最为密切。有报道认为MMP-2、MMP-9可以作为乳腺癌恶性程度和判断预后的一个有用的指标,并有可能成为药物治疗乳腺癌的靶点[9]。本研究通过RT-PCR分析检测发现IL-24能明显下调 MDA-MB-231细胞MMP-2、MMP-9基因的 mRNA 水平,结果表明乳腺癌细胞过表达IL-24蛋白将对其侵袭和迁移有明显的抑制作用。
VEGF是一种强效血管内皮细胞的特异性促有丝分裂原,可以促进新生血管的形成,多项临床研究结果提示在乳腺癌中,无论腋淋巴结有无转移,VEGF蛋白的表达均是影响总生存率和无瘤生存率的独立预后因素。而Ang-1是血管新生过程中的另一关键因子,目前抑制肿瘤的新生血管形成已成为肿瘤治疗的又一新领域。本研究提示pDC316-hIL-24可有效降低乳腺癌细胞内VEGF蛋白、Ang-1蛋白表达及其分泌至细胞外的蛋白水平。
综上所述,本实验表明外源性介导IL-24基因的过表达具有抑制乳腺癌 MDA-MB-231细胞增殖、侵袭转移和血管生成的作用。
[1]杨 玲,李连第,陈育德,等.中国乳腺癌发病死亡趋势的估计与预测[J].中华肿瘤杂志,2006,28(6):438.
[2]Gillet JP,Macadangdang B,et al.The development of gene therapy:from monogenic recessive disorders to complex diseases such as cancer[J].MethodsMol Biol,2009,542:50.
[3]Jiang H,Lin JJ,Su ZZ,et al.Subtraction hybridization identifies a novel melanoma differentiation associated gene,mda-7,modulated during human melanoma differentiation,growth and progression[J].Oncogene,1995,11(12):2477.
[4]Huang EY,Madireddi MT,Gopalkrishnan RV,et al.Genomic structure,chromosomal localization and expression profile of a novel melanoma differentiation associated (mda-7)gene with cancer specific growth suppressing and apoptosis inducing properties[J].Oncogene,2001,20(48):7051.
[5]Su Z,Emdad L,Sauane M,et al.Unique aspects of mda-7/IL-24 antitumor bystander activity:establishing a role for secretion of MDA-7/IL-24protein by normal cell[J].Oncogene,2005,24(51):7552.
[6]Patani N,Douglas-Jones A,Mansel R,Tumour suppressor function of MDA-7/IL-24in human breast cancer[J].Cancer Cell Int,2010,10:29.
[7]Gupta P,Su ZZ,Lebedeva IV,et al.Mda-7/IL-24:multifunctional cancer-specific apoptosis-inducing cytokine[J].Pharmacol Ther,2006,111(3):596.
[8]Liotta LA.Tumor invasion and metastases-role of the extracellular matrix:Rhoads Memorial Award lecture[J].Cancer Res,1986,46(1):1.
[9]Wojtowicz-Praga SM,Dicks on RB,Hawkins MJ.Matrix metalloproteinase inhibitors[J].Invest New Drugs,1997,15(1):61.
