miR-31在人结肠癌细胞系HT-29对RhoBTB1表达的影响
2013-11-24徐瑞斯
徐瑞斯,张 斌
(吉林大学中日联谊医院 内镜中心,吉林 长春130033)
结肠癌(colon cancer)是世界上最常见的恶性肿瘤之一,每年死亡病例居各种恶性肿瘤第三位[1]。目前为止,根治结肠癌最有效的方法还是手术切除联合化疗,对于局部肿瘤5年生存率达到93%[2]。microRNA(miRNA)是一种大小19-24个核苷酸的非编码单链小RNA分子,能够通过排序这些基因的3’段非编码区调整下游目标基因,参与细胞增殖、分化、凋亡等多种重要细胞活动的调控[2]。迄今为止,人们发现了1500多种miRNA序列[3]。越来越多的证据表明miRNA在肿瘤的发生和进展中起着非常重要的作用[4,5],很多miRNA在肿瘤中的表达是上调的或者是下调的[6,7]。
miRNA-31在恶性肿瘤的发生中起着非常重要的作用。有报道称miRNA-31结肠癌表达是显著上调,而且其表达水平在结肠癌的各个阶段是相互关联的[8,9]。有报道称 miRNA-31与结肠癌的侵袭和转移有关,抑制miRNA-31的表达可以影响结肠细胞的迁移和侵袭[10]。RhoBTB是Rho家族小分子鸟苷酸三磷酸酶(Rho GT Pases),是RhoBTB亚家族成员。最近报道指出在头颈癌中,RhoBTB1也是一种抑癌蛋白[11]。
1 材料与方法
1.1 细胞培养 人结肠癌细胞株HT-29来自于美国标准生物品收藏中心(ATCC),为复旦大学李志刚老师惠赠。90%RPMI1640培养基,10%胎牛血清,加100U/ml青霉素和100U/ml链霉素,于37℃,5%CO2培养箱中培养。
1.2 细胞转染 对照RNA和miR-31mimics分别转染HT-29细胞。将细胞在转染之前24h接种到24孔板上(2.5-3×104/well)。取1μl转染试剂 Lipofectamine 2000(Invitrogen)加入50μl(不含抗生素及血清)培养液中,同时将1.25μlmiR-31mimics储存液加入50μl(不含抗生素及血清)培养液中。将两者混匀后加400μl(不含抗生素及血清)培养液,加入培养液清洗后的培养细胞上。37℃培养5-6h,换液。37℃5%CO2培养箱培养48h之后,收集细胞进行检测。
1.3 预测靶基因 使用在线miRNA靶基因预测数据库(http://www.targetscan.org),我们假定RhoBTB1是miR-31的靶蛋白。(如图1A)
1.4 荧光素酶报告基因载体的构建 采用PCR方法扩增RhoBTB1基因的3’UTR序列,并构建其突变型序列,扩增出来的序列经酶切后,连入pGL3载体萤火虫荧光素酶序列的3’端,所有构建好的质粒均经DNA测序检验。
1.5 荧光素酶基因报告分析 将培养好的细胞于转染之前24h接种到24孔板中,将荧光素酶报告质粒与miR-31mimics共同转染细胞,48h之后进行荧光素酶活性的测定。
1.6 RT-PCR 用TRIzol试剂(Invitrogen)从细胞和肿瘤组织中提取总RNA。我们用茎环RT-PCR方法进行miR-31的检测。RhoBTB1mRNA的检测使用M-MLA反转录系统(Promega)将RNA逆转录 成cDNA。qRT-PCR的使用SYBR Green qPCR Master Mix(Tiangen)在 ABI 7300(Applied Biosystems,Foster,CA)。GAPDH作为内参。
1.7 western-blotting 按指示转染后,细胞收集并在RIPA裂解缓冲液(150mM NaCl,10mM Tris,pH7.5,1%NP40,1%脱氧胆酸盐,0.1%SDS,蛋白酶抑制剂混合物(sigma))裂解和使用Bradford protein assay(Bio-Rad,Hercules,CA)测定总蛋白。等量的蛋白样品进行10%SDS-PAGE电泳,并转移到PVDF膜(Millipore,Billerica,USA),室温下在5%脱脂牛奶封闭30min,然后室温下在anti-RhoBTB1(1∶2000,Abcam)中孵育2h,随后室温下加山葵过氧化物酶连接二抗孵育1h,使用ECL(Millipore,MA,USA)观察。β-actin(1∶5000,Abcam)作为内参。
1.8 统计学处理
采用SSPS12.0软件进行统计学分析,计量资料以均数±标准差表示,应用统计方法t检验,P<0.05有统计学意义。
2 结果
2.1 RhoBTB1是 microRNA-31的靶蛋白
由于miRNA的调控目标基因mRNA的翻译和凋亡是通过和靶基因3'UTR的直接结合而相互作用,我们试图寻找miR-31的靶基因,以进一步揭示其结肠癌发生机制中的影响。通过使用miRNA靶基因预测的数据库(http://www.targetscan.org),我们假定 RhoBTB1为 miR-31的靶基因(图1A)。研究RhoBTB1是否为miR-31的直接靶基因,我们应用了荧光素酶报告基因检测。
首先,我们构建了荧光素酶报告质粒包含RhoBTB1 3'UTR序列(WT-RhoBTB1)或删除预测的 miR-31的靶基因位点(mut-RhoBTB1)。如显示在图1B后,共同转染的wt-RhoBTB1质粒,与对照miR转染的细胞,miR-31转染的细胞的荧光素酶活性的显著减少,而与mut-RhoBTB1质粒共同转染的细胞荧光素酶的活性没有改变。两者合计,这些结果表明了miR-31针 对3'UTR直接调控RhoBTB1。

图1 A 靶基因预测数据库中miR-31靶基因的预测结果

图1 B miR-31转染HT-29细胞后,荧光素酶的检测结果
2.2 miR-31的下调RhoBTB1在HT29细胞中的表达
RhoBTB是Rho家族小分子鸟苷酸三磷酸酶,由3名成员组成,有报道称两名成员RhoBTB1和RhoBTB2为抑癌基因。我们发现RhoBTB1为人结肠癌细胞系HT29中miR-31的靶蛋白,接下来我们研究miR-31对RhoBTB1表达的影响。与转染对照RNA的 HT29细胞相比,转染miR-31mimics HT29细胞的RhoBTB1mRNA表达水平显著下调(图2A),western-blotting结果显示miR-31表达抑制之后RhoBTB1蛋白表达水平上调(图2B)。在结肠癌组织中miR-31的上调抑制RhoBTB1的表达。
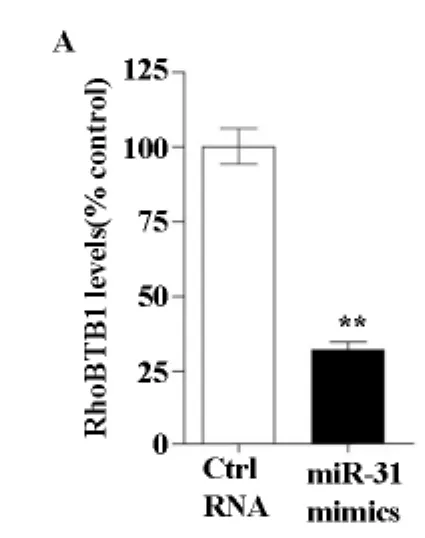
图2 A miR-31mimics转染HT-29细胞,RhoBTB1的mRNA表达水平比较
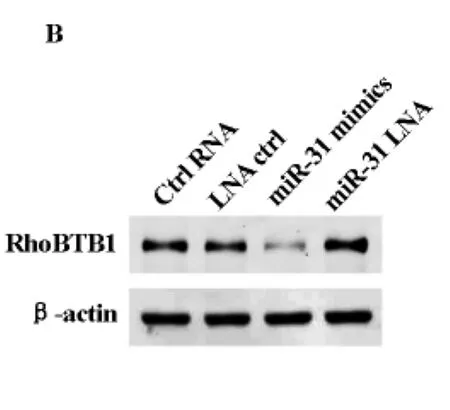
图2 B miR-31mimics转染HT-29细胞,RhoBTB1的蛋白表达水平比较
3 讨论
miRNA是内源性表达的小非编码RNA,它控制目标信使RNA基因的表达。据估计,在人类,基因编码的miRNA的数量约3%,这可能调节30%蛋白质的编码基因[12,13]。确实的证据说明,miRNA人类癌组织中表达异常,在肿瘤的发生和发展中发挥着重要作用[14,15]。
为了确定 miR-31的靶基因,我们使用TargetScan sorftware,分析结果表明,肿瘤抑癌基因RhoBTB1的可能是miR-31的靶基因。RhoBTB1属于RhoBTB亚家族。RhoBTB蛋白是Rho家族小分子鸟苷酸三磷酸酶的非典型成员。Rho GTP酶作为分子开关调节肌动蛋白,被认为是细胞骨架重构的主要调节分子,越来越多的证据表明,他们也参与调节细胞周期和细胞凋亡,也有报道称Rho GTP酶参与肿瘤的发展[16-18]。
RhoBTB亚家族被证实是在2001年在真核细胞盘基网柄菌的基因编码Rho-相关蛋白的研究中。和其他典型的RhoGTPases不同,RhoBTB蛋白质不是调节肌动蛋白系统。现在,RhoBTB的家族两名成员,RhoBTB2和RhoBTB1,被认为是肿瘤抑制蛋白。RhoBTB1,位于10q21,在(HNSCC)的发展有一定的作用。
我们的研究表明,抑癌蛋白RhoBTB1是miR-31的靶蛋白。microRNA-31能够下调RhoBTB1在HT29细胞中的表达量。miRNA-31在调控肿瘤的发生和发展中起着重要的作用。对miRNA的深入研究无疑能增进对大肠癌发生、发展、转归等机制的认识,促进诊断和治疗的快速发展。阐明大肠癌相关miRNA的作用机制将可能丰富大肠癌的病因学及分子病理学理论,为大肠癌诊断治疗提供新策略和思路。如能根据此研究研制出抗肿瘤新药,给社会及经济方面带来深远的影响。
[1]Jemal,A.et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60:277.
[2]AmbrosV.MicroRNA pathways in flies and worma:growth,death,fat,stress and timing[J].Cell,2003,113(6):673.
[3]MiR-30a-5p suppresses tumor growth in colon carcinoma by targeting DTL[J].Carcinogenesis,2012,33(4):732.
[4]Bushati,N.et al.microRNA functions[J].Annu Rev Cell Dev Biol,2007,23:175.
[5]Garzon R,Garzon R,Calin GA,et al.MicroRNAs in cancer[J].Annu Rev Med,2009,60:167.
[6]Slaby O,Svoboda M,Michalek J,et al.MicroRNAs in colorectal cancer:translation of molecular biology into clinical application[J].Mol Cancer,2009,8:102.
[7]Schetter AJ,Harris CC.Alterations of microRNAs contribute to colon carcinogenesis[J].Semin Oncol,2011,38:734.
[8]Bandres E,Cubedo E,Agirre X,et al.Identification by real-time PCR of 13mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues[J].Mol Cancer,2006,5:29.
[9]Slaby O,Svoboda M,Fabian P,et al.Altered expression of miR-21,miR-31,miR-143and miR-145is related to clinicopathologic features of colorectal cancer[J].Oncology,2007,72:397.
[10]Cottonham CL,Kaneko S,Xu L.miR-21and miR-31con-verge on TIAM 1to regulate migration and invasi on of colon carcinoma cells[J].J Biol Chem,2010,285:35 293.
[11]Beder LB,Gunduz M,Ouchida M,et al.Identification of a candidate tumor suppressor gene RHOBTB1located at a novel allelic loss region 10q21in head and neck cancer[J].J Cancer Res Clin Oncol,2006,132:19.
[12]Hwang HW,Mendel JT:MicroRNAs in cell proliferation,cell death,and tumorigenesis[J].Br J Cancer,2006,94 :776.
[13]Lewis BP,Burge CB,Bartel DP.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J].Cell,2005,120:15.
[14]Cho WC.MicroRNAs in cancer from research to therapy[J].Biochim Biophys Acta,2010,1805,209.
[15]Cho WC.MicroRNAs:potential biomarkers for cancer diagnosis,prognosis and targets for therapy[J].Int J Biochem Cell Biol,2010,42,1273.
[16]E Sahai,CJ Marshall.RHO-GTPases and cancer[J].Nat Rev Cancer,2002,2:133.
[17]T Gomez del Pulgar,SA Benitah,PF Valeron,et al.Rho GTPase expression in tumourigenesis:evidence for a significant link[J].Bioessays,2005,27:602.
[18]S Ellenb roek,J Collard.Rho GTPases:functions and association with cancer[J].Clin Exp Metastasis,2007,24:657.
