冬虫夏草水提物体外抗巨细胞病毒研究
2013-11-24陈智平蔡豪斌伍惠玲王茂水
陈智平,蔡豪斌,伍惠玲,王茂水,何 雨,李 山,秦 雪*
(1.广西医科大学公共卫生学院,广西 南宁530021;2.英美特生物技术研究所,广西 桂林541001;3.广西医科大学第一附属医院 临床实验部,广西 南宁530021;4.广西医科大学 医学检验系,广西 南宁530021)
巨细胞病毒在人群中具有极高的感染率,血清阳性率40%-100%不等,美国FDA批准用于抗巨细胞病毒的药物较少,且这些药物存在有较多的副作用:造血抑制、低生物吸收度、肾毒性、生殖毒性等。所以有必要筛选新型低毒的抗巨细胞病毒药物。特别是从中草药中筛选抗巨细胞病毒药物。
冬虫夏草(Cordycepssinensis)是我国一种名贵的中草药材。目前有多种生物活性被报道:提高免疫力,抗肿瘤等。本研究既探讨冬虫夏草水提物的体外抗巨细胞病毒活性。
1 材料与方法
1.1 冬虫夏草的水提物的制备
冬虫夏草为桂林淮安公司赠送。冬虫夏草子实体经高速组织捣碎机处理后,放于超纯水(Milli-Q ultrapure water systems)中低温浸提3次,每次24 h。每次浸提结束后,离心处理(3 000rpm,4℃,10 min),再重新浸取。最后合并3次浸取上清,冻干处理。使用时,称量并溶于培养基(10%DMEM,10%胎牛血清)中,经0.22μm滤器过滤后使用。
1.2 原代细胞培养以及巨细胞病毒制备
人包皮成纤维细胞(HFFs)由桂林英美特生物技术研究所保存,所采用的细胞代数为6-14代。培养基为DMEM(美国Hyclone),含10%胎牛血清(杭州四季青生物工程公司)、100U/ml青霉素、100 μg/ml链霉素。人巨细胞病毒tw-87购自ATCC,经过扩培后[1],-80℃冻存备用,并且确定其滴度。
1.3 细胞毒性试验
通过MTT法[2]检测冬虫夏草水提物的细胞毒性。在37℃,5%CO2培养条件下,HFFs(104/孔)接种至96孔板,待细胞贴壁后,加入同量梯度稀释的冬虫夏草水提物。经过72h孵育后,加入MTT(Sigma)溶液(5mg/ml)。孵育6h后,置酶标仪(Anthos Labtek HT2)读取570nm处的光密度(OD)值。结果以均数±标准差表示。在不同时间,重复本试验以验证结果的可重复性。
1.4 噬斑减少试验
巨细胞病毒(1PFU(Plaque Formation Unit)/细胞)接种至铺满成纤维细胞的24孔板,经过1.5h吸附后,加入同量梯度稀释的冬虫夏草水提物,每个浓度下有三个平行测试孔。孵育7天后,超声处理贴壁的成纤维细胞,取各孔上清在新24孔板上检测其滴度:添加上清后,孵育1.5h后,吸掉培养基,加入1%甲基纤维素、5%胎牛血清的DMEM培养基,7-10天后,用95%酒精固定15min,吉姆萨染色。计数噬斑数量。根据Reed-Münch法,计算半数抑制量(IC50)。
1.5 免疫印迹
人包皮成纤维细胞首先经过血清饥饿24h,然后添加巨细胞病毒(1PFU/cell),经过1.5h吸附后,加入等量冬虫夏草水提物。分别在12h,24h,48h,72h收集细胞蛋白:加入2×Laemmli裂解液400μl,刮取细胞。经13 000rpm离心后。取上清,煮沸5min后,采用12%SDS-聚丙烯酰胺凝胶电泳,分离蛋白样品,然后转印PVDF膜((Millipore),经过5%脱脂奶粉(w/v)封闭后,分别加入一抗、辣根过氧化物酶标记的二抗孵育。采用ECL(碧云天)显色,曝光。
我们检测了3种蛋白的表达(IE1,IE2,UL84),抗巨细胞病毒IE1鼠源单抗、抗巨细胞病毒IE2鼠源单抗、抗巨细胞病毒UL84鼠源单抗(由英美特生物技术研究所研制),分别用来检测PVDF膜上的相应蛋白。当一种抗原检测完毕后,将膜放入洗脱液(100mMβ-巯基乙醇,1.5%SDS,0.05MTris-HCl,pH 2.3)中,60℃孵育30min。经 PBST(含0.5%tween-20,1×PBS)洗2次后,封闭,重新用新的单抗孵育。ECL显色,曝光。另外,选用β-actin(碧云天)作为免疫印迹的内参。
1.6 细胞活性检测
同样采用MTT法。根据巨细胞病毒添加量不同分5个组 (5PFU/细胞,1.25PFU/细胞,0.3125PFU/细胞,0.078PFU/细胞,0PFU/细胞),更换含有或者不含冬虫夏草水提物的培养基。经过72h的孵育后,加入 MTT孵育6h,读取OD值(570nm)。结果以均数±标准差(mean±SD)表示。
2 结果
2.1 细胞毒性检测
冬虫夏草具有较低的细胞毒性,当冬虫夏草水提物浓度为2mg/ml时,在镜下观察细胞形态,细胞边界清晰,但是有些细胞已经悬浮,细胞形态严重改变,胞质中有异物感,细胞发生严重的细胞病变。而在0.5mg/ml浓度下的细胞,与未添加药物的正常细胞相比,没有区别。MTT法证实(表1),当冬虫夏草水提物浓度≤0.5mg/ml,发现与正常组相比,细胞的活性基本没有变化。本研究为进一步减少冬虫夏草水提物的细胞毒性,我们采用0.4mg/ml作为下续研究的测试浓度(免疫印迹,活化抑制试验等)。
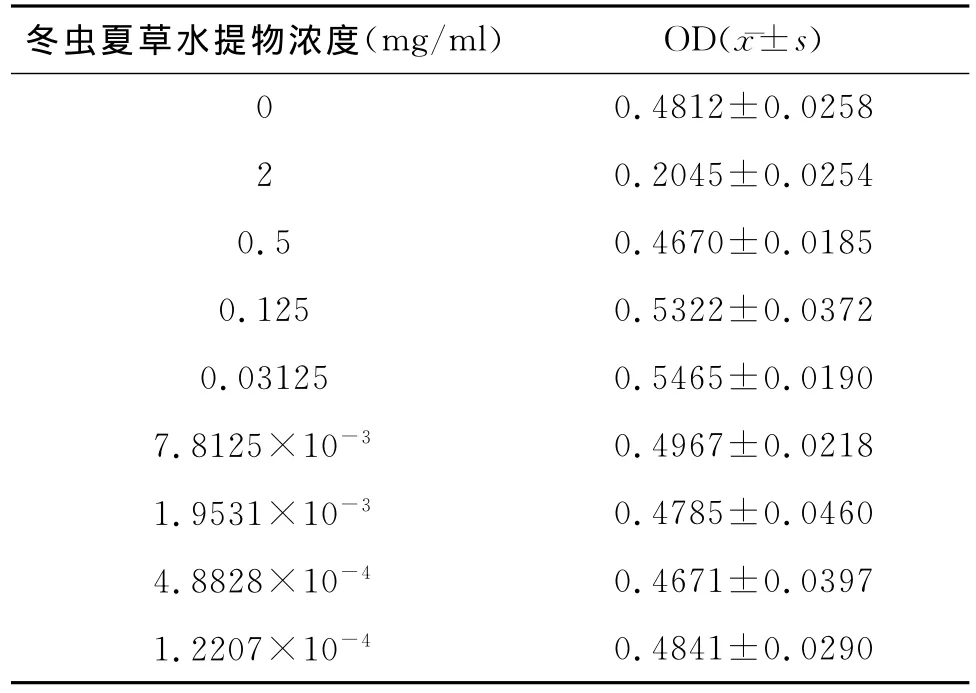
表1 冬虫夏草水提物细胞毒性试验(MTT法)
2.2 噬斑减少试验
通过噬斑减少试验,初步发现冬虫夏草的半数抑制量(IC50)介于0.4mg/ml-0.1mg/ml之间。进一步缩小药物浓度范围,重复噬斑减少试验,结果如表2所示。采用Reed-Münch法,计算得到IC50=0.17mg/ml。
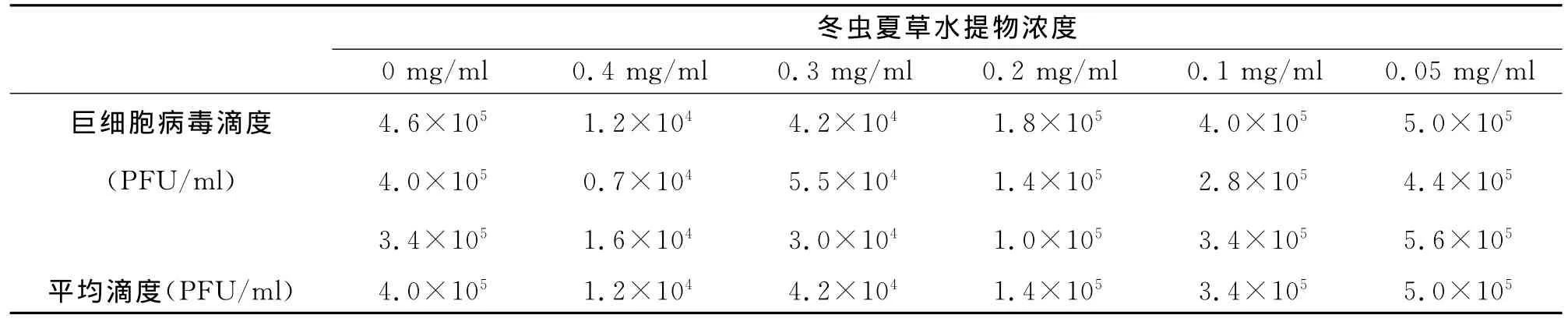
表2 噬斑减少试验结果
2.3 免疫印迹
我们发现冬虫夏草水提物可以轻微抑制IE1的表达;同时可以阻断IE2/UL84的表达(低于免疫印迹的检测限),与未用药物处理组相比,冬虫夏草处理组,在48hpi(hours postinfection),72hpi均未检测到IE2/UL84的表达。而未用冬虫夏草水提物处理组,在48hpi,72hpi,IE2/UL84都有较强的表达。同时,未添加病毒的细胞(mock),没有检测到IE1/IE2、UL84的表达。
2.4 活化抑制试验
巨细胞病毒的感染可以活化细胞。我们采用MTT法检测细胞活性,发现细胞活性的提高与巨细胞病毒的添加量有一定的关系。但是,培养基中含有0.4mg/ml冬虫夏草水提物的细胞,感染巨细胞病毒后,细胞活性的增加不明显,见表3。这说明冬虫夏草可以阻断巨细胞病毒引起的细胞活性增加。镜下观察,冬虫夏草水提取物可以抑制细胞病变的产生(如图2)。
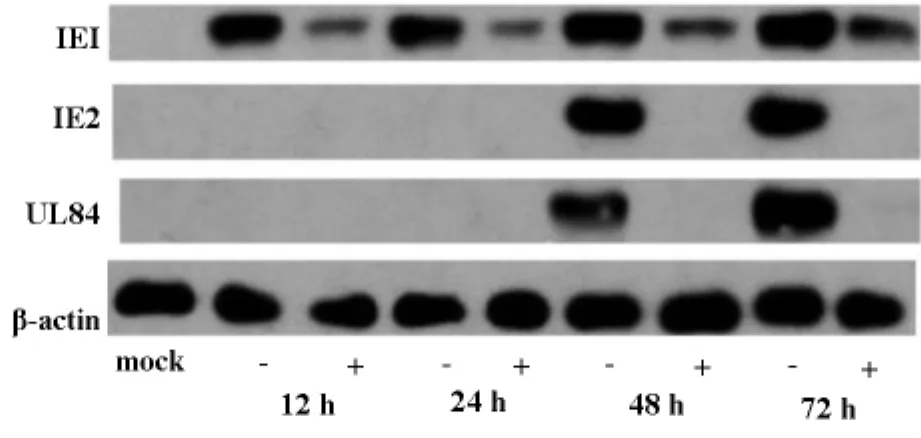
图1 “-”和“+”分别代表不含冬虫夏草水提物、含冬虫夏草水提物。可以发现,冬虫夏草水提物可以轻微抑制IE1的表达,可以抑制IE2、UL84的表达,以致低于检测限度
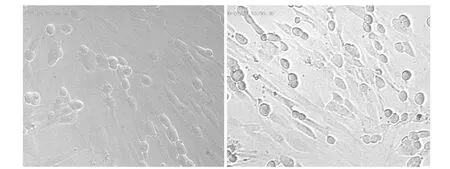
图2 左图,巨细胞病毒添加量为:1.25PFU/细胞,含0.4mg/ml冬虫夏草水提物。右图,巨细胞病毒添加量为:1.25PFU/细胞,不含冬虫夏草水提物。
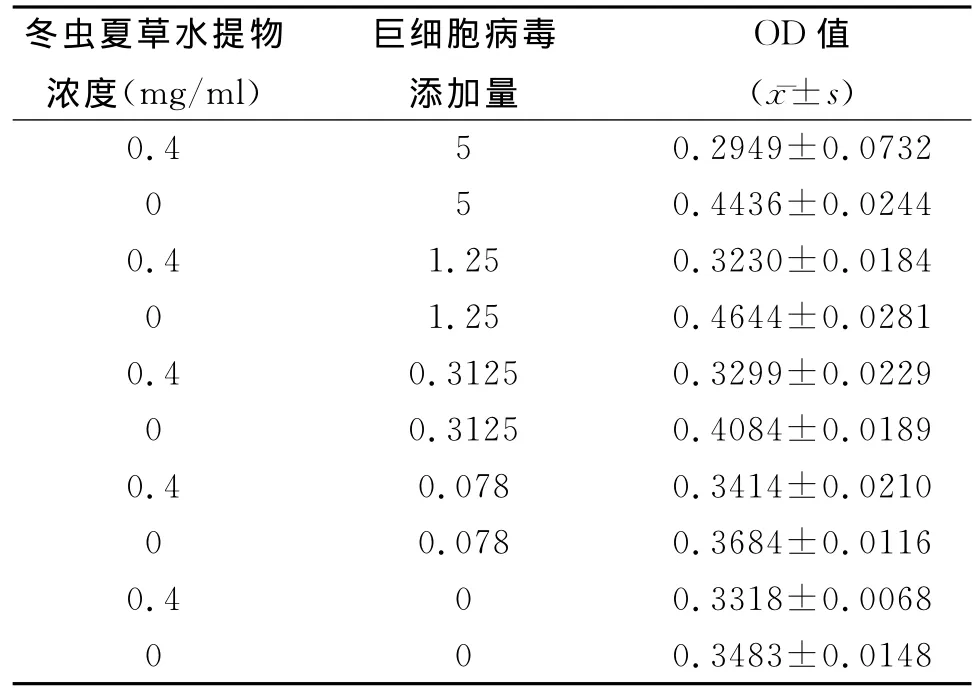
表3 冬虫夏草水提物抑制巨细胞病毒活化细胞试验
3 讨论
冬虫夏草是我国一种名贵的中草药材。鲜有报道其在抗病毒中的作用,在本研究中我们发现冬虫夏草水提物可以有效抑制巨细胞病毒的复制。一种机制是通过抑制某些早期(IE1/IE2)或者早晚期蛋白(UL84)的表达,抑制巨细胞病毒的复制。另外一种可能是,冬虫夏草具有多种生理活性作用,可影响细胞内的微环境,这提示虫草可能通过改变细胞内微环境而影响巨细胞病毒的复制。
IE1/IE2,UL84对于巨细胞病毒的DNA复制非常重要。它们参与反式激活巨细胞病毒与宿主细胞,巨细胞病毒突变体CR208(IE1基因中缺乏外显子4),具有较低的复制效率,这说明IE1在巨细胞病毒的复制过程中具有重要的作用[3],作为反转录因子的一种,IE2反式激活绝大多数的巨细胞病毒启动子,IE2的缺失会导致病毒不表达早期裂解基因,这意味着IE2也可影响巨细胞病毒的感染效率[4]。至于 UL84,它参与复制中心(replication center)的形成,UL84的缺失,会导致UL44和IE2不能参与复制中心的形成,而复制中心的形成对于巨细胞病毒的复制是必须的[5]。基于上述发现,我们检测了IE1,IE2和UL84的表达水平。通过我们的研究表明,冬虫夏草水提物可能通过抑制某些早期(IE1/IE2)或者早晚期蛋白(UL84)的表达,抑制巨细胞病毒的复制。
研究表明,巨细胞病毒可以活化细胞,比如,增加胞内Na+的浓度,以及cAMP和cGMP的胞内浓度,促进宿主细胞DNA的合成,促进冠状动脉平滑肌细胞的增殖,激活VEGF的转录等。有报道称,当巨细胞病毒引起的活化信号被抑制时,或者生理反应被阻断时,巨细胞病毒的复制量会降低,这也就是说巨细胞病毒引起的细胞生理反应也是一种潜在的抗巨细胞病毒的作用靶点[6]。因此巨细胞病毒引起细胞活性的增高应该是一种促进病毒增殖的一种手段。但是为什么冬虫夏草水提物会抑制巨细胞病毒的活化作用呢?这意味着这种抑制细胞活性的上调可能是冬虫夏草水提物的一种抗巨细胞病毒的靶位。但是免疫印迹的结果显示冬虫夏草水提物的抑制巨细胞病毒的靶位为一些早期蛋白(IE1/IE2)或者早晚期蛋白(UL84)。因此,细胞活性的相对降低可能是由于冬虫夏草抑制这些重要蛋白的表达而引起的。但是也不能排除是由于冬虫夏草对细胞内环境的影响[7-9]。这些只是我们的假设,还需要进一步的实验来支撑。
综上所述,我们发现了冬虫夏草的一种新的生物活性:抗巨细胞病毒作用,并初步确定其抗巨细胞病毒的靶位,下一步我们将从中分离出有效的抗巨细胞病毒组份,以应用于临床。
陈智平和蔡豪斌对本文有同等贡献,并列第一作者。
[1]Huang ES,Chen ST,Pagano JS.Human cytomegalovirus.I.Purification and characterization of viral DNA[J].J Virol.1973,12(6):1473.
[2]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Methods.1983,65(1-2):55.
[3]Greaves RF,Mocarski ES.Defective growth correlates with reduced accumulation of a viral DNA replication protein after lowmultiplicity infection by a human cytomegalovirus ie1mutant[J].J Virol.1998,72(1):366.
[4]Marchini A,Liu H,Zhu H.Human cytomegalovirus with IE-2(UL122)deleted fails to express early lytic genes[J].J Virol.2001,75(4):1870.
[5]Xu Y,Cei SA,Huete AR,et al.Human cytomegalovirus UL84 insertion mutant defective for viral DNA synthesis and growth[J].J Virol,2004,78(19):10360.
[6]Albrecht T,Boldogh I,Fons M,et al.Cell activation signals and the pathogenesis of human cytomegalovirus[J].Intervirology.1990,31(2-4):68-75.
[7]Kuo YC,Tsai WJ,Wang JY,et al.Regulation of bronchoalveolar lavage fluids cell function by the immunomodulatory agents from Cordyceps sinensis[J].Life Sci,2001,68(9):1067.
[8]Shi P,Huang Z,Tan X,et al.Proteomic detection of changes in protein expression induced by cordycepin in human hepatocellular carcinoma BEL-7402cells.Methods Find Exp Clin Pharmacol[J].2008,30(5):347.
[9]Kim GY,Ko WS,Lee JY,et al.Water extract of Cordyceps militaris enhances maturation of murine bone marrow-derived dendritic cells in vitro[J].Biol Pharm Bull,2006,29(2):354.
