氯化铵和硫酸铵生成焓与晶格能测定
2013-11-23成文玉王庆伦刘晓莉王桂香
杨 春,成文玉,王庆伦,刘晓莉,王桂香,杨 津
(1.河北工业大学 化工学院,天津 300130;2.南开大学 化学学院,天津 300071)
1 原实验的不足和改进措施
1.1 原实验的不足
化学反应焓变的测定是目前一些高等院校开设的一类无机化学实验[1-4],其主要目的是训练学生设计合适的热化学循环解决实际问题的能力,加深学生理解生成焓的概念和Hess定律。在河北工业大学应用化学、海洋技术和材料化学等专业长期开设的“氯化铵生成焓的测定”实验过程中,主要存在以下4点不足:
(1)实验内容偏少、难度偏低,不能充分调动学生的主观能动性;
(2)不要求学生对实验数据用作图法进行校正,实验误差较大;
(3)氯化铵的用量较大,而且氯化铵溶液没有得到重复使用;
(4)实验局限于体系宏观性质的研究,没有引导学生对所研究的物质进行结构层面的思考。
1.2 改进措施
我们针对上述存在的问题,在“以学生为中心,注重从验证式教学模式向探究式教学模式过渡”思想的指导下[5],对实验进行了如下改进:
(1)我们注意到硫酸铵的溶解热(6.2kJ/mol)明显小于氯化铵的溶解热(14.8kJ/mol)[6],因此在学生完成氯化铵生成焓的测定后,增加难度适合大学一年级学生的设计性实验内容——硫酸铵生成焓的测定,要求学生把已有的实验结果和文献数据灵活地运用到新的实验中去,既充实了实验内容,又有利于培养学生的创新意识和创新能力[7];
(2)用数字贝克曼温度计代替普通的温度计,便于学生实时记录体系的温度变化,并用作图法对温度-时间曲线进行校正[8],提高温度测量的准确度,训练学生处理实验数据的能力;
(3)在无机化学实验中渗透绿色化学的理念[9-12],减少氯化铵的用量,产生的硫酸铵溶液可以用作基础无机化学实验“硫酸亚铁铵的制备”的原料,实现实验之间的衔接;
(4)为了引导学生思考氯化铵和硫酸铵热力学性质不同的内在原因,在数据处理部分增加求晶格能的内容,帮助学生探究离子晶体结构与物性的关系,加深学生理解离子晶体结构的理论知识。
2 实验原理
在一定温度的标准状态下,由一组指定单质生成1mol某物质的标准摩尔焓变,称为该物质的标准摩尔生成焓,以符号ΔfH(T)表示,简称生成焓。有些物质往往不能由单质直接生成,这些物质的生成焓则无法直接测定,根据Hess定律,可以设计热化学循环,求得该物质的生成焓。如图1所示,只要通过实验测定稀盐酸与稀氨水反应的中和焓[中和]和氯化铵晶体的溶解焓[NH4Cl,cr],再结合已知的 NH3和HCl的生成焓[NH3,aq)]和[HCl,aq],即可由式(1)求得氯化铵晶体的标准摩尔生成焓[NH4Cl,cr]:
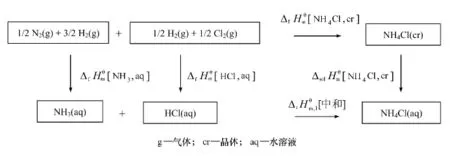
图1 生成氯化铵溶液的两种途径


在标准状态下,按下列化学反应计量式使离子晶体变为气态正离子和气态负离子时所吸收的能量称为晶格能,用U表示。式(2)反应的焓变称为晶格焓。本实验忽略晶格能与晶格焓的微小差异,认为。晶格能的大小反映了离子晶体中正负离子间相互作用的强弱,离子化合物的熔点、沸点、硬度等很多性质都可以联系晶格能来说明。晶格能不能直接测出,可根据Born-Haber热化学循环,应用有关的热化学数据计算。
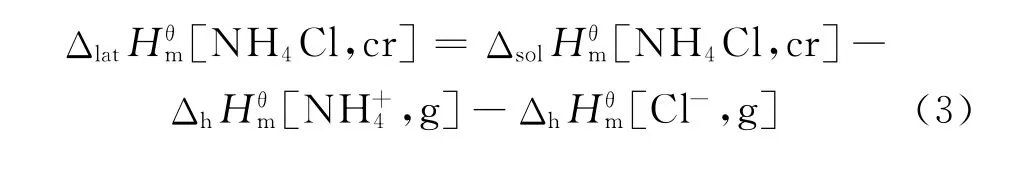
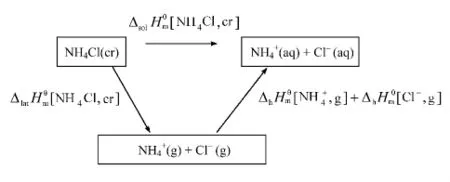
图2 氯化铵晶体溶解的两种途径
同理,可以设计合适的热化学循环,结合量热实验,来求算硫酸铵晶体的生成焓和晶格能。本实验中蒸馏水和实验中涉及的所有溶液的密度均取1g/mL,它们的比热容均为c(H2O)=4.18J/(g·℃)。
3 仪器和试剂
仪器:移液管,滴定管,电子天平(FA2104N,0.000 1g),自制保温杯式量热计(250mL),数字贝克曼温度计(SWC-II,0.01℃),秒表。
液体试剂:HCl(1.427mol/L),H2SO4(0.750 mol/L),NH3·H2O(1.6mol/L),盐酸和硫酸的浓度均用浓度为1.456mol/L的NaOH标准溶液标定。
固体试剂:NH4Cl,(NH4)2SO4。
4 实验内容
4.1 量热计热容的测定
用移液管量取室温下的蒸馏水50.00mL,放入干净且干燥的保温杯中,盖好塞子,用环形搅拌棒上下搅动,用数字贝克曼温度计观测温度,若连续3min温度不变,记下冷水温度θc=26.33℃。
用移液管量取50.00mL蒸馏水,倒入100mL烧杯中,把此烧杯置于温度高于室温20℃的热水浴中,放置10~15min后,用数字贝克曼温度计准确读出热水温度为θh=46.80℃。
迅速将此热水全部倒入保温杯中,盖好塞子,以上述同样的方法进行搅动,使冷、热水充分混合。在倒入热水的同时,按动秒表,用数字贝克曼温度计每隔10s测量1次温度,记录3次;然后每隔20s测量1次温度,直到体系温度等速下降约600s后停止记录。倒尽保温杯中的水,把保温杯洗净并用吸水纸擦干待用。
实验测得的温度-时间曲线见图3,用Origin软件对t为90~630s之间的数据进行线性拟合,得到线性方程θ=35.56-2.08×10-3t,相关系数R=-0.996,从而确定混合后水的温度θm=35.56℃。
按公式[m×c(H2O)+Cp](θm-θc)=m×c(H2O)×(θh-θm)[14],计算得到量热计热容Cp=45.51J/K。m为水质量。

图3 热水加入后水温随时间的变化
4.2 中和焓的测定
4.2.1 稀盐酸与氨水中和焓的测定
用50mL移液管移取50.00mL、1.427mol/L的HCl放入干净且干燥的保温杯中,盖好塞子,缓慢搅动,用数字贝克曼温度计每隔30s测量1次盐酸的温度,当盐酸温度保持不变时(约需3min),记下温度θ1=21.84℃。
用碱式滴定管从保温杯盖子上的小孔中快速加入50.00mL、1.6mol/L的 NH3·H2O,开始加入氨水的同时按动秒表计时,边加边缓慢搅动,当NH3·H2O完全加入后,用数字贝克曼温度计每隔30s测量1次溶液的温度,当溶液温度上升到最高点后,继续记录5~6 min。测定完毕后将NH4Cl溶液倒入回收瓶中。
HCl(aq)+NH3(aq═══)NH4Cl(aq),ΔrHθm,1(中和)测得的温度-时间曲线如图4所示,用Origin软件对t为60~630s之间的数据进行线性拟合,得到线性方程θ=30.02-2.73×10-3t,R=0.998,确定溶液的最高温度为θ2=30.02℃,则Δθ=θ2-θ1=8.18℃。据公式:
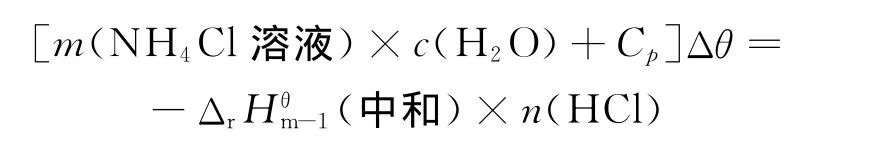

图4 稀盐酸中和氨水过程中溶液温度随时间的变化
4.2.2 稀硫酸与氨水中和焓的测定
学生根据稀盐酸与氨水中和焓测定实验的初步结果和实验室条件,自行设计实验方案。与稀盐酸与氨水中和焓的测定相似,在液体试剂温度均为21.77℃条件下,测定了50.00mL、0.750mol/L的 H2SO4与50.00mL、1.6mol/L的 NH3·H2O 的中和焓,为节省篇幅,实测温度-时间曲线略。
用Origin软件对t为60~630s之间的数据进行线性拟合,得到线性方程θ=30.43-3.86×10-3t,R=0.993,确定溶液的最高温度为30.43 ℃,Δθ=8.66℃。
根据公式:

4.3 溶解焓的测定
4.3.1 NH4Cl溶解焓的测定
用移液管准确量取100.00mL蒸馏水放入干净且干燥的保温杯中,盖好塞子,缓慢搅动,用数字贝克曼温度计观测温度3min,当温度保持不变时,记下水温θ3=26.90℃。
向保温杯中迅速加入研细过的NH4Cl粉末4.012 5g,盖好塞子,缓慢搅动,加入NH4Cl的同时,按动秒表开始计时。用数字贝克曼温度计观测温度,每隔30s记录1次溶液的温度,当溶液温度下降到最低点后,再继续记录温度5~6min。测定完毕后将NH4Cl溶液倒入回收瓶中。
测得的温度-时间曲线如图5所示,用Origin软件对t=90~660s之间的数据进行线性拟合,得到线性方程θ=24.323 08+1.45×10-3t,R=0.999 1,确定溶液的最低温度为θ4=24.32℃,则Δθ=θ4-θ3=-2.58℃。
据公式:
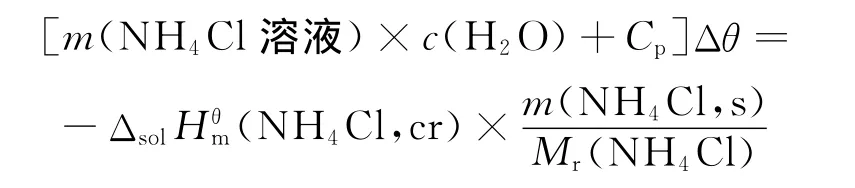

图5 氯化铵溶解过程中溶液温度随时间的变化
4.3.2 (NH4)2SO4溶解焓的测定
学生根据NH4Cl溶解焓测定实验的初步结果和(NH4)2SO4溶解焓的文献值,自行设计实验方案。与NH4Cl溶解焓的测定相似,测定了20.000 3g(NH4)2SO4溶解于100.00mL温度为26.33℃的蒸馏水中的溶解焓。用Origin软件对t为120~600s之间的数据进行线性拟合,得到线性方程θ=24.38+1.13×10-3t,R=0.990 1,确定溶液的最低温度为24.38℃,Δθ=-1.95℃。
根据公式:
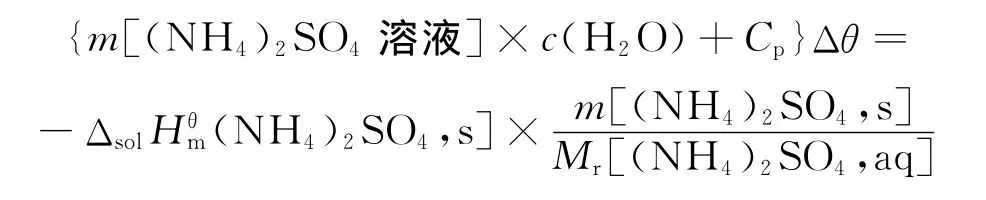
计算得:Δsol[(NH4)2SO4,cr]=6.72kJ/mol。
与文献[6]的 Δsol[(NH4)2SO4,cr]=6.2kJ/mol相比,实验相对误差为8.45%。
5 结果与讨论
5.1 中和热的比较
按文献[15]提供的标准摩尔生成焓数据计算得到的强酸与强碱反应的中和热为-55.81kJ/mol。
由于弱碱NH3·H2O的解离是吸热反应,所以本实验中强酸与弱碱反应的中和热较低:
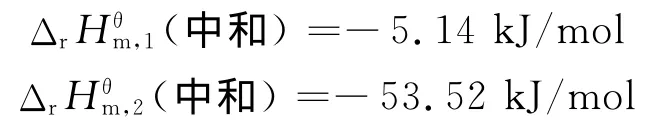
5.2 氯化铵和硫酸铵生成焓的比较
参照文献[3]给出的 ΔfHθm[NH3,aq]=-81.20 kJ/mol、ΔfHθm[HCl,aq]=-167.08kJ/mol和ΔfHθm[H2SO4,aq]=-909.27kJ/mol,并利用上述的中和热与溶解热,计算生成焓如下:
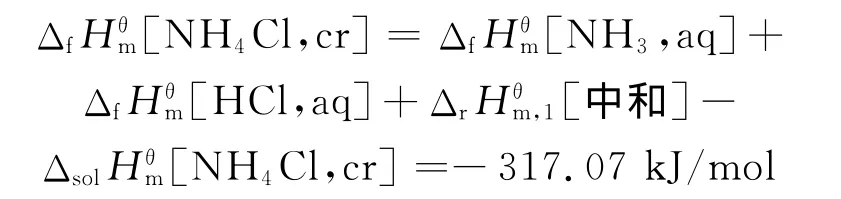
与文献[15]的ΔfHθm[NH4Cl,cr]=-314.5kJ/mol相比,实验的相对误差为0.85%;

与文献[15]的 Δf[(NH4)2SO4,cr]=-1 180.9kJ/mol相比,实验相对误差为0.38%。
5.3 氯化铵和硫酸铵晶格能的计算
(1)参照文献[6]给出的气态离子的水合热数据(Δh[,g]=-307kJ/mol,Δh[Cl-,g]=-378kJ/mol),Δh[,g]=1 059kJ/mol,并利用上述的溶解热数据,计算氯化铵和硫酸铵的晶格能的实验值分别为:

与文献[7]的Δlat[NH4Cl,cr]=698kJ/mol相比,实验相对误差为0.38%。

与文献[7]的 Δlat[NH2SO4,cr]=1 679.2kJ/mol相比,实验相对误差为0.03%。
(2)氯化铵和硫酸铵晶格能的理论计算。在不知道离子晶体晶格结构的情况下,除了借助实验数据,根据Born-Harber热化学循环来间接推算晶格能U外,还可用Φерсман(费尔斯曼)和 Каnyстинский(卡普斯钦斯基)公式计算晶格能[16-18]。NH4C1和(NH4)2SO4晶格能的计算值和实验值见表1,计算值与实验值基本相符,说明它们是比较典型的离子晶体。
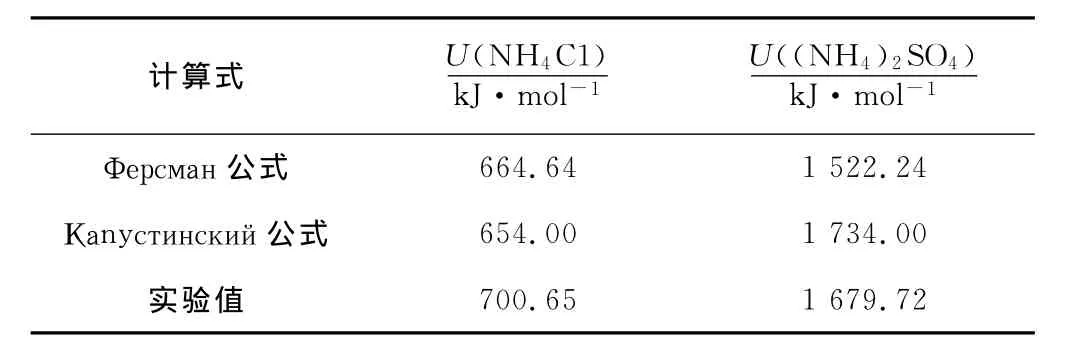
表1 NH4C1和(NH4)2SO4晶格能的计算值和实验值
(References)
[1]浙江大学普通化学教研组.普通化学实验[M].3版.北京:高等教育出版社,1996:73-76.
[2]古凤才,肖衍繁,张明杰,等.基础化学实验教程[M].2版.北京:科学出版社,2005:353-360.
[3]沈君朴.实验无机化学[M].2版.天津:天津大学出版社,1992:59-62.
[4]华东化工学院无机化学教研组.无机化学实验[M].3版.北京:高等教育出版社,1990:35-37.
[5]冯清.问题引导下的探究式实验教学模式研究[J].实验技术与管理,2012,29(5):164-165.
[6]唐宗薰.无机化学热力学[M].北京:科学出版社,2010:37-229.
[7]陈叔平.实验是培养创新人才的必由之路[J].实验室研究与探索,2012,31(3):1-3.
[8]陈旭红.用Origin软件的线性拟合和非线性曲线拟合功能处理实验数据[J].江苏技术师范学院学报,2006,12(6):85-89.
[9]李军.化学实验室绿色化之思考[J].化学教育,2002(1):37-39.
[10]刘葵,汪建民.循环实验模式的构建与教学实践[J].实验室研究与探索,2012,31(3):140-142.
[11]周晓明.STS教育与绿色化学教育[J].现代教育科学,2004(3):86-89.
[12]曹文高,赵小林,范华汉.无机化学系列化实验的介绍[J].大学化学,1992,7(1):49.
[13]Zhang L J,Di Y Y,Dou J M.Crystal structure and thermochemical properties of n-decylammonium ethyl sulfate(C10H21NH3SO4C2H5)(s)[J].J Chem Thermodynamics,2013,57:54-58.
[14]赵新华.化学基础实验[M].北京:高等教育出版社,2004:171-172.
[15]John A Dean.兰氏化学手册[M].2版.魏俊发,译.北京:科学出版社,2003.
[16]李丙瑞.结构化学[M].2版.北京:高等教育出版社,2011:427-429.
[17]李丙瑞.晶格能与 Madelung常数[J].化学通报,1992(1):46-49.
[18]吴自慎,严振寰.晶格能和玻恩:哈伯循环及其在无机化学中的应用[J].华中师院学报,1982(4):119-136.
