牛传染性鼻气管炎病毒的分离鉴定与灭活疫苗免疫效果研究
2013-11-23胡义彬潘延钵贺亚奇邓玉芹北京生泰尔生物科技有限公司北京昌平02206北京华夏兴洋生物科技有限公司北京大兴02629
赵 卓,胡义彬,潘延钵,贺亚奇,邓玉芹,王 力,2(.北京生泰尔生物科技有限公司,北京昌平02206;2.北京华夏兴洋生物科技有限公司,北京大兴02629)
牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV)是引起牛的一种急性热性接触性传染病,以高热、呼吸困难、鼻炎和上呼吸道炎症为特征。该病在世界各地普遍存在,主要的经济损失在于延缓肥育牛的生长和增重,患病奶牛产乳量下降,继发流产,其流产率有时高达50%,急性发病期牛死亡率可达10%[1]。文献报道我国大部分地区也存在该病的流行,并由疑似病例中成功分离到了IBR病毒[2-4],但很多牛场仍缺乏对牛传染性鼻气管炎病的足够认识。控制本病的主要措施在于应用疫苗进行免疫预防接种。但在我国,目前尚无IBR疫苗产品上市。本研究成功分离到了一株免疫原性良好的牛传染性鼻气管炎病毒,并采用该毒株进行了灭活疫苗的初步研究。
1 试验材料
1.1 病料 疑似发病牛眼鼻分泌物及生殖道分泌物。
1.2 细胞、抗原及血清 MDBK细胞、IBRV中和试验抗原、IBR阳性血清均购自中国兽医药品监察所菌种保藏中心。
1.3 试验动物 1~3月龄IBR中和抗体≤1∶2的健康犊牛25头,购自北京市北郊奶牛场。体重为
1.5 ~2 kg日本大耳白家兔20只,购自北京维通利华实验动物技术有限公司。
1.4 试剂 DMEM培养基,GBICO公司;胎牛血清,兰州民海生物工程有限公司;Taq聚合酶,宝生物工程(大连)有限公司;PCR引物,由上海生物工程技术有限公司合成;疫苗佐剂(603佐剂),由北京生泰尔生物科技有限公司提供。
1.5 仪器设备 PCR仪、电泳仪、凝胶成像仪、96孔细胞培养板、CO2细胞培养箱、倒置生物显微镜,由北京生泰尔生物科技有限公司提供。
2 试验方法
2.1 病料采集与处理 选取表现典型IBR临床症状的5头牛,分别采集鼻腔拭子和生殖道分泌物拭子,放入运输培养液中(含1000单位/mL青霉素、1000 μg/mL链霉素和20%血清的DMEM),4℃作用过夜。冻融2次后,10000 r/min离心10 min,取上清液用0.22 μm微孔虑膜进行虑过除菌,-20℃保存。
2.2 病毒分离 取上清液1 mL接种于长满MDBK细胞单层的细胞培养瓶中,37℃吸附1 h,倾去液体,加入维持液(含青霉素200单位/mL、链霉素200 μg/mL和2%血清的DMEM),于37℃,含5%CO2的培养箱中培养,每天观察细胞病变(CPE),待70% ~80%细胞出现CPE时收毒,如果细胞不出现CPE,5 d后盲传,连续盲传3代。
2.3 病毒蚀斑克隆纯化 将病毒培养液做10倍系列稀释到10-6,接种长成良好的MDBK细胞单层的6孔细胞培养板;每孔接种病毒稀释液200 μL,每个稀释度病毒液接种2孔,置细胞培养箱中吸附1 h,每20 min摇动一次使病毒分布均匀;吸附后弃去6孔板内病毒液;然后取细胞培养液加入等量的1%琼脂(60℃水浴加热)中,混匀,冷却到40℃时加入细胞培养板中,每孔加入2~3 mL,凝固后置37℃含5%CO2的细胞培养箱中继续培养;待适当稀释度出现单个蚀斑后,吸取噬斑处琼脂加入营养液中使其溶解后作为收获病毒,收获后的病毒液接种单层MDBK细胞继续培养增殖。
2.4 病毒TCID50的测定 待96孔细胞培养板中的MDBK细胞长满单层后,将病毒做10倍系列稀释后,每一稀释度接种8孔,0.1 mL/孔,37℃吸附1小时,补加细胞维持液,0.1 mL/孔。培养板置37℃,含5%CO2的培养箱中培养,逐日观察7 d后,采用Reed-Muench法,计算IBR病毒TCID50。
2.5 血清中和试验 将IBRV阳性血清于56℃灭活30 min后,作连续2倍倍比稀释后,加入等体积的IBR病毒(200 TCID50/0.1mL),37℃中和1 h。然后将血清-病毒中和液加入长满单层MDBK细胞的96孔板中,每个血清稀释度接种4孔,每孔0.2 mL。于CO2培养箱中培养,逐日观察细胞病变。
2.6 PCR检测
2.6.1 引物设计与合成 根据Genbank中公布的IBRV全基因序列,选取gB蛋白全基因组序列,利用Primer Premier 5软件设计如下引物序列进行目的基因片段的扩增:
gb-F:5’-CGAGGAAGAGGAGGAGTTTGACG-3’
gb-R:5’-GCACCCGAACTGCCCATACATAG-3’
2.6.2 病毒DNA的提取 将病毒培养物冻融2~3 次后,取560 μL 加入30 μL 100 g/L SDS和3 μL 20 g/L蛋白酶K,37℃水浴60 min,先后以酚/氯仿和氯仿各抽提1次,0.8倍体积异丙醇沉淀,700 mL/L乙醇洗涤,干燥后加适量无核酸酶水溶解。
2.6.3 PCR扩增 50 μL反应体系中加入10×Ex Taq buffer 5 μL、dNTP(各 2.5 mmol/L)4 μL、MgCl2(25 mmol/L)4 μL、引物(20 μmol/L)各0.5 μL、Ex TaqTM 酶 0.25 μL、病毒 DNA 2 μL、ddH2O至50 μL。瞬间离心后进行PCR扩增。同时设MDBK细胞DNA和无DNA的空白对照。扩增条件为:95℃预变性5 min,95℃ 1 min,65℃45 s,72 ℃ 45 s,10 个循环;95 ℃ 1 min,54 ℃ 45 s,72 ℃ 45 s,15个循环;95 ℃ 1 min,60 ℃ 45 s,72 ℃45 s,10个循环,最后72℃延伸10 min。PCR产物用20 g/L琼脂糖凝胶电泳后观察结果。
2.6.4 目的片段测序 将PCR扩增产物回收后进行序列测定,根据测序结果做进一步验证。
2.7 动物回归试验 选用IBR抗体阴性牛5头,其中3头采用滴鼻和喷雾的方式共接种IBRV液10 mL(含107.3TCID50),每天测定体温,观察临床症状。另2头作为空白对照组,试验组与对照组隔离饲养。试验牛出现典型的临床症状时,采集眼鼻或阴道分泌物进行病毒分离和PCR检测,发病后3~5 d扑杀作病理解剖学观察。
2.8 疫苗的制备 将IBRV进行增殖培养后,进行病毒含量测定和无菌检验,检验合格后进行病毒灭活。然后将病毒灭活液与603佐剂按照2∶1的比例混合、搅拌均匀。
2.9 疫苗的检验
2.9.1 常规检验 按照现行《中国兽药典》的方法分别进行无菌检验、稳定性检验、黏度检验、甲醛残留检验[5]。
2.9.2 小白鼠安全性检验 每批疫苗经背部皮下接种IBR灭活疫苗0.3 mL,每组10只,观察14 d,记录小白鼠的死亡情况及全身和局部的不良反应。
2.9.3 效力检验 每批IBR灭活疫苗免疫接种5头牛,每头牛肌肉注射2 mL,21 d加强免疫一次。同时每批疫苗免疫接种家兔5只,每只肌肉注射0.5 mL,21 d以同样剂量加强免疫一次。二免后14 d采血,分离血清,进行血清中和抗体测定。
2.9.4 攻毒保护试验 IBR灭活疫苗二免后14 d进行采血后,随即连同对照牛进行攻毒,每头牛采用滴鼻的方法接种F4代牛传染性鼻气管炎病毒10 mL(含107.3TCID50),攻毒后每天观察临床症状和体温变化,观察15 d。根据牛的发病情况计算免疫牛的攻毒保护率。
3 结果
3.1 病毒分离和TCID50测定 采集疑似发病牛鼻腔拭子和生殖道分泌物拭子样品接种MDBK细胞后,其中1份样品在第1代的第3天出现死亡细胞明显增多的现象,而对照细胞生长良好(图1);传至第2代,在第2天观察到特异性CPE,表现为细胞圆缩,聚集,在单层细胞上形成空洞,之后细胞脱落(图2),第3天70% ~80%细胞出现CPE,细胞圆缩、死亡、脱落。病毒培养物经蚀斑纯化后连续传3代,CPE出现的时间和病变特征与前几代相似。收获蚀斑纯化后的第3代病毒培养物,冻融1次,分装,经TCID50测定,病毒毒价为107.7TCID50/mL。
3.2 病毒蚀斑克隆纯化 将第2代病毒培养物进行病毒蚀斑纯化,结果在第4天即可看到典型的病毒蚀斑(图3),吸取蚀斑处琼脂收获病毒,收获后的病毒液接种单层 MDBK细胞继续培养增殖,在MDBK单层细胞上仍可出现典型的细胞病变效应。
3.3 血清中和试验 阳性血清做1∶16倍稀释后可以与IBR病毒培养物完全中和,MDBK细胞对照无细胞病变产生。而32倍稀释的血清与病毒中和后有1/4孔细胞出现细胞病变,细胞呈现园缩聚集成团,细胞间出现空洞,最后圆缩脱落。
3.4 PCR扩增 图4结果显示,分离培养物和IBRV标准株均能扩增出与目的基因片段大小一致的特异性条带。
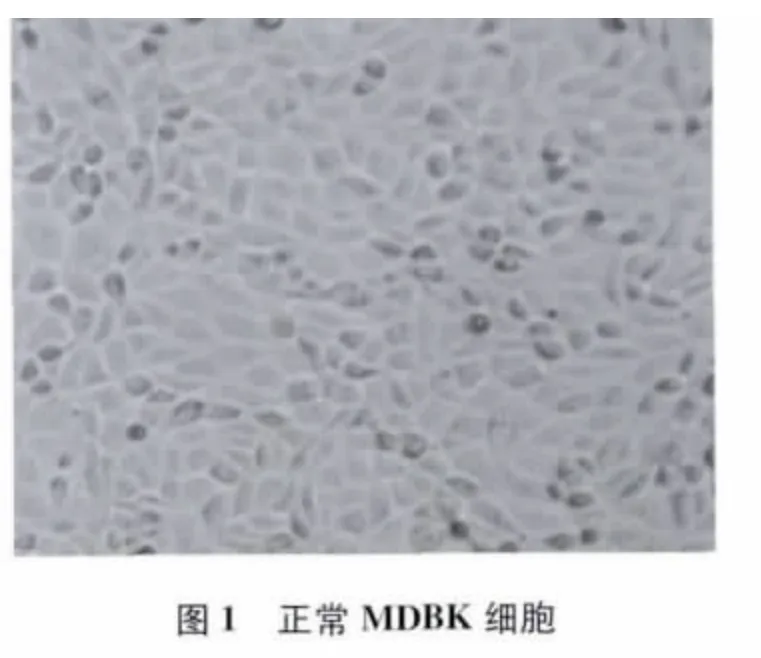
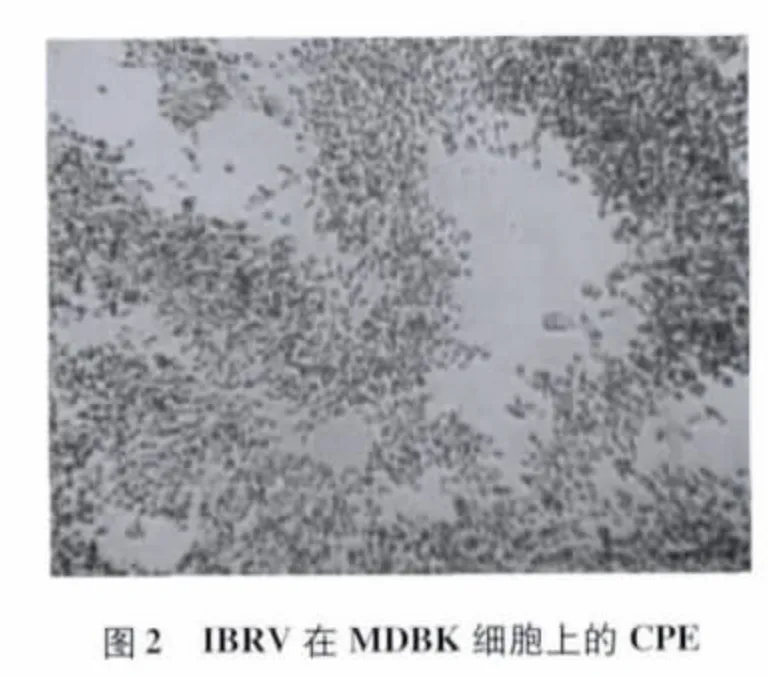
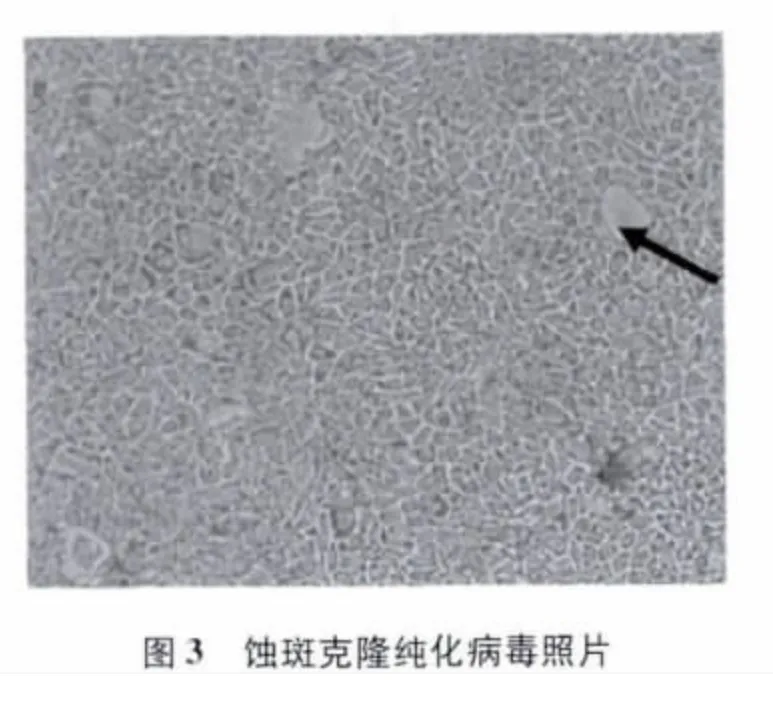
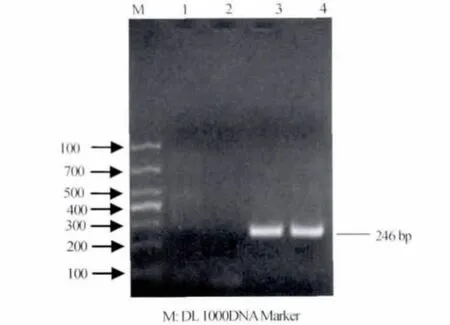
图4 IBRV特异性片断基因扩增结果
3.5 扩增产物测序 将PCR扩增产物回收后送上海生物工程技术有限公司进行测序。测序结果采用序列分析软件分析,并将测序序列与GenBank中的牛IBR病毒基因序列进行Blast比对,基因序列同源性达99%。
3.6 动物回归试验 3头犊牛在攻毒后24 h出现发热,温度达到40.9℃;攻毒后3 d,3头牛均出现鼻镜潮红,流泪,精神萎靡,食欲减退的症状;观察至第5天,牛的鼻腔及眼角有多量的浓性分泌物,出现咳嗽、拒食、发热等典型症状,与IBR临床症状相符。其中1头牛在攻毒后20 d临床症状逐渐减轻,食欲逐渐恢复。另外一头牛进行剖检观察,可见气管出血,粘膜脱落,牛鼻腔中充满了脓性分泌物,堵塞整个鼻道。
3.7 病毒分离与PCR检测 结果显示,分离物在MDBK细胞上能产生典型细胞病变效应,病毒培养物PCR检测结果呈阳性,确诊为IBR病毒感染发病。
3.8 疫苗的制备和检验 将实验室制备的三批IBR灭活疫苗分别进行各项检验。表1结果表明,采用603佐剂制备的IBR灭活疫苗性状良好、稳定性好、黏度低、对小白鼠安全。
3.9 疫苗效力检验 将制备的三批灭活疫苗分别免疫抗体阴性牛,并对免疫牛进行IBR病毒攻毒试验和中和抗体效检测定。表2结果表明,免疫后IBR中和抗体效价较高,抗体效价几何平均值可达1∶41以上,攻毒后免疫组牛均无IBR临床症状,可达5/5保护。而对照组牛出现不同程度的发热,持续高温3 d以上,鼻镜潮红,流泪,眼睛有浓性分泌物,食欲减退等症状,剖检后观察可见对照组牛的鼻腔内有脓性分泌物,靠近肺端气管有大量的白色泡沫等病理变化。免疫家兔后抗体效价几何平均值也可达1∶42以上,初步表明牛和家兔二者抗体效价存在一定的平行性。
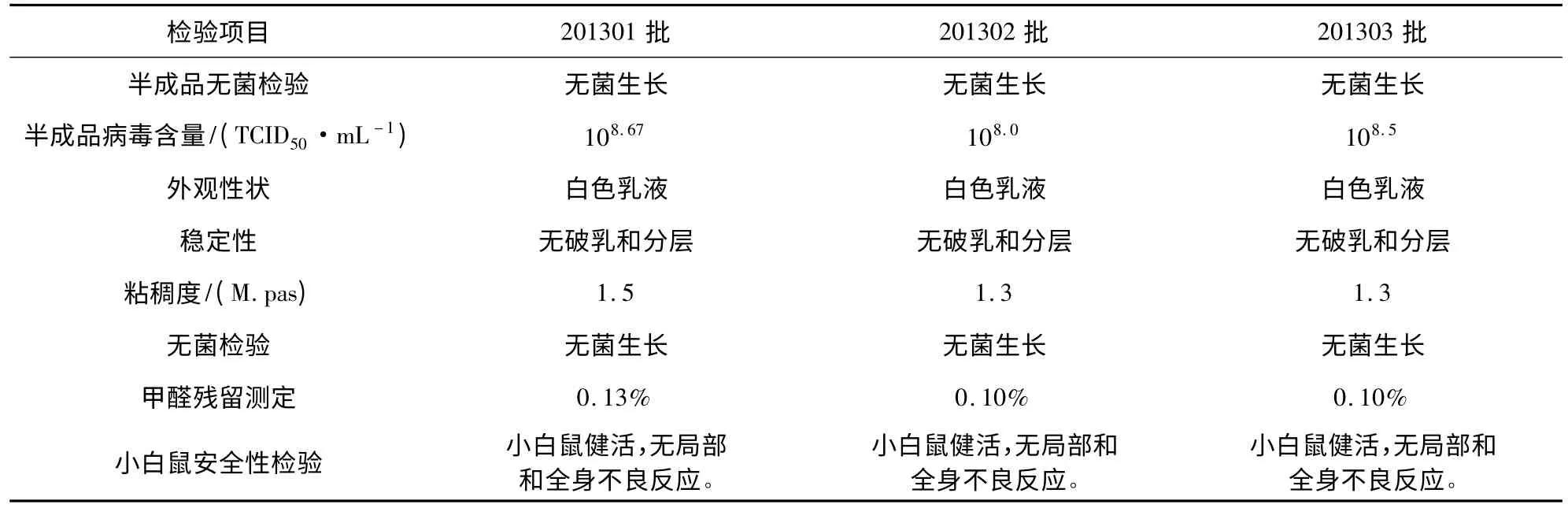
表1 三批IBR灭活疫苗各项检验结果
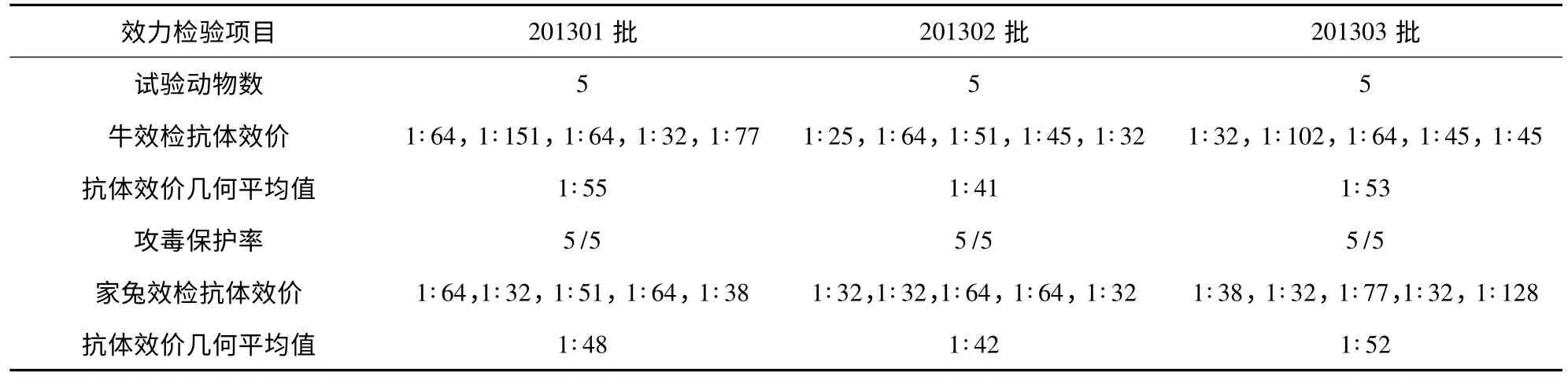
表2 三批IBR灭活疫苗免疫效力试验结果
4 小结
本研究采用MDBK细胞成功从疑似病例牛的鼻腔分泌物、阴道分泌物拭子中分离出IBR病毒。病毒在MDBK细胞上可产生明显的细胞病变效应,且能被IBR阳性血清完全中和。采用特异性引物进行PCR检测,可扩增出特异性目的片段,扩增产物经测序与已发表的IBRV基因组序列一致。结果表明分离株为IBR病毒,从而也进一步证实了本病在我国的存在。
国外采用IBR灭活疫苗防控本病取得了很好的效果[6-7],但在国内该疫苗的研制尚处于实验室研究阶段[8]。本研究制备的IBR灭活疫苗免疫抗体阴性牛,中和抗体效价平均值可达1∶41以上,高于美国联邦法规(9CFR)标准(≥1∶8),证明疫苗免疫效果理想,为下一步开展IBR灭活疫苗新产品研发奠定了基础。
[1]王家驹,李亚明.牛传染性鼻气管炎的研究[J].中国畜禽,1994,76(3):1-3.
[2]封启民.我国牛传染性鼻气管炎血清抗体普查报告[J].动物检疫,1982,(1):36-39.
[3]王淑娟,孙成友,宋晓晖.牛传染性鼻气管炎的诊断、流行病学调查及防控[J].中国畜牧兽医文摘,2012,28(9):95-96.
[4]徐晓琴,冷 血,李真光,等.牛传染性 鼻气管炎病毒IBRV-LN01/08株的分离鉴定[J].中国兽医科学,2010,40(4):352-356.
[5]中国兽药典委员会.中华人民共和国兽药典二○一○年版三部[S].
[6]Pospisil Z,Krejci J,Jinek P,et al.Development of a disease control programe based on the use of an inactivated vaccine against infectious bovine rhinotracheitis[J]. Veterinary Micrology,1996,53:199-206.
[7]Patel J R.Relative efficacy of inactivated bovine herpesvirus-1(BHV-1)vaccines[J].Vaccine,2005,23:4054–4061.
[8]冷 血,赵炳武,郭 利,等.牛传染性鼻气管炎灭活疫苗的安全性和免疫保护效果[J].中国兽医科学,2010,40(11):1161-1165.
