参麦合剂对兔干眼症模型泪液分泌及眼表结构的影响
2013-11-21丛晨阳毕宏生解孝锋郭大东杜然然
丛晨阳 温 莹 毕宏生, 解孝锋 郭大东 杜然然
(1山东中医药大学山东,济南,250012;2山东中医药大学附属眼科医院,济南,250002;3山东中医药大学眼科研究所,济南,250002)
干眼症是由于泪液质和量的异常引起泪膜的不稳定和眼表损害,从而导致眼部不适。西医以局部对症治疗为主,效果不显著且存在副作用。中医学认为本病是五脏六腑功能失调,或燥邪所伤致津液耗伤而产生。随着中医药对干眼症研究的不断深入,通过辨证论治、专方验方、局部用药、针刺、穴位按摩、中药喷雾等治疗均有良好的疗效,临床观察结果显示患者的各种症状、体征及实验室指标都有一定程度的改善,并且无西药的不良反应[1]。参麦合剂是根据中医基础理论,筛选出鬼针草、玄参、麦冬制成的配方颗粒,三药合用有清热养阴润目的作用。本研究通过观察参麦合剂颗粒剂灌胃对兔干眼症模型泪液分泌及眼表结构的影响,为临床用药提供理论依据。
1 材料和方法
1.1 材料
1.1.1 实验动物 选用健康新西兰大白兔30只(山东中医药大学动物试验室提供),雌雄不限,体重2.1~2.5 kg。动物的饲养及环境均遵循国际眼科与视觉科学研究中动物实验的标准。
1.1.2 主要试剂 参麦合剂为山东中医药大学附属眼科医院院内协定方,鬼针草、玄参、麦冬(1∶2∶2)三蒸水配制成浓度0.3 g/mL口服液(华润三九医药股份有限公司);苯扎氯胺(benzalkonium chloride,BAC)(Sigma)三蒸水配制成浓度0.1%溶液;Schirmer试验滤纸条(天津晶明新技术开发有限公司);荧光素钠眼科检测试纸(天津晶明新技术开发有限公司);硝酸纤维素膜(PALL);过碘酸-席夫(PAS)染色试剂盒(上海源叶生物科技有限公司)。
1.2 方法
1.2.1 实验动物分组 30只新西兰大白兔按随机数字表法分为3组:空白对照组、实验对照组、药物治疗组,每组10只。
1.2.2 动物模型的制备 所有动物选取右眼为实验眼滴用0.1%苯扎氯胺(BAC)4周,2次/d,建立干眼动物模型[2]。4周后,检查干眼模型兔,见角结膜外观干燥,泪液量少,Schirmer试验值均<10 mm/5 min(对照组均>10 mm);泪膜破裂时间(break up time,BUT)均<10 s;荧光素染色见角结膜点、片状着色,即为模型制作成功[3]。
1.2.3 药物配制和用法 参麦合剂(鬼针草、玄参、麦冬颗粒剂)稀释液,浓度0.3 g/mL。药物治疗组在建立动物模型的基础上给予参麦合剂灌胃干预,根据兔体重配比率(1 mL/kg)每日灌胃1次;实验对照组同时灌胃等体积生理盐水;空白对照组不做任何治疗,其正常眼作为正常对照组。
1.3 标本取材及检测 实验动物均由同一人检查。检查时间、地点、照明亮度及温度相同。于给药后第7,14,21,28 d,分别在裂隙灯下观察兔角结膜外观、荧光素染色、BUT;同时做Schirmer试验,结膜印迹细胞学检查(CIC)。给药后28 d,以空气栓塞法处死动物后,每组随机取5只新西兰兔剪取角膜和距角膜缘2 mm上方中央球结膜组织,光镜下观察组织病理学改变。
1.3.1 Schirmer试验 盐酸奥布卡因表面麻醉后1 min后,棉签蘸干眼睑周围液体,将Schirmer试纸置于兔下方结膜囊的中、外三分之一交界处,其余部分悬垂于皮肤表面,闭眼,5 min后取出滤纸条,测滤纸条的浸湿长度。
1.3.2 BUT 将荧光素钠眼科检测试纸条放置在下睑结膜囊片刻,使荧光素钠均匀分布于眼表后维持眼睑张开,在裂隙灯显微镜下用钴蓝光观察,直至泪膜上出现第1个干燥斑,记录从眼睑张开到第1个干燥斑出现的时间,连续测量三次,取平均值并记录。
1.3.3 结膜印迹细胞学检查(CIC) 治疗后第7,14,21,28 d各组分别行结膜印记细胞学检查。将硝酸纤维素膜剪成3.5 mm×3.5 mm大小,以蒸馏水浸泡4h,烘干,备用。表面麻醉后分别将两片硝酸纤维素膜粗糙面向下置于鼻上和颞上象限球结膜,持续按压10秒印取表层上皮细胞。将滤膜置于95%乙醇中固定。过碘酸席夫试剂(PAS)染色。光学显微镜下计数杯状细胞,根据Nelson评分标准[4]进行分级。
1.3.4 组织病理学检查:将剪下的角膜和结膜组织置于10%福尔马林固定24 h。梯度脱水后,石蜡包埋和切片,HE染色,结膜加做PAS染色。
1.4 统计学方法 采用SPSS 16.0统计学软件进行统计分析,实验结果以均数±标准差(±s)表示。同一时间点,各组Schirmer test值、BUT值比较均采用单因素方差分析法,并进一步采用LSD-t检验法两两比较。比较同一组内不同时间点之间的差异,则采用配对t检验。以P<0.05作为差异有统计学意义。
2 结果
2.1 Schirmer试验 兔干眼症模型Schirmer test值均<10 mm。治疗前空白对照组、实验对照组和药物治疗组的 Schirmer test值分别为(8.40±0.76)mm、(8.60±0.77)mm、(8.49±0.65)mm,差异无统计学意义(F=0.098,P=0.907)。治疗第14 d,药物治疗组Schirmer test值为(12.07±0.84)mm,较用药前明显升高(t=-51.694,P=0.000),较空白对照组和实验对照组亦明显升高(F=26.742,P=0.000),空白对照组和实验对照组之间差异无统计学意义(t=0.559,P>0.05);用药28 d后,药物治疗组 Schirmer test值为(16.01±1.33)mm,较治疗前明显延长(t=-28.161,P=0.000),较空白对照组和实验对照组亦明显延长(F=82.090,P=0.000),空白对照组和实验对照组之间差异无统计学意义(t=-1.758,P>0.05),见表1。
2.2 BUT 泪膜破裂时间均<10 s。治疗前空白对照组、实验对照组和药物治疗组的BUT值分别为(8.95±1.30)s、(8.74 ±0.65)s及(8.29 ±1.12)s,差异无统计学意义(F=0.550,P=0.583)。治疗第14 d,药物治疗组BUT值为(10.57±1.40)s,较治疗前明显延长(t=-7.921,P=0.000),较空白对照组和实验对照组亦明显延长(F=3.977,P=0.031),空白对照组和实验对照组之间差异无统计学意义(t=0.094,P>0.05);用药28 d后,药物治疗组BUT值为(14.27±1.82)s,较治疗前明显延长(t=-16.476,P=0.000),较空白对照组和实验对照组亦明显延长(F=29.706,P=0.000),空白对照组和实验对照组之间差异无统计学意义(t=-1.208,P>0.05)(表2)。

表1 各组用药后Schirmer test值的变化(mm)
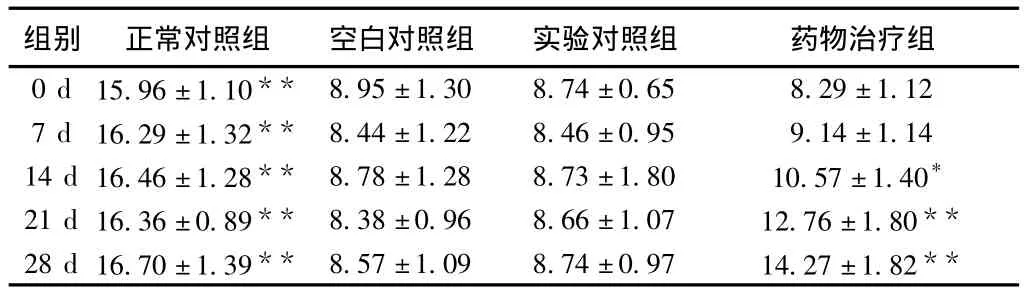
表2 各组用药后BUT值的变化(s)
2.3 荧光素钠染色(FL) 干眼模型制作完成后,肉眼可见兔角结膜外观干燥无光泽;荧光素染色见角结膜点、片状着色。药物治疗组用药7 d后,兔角结膜外观干燥较用药前略有好转,泪液量少,但角结膜点、片状着色较干眼症组明显好转:治疗14 d后,角结膜干燥进一步好转,泪液量增加,角结膜点、片状着色少;治疗28 d后,角结膜外观湿润,泪液明显增加,角结膜未见着色。
2.4 结膜印迹细胞学检查(CIC) 干眼模型组与正常对照组之间杯状细胞密度的差异有统计学意义。给药后,药物治疗组杯状细胞密度逐渐增加,与给药前相比差异有统计学意义;空白对照组与实验对照组各时间点杯状细胞密度与给药前差异无统计学意义(图1)。结膜印迹细胞学检查采用目前公认的Nelson评分标准[4]进行分级。鳞状上皮化生分为4个级别,0级:正常;Ⅰ级:轻度;Ⅱ级:中度;Ⅲ级:重度。正常兔眼Nelson分级为0级,干眼症眼分级为Ⅱ级。给药后,药物治疗组杯状细胞密度逐渐增加,形态趋于正常。空白对照组与实验对照组各时间点杯状细胞密度和形态与给药前无明显差异(图2)。
2.5 光镜检查 显微镜下可以看到,在正常结膜上皮由柱状的上皮细胞层和3-4层立方细胞构成,PAS阳性的杯状细胞穿插其中(A)。在空白对照组(B)和实验对照组(C)中,结膜变薄,立方细胞层消失,PAS阳性的杯状细胞显著减少。药物治疗组(D)与正常兔眼对比结膜杯状细胞数量未见明显差异,但结膜上皮层数较正常兔眼减少。
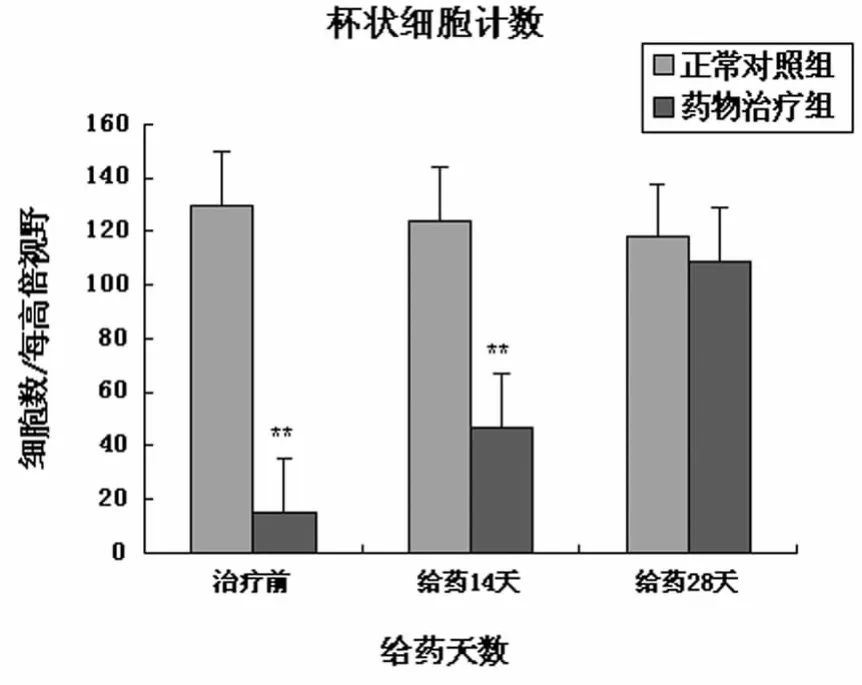
图1 正常对照组及药物治疗组杯状细胞密度(*P <0.05,**P<0.01)

图2 (A)正常兔眼,Nelson分级为0级。(B)治疗前,Nelson分级为Ⅱ级。(C)治疗14天后,Nelson分级为I级。P(D)治疗28天后,Nelson分级为0级。(×200)

图3 结膜石蜡切片(×200)
3 讨论
国际干眼工作组于2007年定义干眼为:多种因素所致的一种泪液和眼表疾病,包括眼表不适症状,视力变化和泪膜不稳定并且有潜在眼表损害,伴随泪液渗透压升高和眼表炎症反应[5]。西医对干眼症发病机制的研究发现,炎症是干眼症发病机制中最关键的因素[6]。性激素分泌失衡[7]、神经功能障碍[8]和细胞凋亡[9]也共同参与干眼症的发病过程。泪膜的持续异常可损伤眼表正常的修复或防御机制,导致眼表和泪腺处于一种慢性炎症状态。中医学又将干眼症称为“神水将枯”,《审视瑶函》谓“此症南人俗呼白眼,其病不肿不赤,只是涩痛,乃气分隐伏之炎,脾肺络湿热,秋天多患此。”说明了干眼症与五脏六腑息息相关,当五脏六腑功能失调,其正常功能受燥邪所伤,必然会导致五脏津液耗伤,不能发挥其正常的生理功能,而发生本病。不同类型的干眼症表现出类似眼表异常的病理改变。干眼的眼表损害主要包括角膜改变和结膜改变。角膜改变主要包括角膜上皮的形态改变、干燥失活、完整性破坏和化生,亦包括角膜敏感性降低、厚度变薄、表面规则性降低。结膜改变主要包括结膜上皮角化、细胞形态不规则、胞核形态及致密度不同、核胞浆比下降、上皮下炎症细胞浸润及杯状细胞大量丢失并接近消失[10]。
针对已知的发病机制,西医治疗干眼症具有一定的局限性,对症治疗为主,对潜在病因未予治疗。药物多以局部用药为主,增加角膜表面水液存留,提高角膜湿性,刺激泪液分泌等,但毒副作用较多。主要采取补充人工泪液、局部滴用糖皮质激素和0.1%环孢素滴眼液等抗炎药物治疗[11]。手术治疗包括泪小点栓塞和自体颌下腺移植[12],但存在并发症的风险,应慎重选择。近几年来,中西医结合在治疗干眼症方面发展较快,在中医理论指导下结合现代医学理论和检测手段,是目前干眼症治疗的一条崭新的思路。结合古代文献及现代临床经验,干眼症是由泪液分泌减少或泪液的质发生改变引起的,阴精亏虚是干眼发病的基础,阴虚、内燥、虚火浮越、津液不能上营是本病发病的主要病机,治则当以养阴清热,促进泪液分泌为主。
近年对眼表黏蛋白层的深入研究表明,其带有水溶性及脂溶性,能降低泪膜表面张力,同时,泪膜的光滑完整性也依赖于眼表黏蛋白的活性,泪膜中黏蛋白在角膜上皮细胞表面形成一层多糖被,使得角膜表面从疏水性转化为可湿润的亲水性,增加水一黏蛋白在眼表的分布能力,以形成完整的泪膜湿润眼表[13]。由结膜杯状细胞分泌的黏蛋白-MUC5AC是构成泪膜中黏蛋白层的主要成分[14]。眼表的干燥性疾病常导致杯状细胞数量减少,进而影响黏蛋白合成和分泌。单纯补充眼表水分很难恢复泪膜的稳定性。因此在有效促进泪液分泌的基础上,增加眼表黏蛋白的合成和表达是恢复眼表健康的重要前提。参麦合剂是根据中医基础理论,筛选出鬼针草、玄参、麦冬制成的配方颗粒,《中药大辞典》记载鬼针草具有使人流泪的作用[15],据现代药理研究报道,鬼针草具有拟胆碱能的作用,可增加泪液分泌,引起多泪。麦冬具有养阴清热、润肺的功效,适宜于阴虚肺燥导致的眼睛干涩,泪液分泌减少。玄参苦寒清降,咸寒而润,主入肾经以滋阴降火,又入血分以凉血解毒,能滋补肝肾,退虚热,养肝明目。故三药合用,共奏清热养阴润目之功。已有研究表明泪腺、副泪腺和结膜杯状细胞都受副交感神经支配,而鬼针草具有拟胆碱作用[16]能增加黏蛋白的分泌。玄参、麦冬清热养阴,促进泪液分泌。
建立一种模拟干眼病自然病因、病程的干眼模型对干眼病发病机制和治疗的研究非常重要。兔干眼模型是常用的干眼动物模型之一,本实验采用局部滴用0.1%苯扎氯胺构建兔干眼模型。广泛研究表明,滴眼液中的防腐剂与干眼症状有关,因此,局部使用防腐剂建立干眼模型符合干眼发病的自然原因,且局部用药避免了机械法、免疫性、内分泌控制等方法对全身带来的副作用,而适当的浓度也避免了对眼表造成的不可逆损害,适合对干眼症疗效进行观察。文献研究表明,局部应用0.1%苯扎氯胺引起的兔眼表损害符合人类干眼病表现[6]。
Schirmer试验是测量泪液产生量的常用方法,本实验在表麻下进行,药物治疗组Schirmer试纸湿长较其余两组增加,表明参麦合剂用药后基础泪液分泌增加。荧光素钠染色直接反映眼表损害情况。本实验中干眼症组荧光素钠染色弥漫点状着色,符合干眼症的临床特征,药物治疗后着色面积减少,说明该药可改善眼表健康状况。CIC是一种简单易行、无创伤、可重复性好的眼表细胞学检查方法,被认为是诊断干眼中最有效的病理检查[4],因其可以在整个实验过程中进行,所以常使用CIC来观察杯状细胞密度的变化以及进行眼表损害情况分级。CIC结果反映了干眼模型组结膜杯状细胞减少,细胞形态改变,随着参麦合剂灌胃治疗的进行,结膜杯状细胞的密度增加,形态趋向正常。光学显微镜下观察,在正常兔眼结膜上皮由柱状的上皮细胞层和3-4层立方细胞构成,PAS阳性的杯状细胞穿插其中。干眼症模型结膜变薄,立方细胞层消失,PAS阳性的杯状细胞显著减少。药物治疗后药物治疗组与正常兔眼对比结膜细胞数量未见明显差异,结膜上皮层数较前减少。
综上所述参麦合剂灌胃治疗兔干眼模型4周后能明显改善泪液分泌及眼表细胞结构,在干眼症的治疗方面有一定的应用前景。为进一步研究药物的作用机理和临床用药提供了依据。
[1]叶康,王中林.中医治疗干眼症临床研究[J].吉林中医药,2010,2:114-115.
[2]Burstein NL.Preservative cytotoxic threshold for benzalkonium chloride and Chlorhexidine digluconate in cat and rabbit corneas[J].Invest Ophthalmol Vis Sci,1980,19:308-313.
[3]Cuiju Xiong,Dong Chen,Jingbo Liu,et al.A Rabbit Dry Eye Model Induced by Topical Medication of a Preservative Benzalkonium Chloride[J].Invest Ophthalmol Vis Sci,2008,49(5):1850-1856.
[4]Nelson JD.Impression cytology[J].Cornea,1988,7:71- 81.
[5]The definition and classification of Dry Eye Disease:Report of the Definition and classification subcommittee of the international Dry Eye Work shop(2007)[J].Ocul surf,2007,5(2):75-92.
[6]Margarita Calonge,Amalia Enríquez- de- Salamanca,Yolanda Diebold,María J.et al.Dry Eye Disease as an Inflammatory Disorder.Ocular Immunology & Inflammation,2010,18(4):244-253.
[7]Schirra F,Seitz B,Knop N,et al.Sex hormones and dry eye[J].Ophthalmologe,2009,106(11):988-94.
[8]Liu Q,McDermott AM,Miller WL.Elevated nerve growth factor in dry eye associated with established contact lens wear[J].Eye Contact Lens,2009,35(5):232-7.
[9]Zoukhri D.Effect of inflammation on lacrimal gland function[J].Exp Eye Res,2006,82(5):885-98.
[10]张梅,陈家祺,刘祖国.干眼症的眼表改变及发病机制的研究进展[J].中国眼耳鼻喉科杂志,2002,2(4):252-255.
[11]Murat Dogru,Kazuo Tsubota.Pharmacotherapy of dry eye[J].Expert Opin Pharmacother,2011,12(3):325-334.
[12]Fabiana de Pinho Tavares,Raphael Stehling Fernandes,Taliana Freitas Bernardes,et al.Dry Eye Disease[J].Seminars in Ophthalmology,2010,25(3):84-93.
[13]刘盛春,吴晓梅.减少瞬目频率建立的蒸发过强型兔干眼模型[J].国际眼科杂志,2009,9(7):1265-1268.
[14]Jumblatt MM,McKenzie RW,Jumblatt JE.MUC5AC Mucin Is a Component of the Human Precorneal Tear Film[J].Invest Ophthalmol Vis Sci,1999:40(1):43-49.
[15]江苏新医学院.中药大词典·上册[M].上海:上海人民出版社,1997:1354.
[16]李桥,施炜,王育良,等.鬼针草治疗局部滴用阿托品的兔干眼疗效评价[J].江苏中医药,2009,21(5):74-75.
