污水深度回用反渗透膜面微生物污染机理试验研究
2013-11-20于海琴孙慧德杨成永周煜坤
于海琴,孙慧德,陈 蕊,杨成永,周煜坤
(1.北京交通大学 土木建筑工程学院,北京 100044;2.上海安昆水处理设备有限公司,上海 200060)
污水深度回用膜集成工程中反渗透膜污染始终是制约膜分离技术发展的瓶颈[1-2],是反渗透技术应用过程中关注的重点[3-4]。反渗透膜污染的类型主要有生物污染、有机污染、无机污染及颗粒杂质污染[5],而微生物污染是众所周知的最难预防和消除的污染[6]。由于预处理不能完全去除细菌,加上水中有机物成为微生物生长的碳源,所以反渗透膜上微生物污染普遍存在[7],Vrouwenvelder等[8]通过对中东地区海水淡化厂的反渗透设备调研,发现其中70%遭受微生物污染,所以认为微生物污染是NF、RO应用过程中最严重的问题之一。由于污水含氮、磷等富营养物质多,TOC、COD、BOD值较高,水温较高等[9],所以污水回用RO膜微生物污染相对发生的几率更高些。一旦出现生物污染,反渗透会马上出现渗透通量下降的表现[10-11],生物污染对通量降低的影响比非生物污染大,所以微生物污染问题日渐突出[12-14]。污染最直接的影响是导致运行成本增加、寿命降低、膜清洗和更换频繁[15]。有证据表明微生物污染对膜性能的影响是其污染影响的数倍[16],生物膜的存在会加重其它污染的发生,称之为生物膜强化污染(Biofilm-enhanced),主要是由于生物污垢造成压差升高,在膜表面形成低流速状态,在生物及其分泌物的黏附作用下进一步加剧了胶体、有机污染、无机结垢和微生物的污染[13]。
膜面微生物污染的复杂性主要表现在它的存在性、生长性、环境适宜性和与膜面的黏附性、难于彻底去除性上。预处理不能完全消除微生物,加氯消毒的反渗透工厂也发现有微生物污染问题[17]。脱氯后微生物存在再生问题,Mohamed等[18]研究发现,反渗透系统在经过SBS脱氯后出现大量微生物再生,使得微生物污染加重。
本文通过对反渗透膜微生物污染的试验研究,期望能够很好地掌握污染的机理与特性,同时能够帮助我们更好地解决膜微生物污染问题,对膜的清洗也有重要的指导作用。
1 微生物污染试验方法
微生物污染是膜材料、流动参数(如溶解物、流动速度、压力等)和微生物间复杂的相互作用的结果。试验研究内容主要考察中水水质对微生物污染和生物膜形成的影响,考察主要的微生物种类和生长状态,通过杀菌处理考察杀菌预处理对反渗透入口水微生物存在和生长的影响。试验研究以静态试验和错流过滤动态试验相结合的方式进行。
试验材料和药品:除盐水、牛肉膏、蛋白胨、氯化钠、琼脂、中水、反渗透膜(洁净和已污染的2种)。
静态试验装置:试验采用静态膜污染模拟器进行污染研究,如图1所示。

图1 静态试验装置(MFS)
膜片处理:将大片(张)膜用除盐水润湿透水侧,轻轻地平整固定在玻璃板上,使用特制的裁剪装置(一端软固定、一端锋利刀片)将膜裁剪成需要的尺寸,切忌刮伤膜片或重压膜片。将裁剪好的膜片在灭菌的除盐水中浸泡24h,其间换水3次。静态试验的膜片需要事先固定在支撑的圆环上,再进行灭菌处理。
试验菌液(中水中微生物菌种)培养和配制:取中水放于事先经过灭菌处理的洁净烧杯中;取2个已经杀菌的培养皿,利用移液管从烧杯中分别取1mL中水置于培养皿中。用洁净烧杯称取牛肉膏0.5g,蛋白胨1g,氯化钠0.5g,琼脂2g,加除盐水溶于100mL锥形瓶中,搅拌并调节pH至7.2~7.4,塞紧瓶口,放于灭菌锅中灭菌,4h后,取出锥形瓶冷却至50℃左右,倒入培养皿,以刚好覆盖培养皿底部为宜;盖好培养皿,置于37℃恒温箱中培养24h;24h后,取出培养皿,用玻璃棒挑出菌落置于装有除盐水的烧杯中,搅拌待用。
2 试验内容及结果分析
2.1 反渗透产品水(即除盐水)中微生物生长性研究
取6个500mL的事先灭菌处理的洁净烧杯,分别加入200mL的除盐水;在1、2、3号烧杯中分别加入1mL配置的菌液;将6个烧杯上口盖紧,置于室温下静置,5h后分别取1mL水样培养,观察培养皿表面菌落生长情况;同时另取一个培养皿(7号),取1mL原菌液模拟中水条件,进行对比培养。试验结果见表1。

表1 除盐水中微生物生长性
试验观察到1、2、3号培养皿中只有少数的菌落,而4、5、6号基本上没有菌落。在7号培养皿中长出了很多菌落。
实验结果表明:在除盐水中,由于没有微生物生长和繁殖的必须营养物质,所以膜面污染情况较轻,培养皿中的菌落数很少。反渗透出水本身几乎没有细菌,而且除盐水中缺乏细菌生长所必需的营养物质,即使在除盐水中加入菌液,也无法快速繁殖,甚至会因为缺乏营养而失活。在相同培养时间和温度条件下,中水中菌落数要比除盐水条件下培养生成的菌落多得多。说明反渗透出水侧或出水侧膜面通常没有微生物存在,但是有细菌介入的情况下,即有微生物源时会造成生长,尤其是水样中如果有足够的营养物质,就会在膜表面快速形成微生物粘泥,影响膜的正常运行。
2.2 水温对微生物生长的影响
分别取6个事先灭菌处理的洁净500mL烧杯,分别加入200mL除盐水和1mL培养菌液;在1、3、5号烧杯中分别放入2片干净的反渗透膜片,在2、4、6号烧杯中分别放入2片污染的膜片;盖好杯口;将1、2号烧杯放入冷水浴中,维持温度在15℃左右,3、4号烧杯置于室温下,5、6号烧杯热水浴,维持温度30℃左右;隔0.5h测各个烧杯的水温;5h后,取出膜片,分别置于6个事先灭菌处理的干净烧杯中,用清洗剂清洗膜;分别从每个烧杯中取出1mL清洗液,用培养皿培养,观察菌落数的多少,1~6号烧杯中取出的清洗液中,培养菌落数分别为1、3、3、5、7、12个。试验温度见表2。
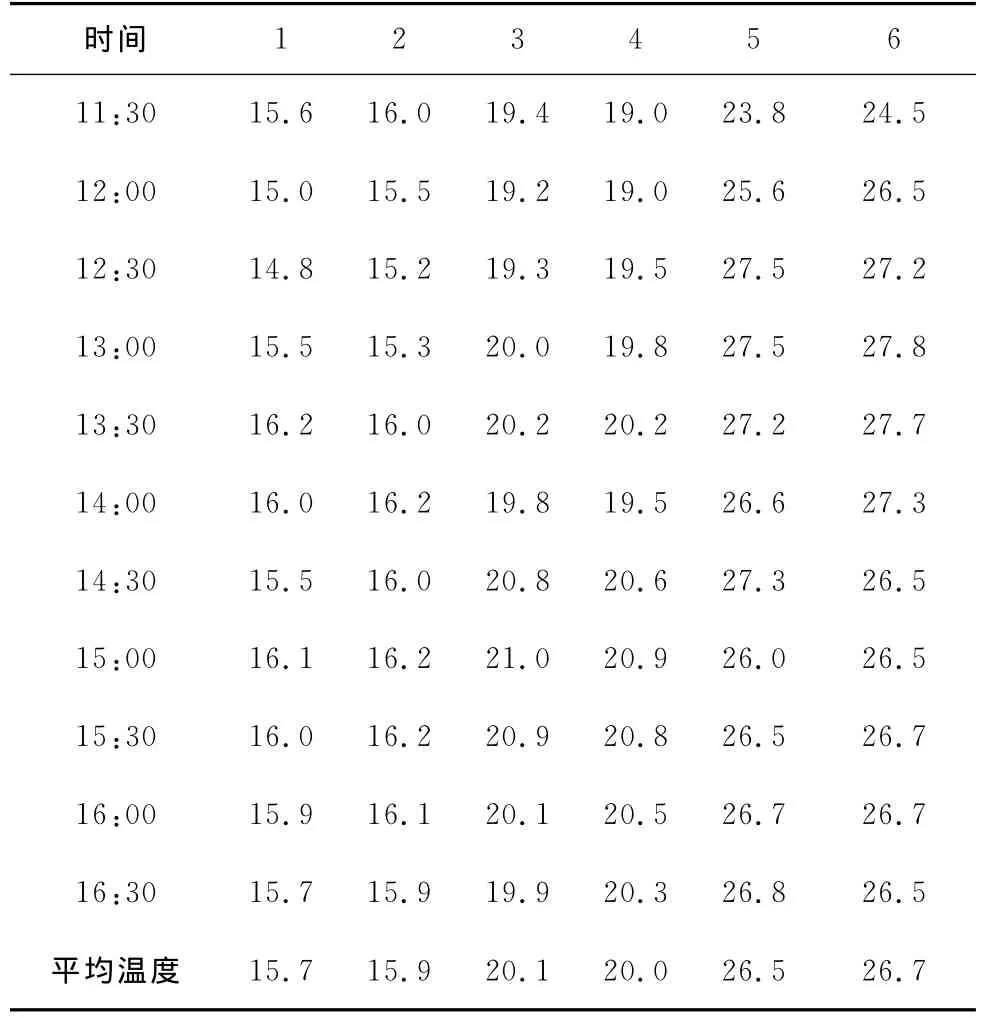
表2 温度对膜面微生物生长的影响
根据不同温度下微生物培养的表现可以看出,微生物在温度较高的情况下更易于在膜面繁殖、生存。除盐水中总体上膜面微生物生长或污染情况比较轻,但是同样在除盐水中,已经污染的膜片微生物的生长现象和污染比清洁膜严重。
2.3 反渗透在中水环境中膜面微生物生长性能静态污染试验
静态模拟试验装置MFS中以中水为试验介质,放入膜片,利用磁力搅拌器模拟膜面流动状态,控制搅拌速度和时间,观察膜表面的微生物污染情况。经过一定时间取出膜片,通过培养来观察污染的微生物的特性。试验前将烧杯和搅拌磁子做灭菌处理。在500mL烧杯中分别加入同体积除盐水、中水,放入经过前处理的反渗透膜片(功能皮层朝下,直径50mm),控制搅拌器转速,加热棒控制水样的温度,观察在不同条件下膜面的污染情况。
以高温灭菌冷却后的除盐水淋洗取出的膜片,去除浮在上面的杂质,将膜片放在另外一套经过灭菌处理的MFS装置中,烧杯内加入200mL高温灭菌的除盐水,启动搅拌器(1500r/min)进行膜面微生物污染洗脱处理,取适量洗脱液进行微生物菌落培养,并将洗脱液放在显微镜下观察微生物的形态。
2.3.1 微生物污染出现时间试验 分别取6个洁净的500mL烧杯,编号后,分别加入200mL除盐水和1mL培养菌液,静置30min;同时向6个烧杯中加入2片洁净RO膜片,开始计时,以65r/min转速搅拌,分别在10、15、20、25、30、40min后,取出膜片,用清洗液清洗,再取其中的1mL清洗液进行微生物培养;观察6个培养皿中的微生物生长情况。试验结果见表3。

表3 不同时间微生物生长状态(水温:26.8℃,洁净膜片)
试验结果分析:从表中可以看出,膜表面在膜浸入水样中15min后就开始出现微生物附着的现象,而之前基本上没有微生物污染出现。30min后,膜污染现象加重,膜表面微生物量增多。说明随着时间的延长,膜表面微生物繁殖越来越多,膜表面污染也就越来越严重,严重时可以堵塞膜孔,阻碍过水,使得系统产水量下降。
2.3.2 水流速度对微生物污染的影响试验 主要研究在不同的水流速度下,膜表面微生物的污染情况。膜面错流流速通过改变搅拌器转速来进行模拟研究,转速选择0、65、125r/min。
取6个洁净的500mL烧杯,分别加入200mL除盐水和1mL培养菌液,静置30min;同时向1、2、3号烧杯中分别加入2片洁净反渗透膜片,向4、5、6号烧杯中加入已经污染的膜片。将烧杯分别放在磁力搅拌器下,1、4号烧杯以0r/min的转速搅拌,2、5号烧杯以65r/min的转速搅拌,3、6号烧杯以125r/min的转速搅拌;60min后,同时取出膜片,用清洗液清洗并进行微生物培养。试验结果见表4。
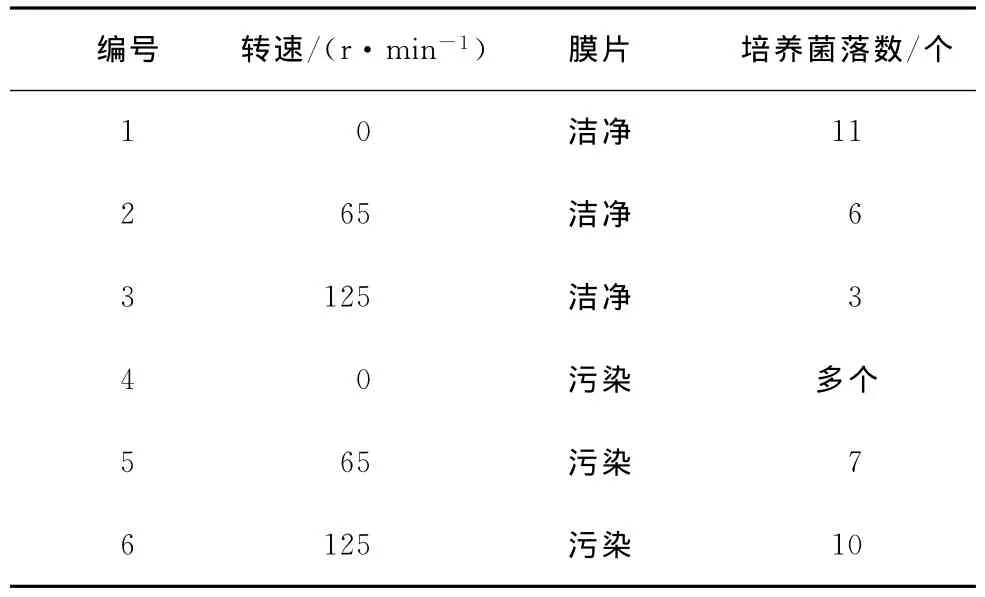
表4 搅拌速度对膜面微生物生长的影响(温度:21.2℃)
实验现象及结果:污染膜片比洁净膜片污染严重,说明污染膜片再污染情况严重;在水样流动的情况下,不易产生微生物污染。一定的水流速度在膜表面形成了一定的剪切力,使得微生物等很难附着在膜表面。即使附着在膜表面,在生长初期会在受到流速作用下被水流的剪切力冲走。
试验结果及分析说明反渗透在停用期间微生物污染的可能性大。
2.4 中水水质对微生物污染的影响——强化生物污染试验
水中微生物营养成分的存在是微生物污染发生的基本条件,Vrouwenvelder等[19]对此进行了长期的研究,在2000年报道很低含量的营养成分(μg/L)就可引起微生物污染,2001年的研究表明较低的可生物降解有机物的存在可造成微生物污染[20],2010年研究磷酸盐的影响,结果表明,在RO进水磷酸盐含量较低的情况下,反渗透膜的微生物污染受到明显控制[21]。
试验以从中水分离的微生物经过培养后的水进行高菌水配置,以高菌水对反渗透膜进行强化生物污染试验,考察污染性质及对膜过滤性能的影响。
中水本身含有较多的有机物的代谢产物,低分子量或溶解态的有机物,试验模拟研究浓差极化现象下膜面污染成分含量增加的情况下微生物生长的特性。以腐殖酸为有机物浓度的目标污染物,通过配水进行试验研究。在考虑膜面胶体杂质在浓差极化层内积聚的信息,以硅藻土做胶体杂质的目标污染物,同时进行配水。用0.001g/L硅藻土来模拟1个浊度,即1NTU=0.001g/L硅藻土。
由于浓差极化层内流动状态与主体流动状态不同,所以采用不加搅拌的方式进行污染试验研究。在前阶段试验的基础上,维持相同的温度,流速和时间,考察在不同浓度的有机物和胶体存在时膜表面微生物污染的情况。
分别取9个洁净的500mL烧杯,根据表5进行水样配置(200mL),同时加入1mL培养菌液,静置30min;在0、1、2、3、4号烧杯中分别放入2片干净的反渗透膜片,在1′、2′、3′、4′号烧杯中分别放入2片已污染的膜片;同时加入1mL培养菌液,置于试验装置中,以65r/min搅拌1h;1h后,取出膜片,分别置于干净烧杯中,用清洗剂清洗并进行微生物培养。试验结果见表6。

表5 强化污染配水
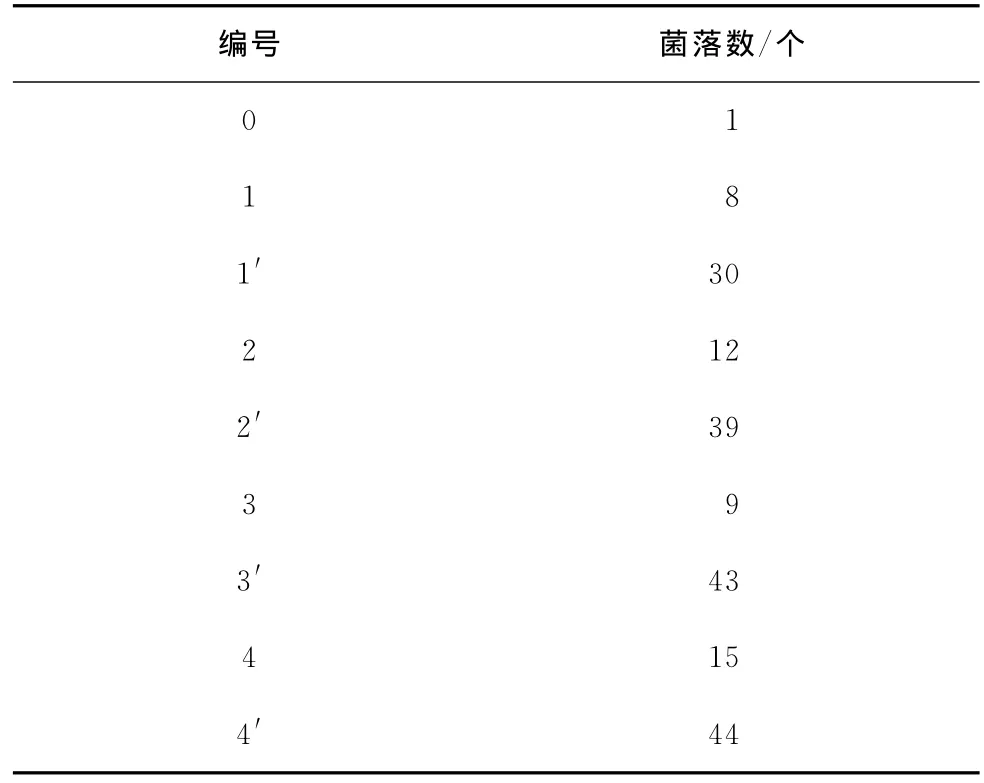
表6 强化污染试验结果(温度:27℃)
试验数据表明:胶体和有机物浓度越高,膜表面的微生物越多,即污染越严重。
2.5 杀菌处理对微生物污染的影响
取中水加入培养菌形成生物污染环境,用甲醛杀菌后,再放入反渗透膜片,试验研究膜表面的污染情况。主要步骤如下:分别取9个洁净的500mL烧杯,编号后,分别加入中水已经配好的水样(NTU=5,腐殖酸=10mg/L);同时加入1mL培养菌液,静置30min,30min后在1~8号烧杯中分别加入5mL 1%的甲醛溶液,杀菌5min后,分别放入干净的反渗透膜片;放置在试验装置上,以65r/min搅拌;在不同时间分别取出膜片,置于干净烧杯中,用清洗剂清洗并进行微生物培养。试验结果见表7。
试验现象及结果:水样加入菌液后,静置30min,水中微生物已经繁殖,数量增加,增加速度很快。用1%的甲醛溶液杀菌后,在一段时间内,膜上微生物量很少,污染较轻。但是经过一段时间后,杀菌水样中的微生物数量开始急剧上升,膜污染现象依然存在。

表7 杀菌处理对反渗透膜微生物污染的影响(25℃,65r/min)
2.6 膜面微生物污染的微生物种类
将各次试验洗脱液放在显微镜下进行观察,以研究中水微生物污染的生物形态,显微镜照片如图2~5所示。
2.6.1 没有杀菌处理 没有进行杀菌处理的膜面清洗水样中微生物种类如图2所示。
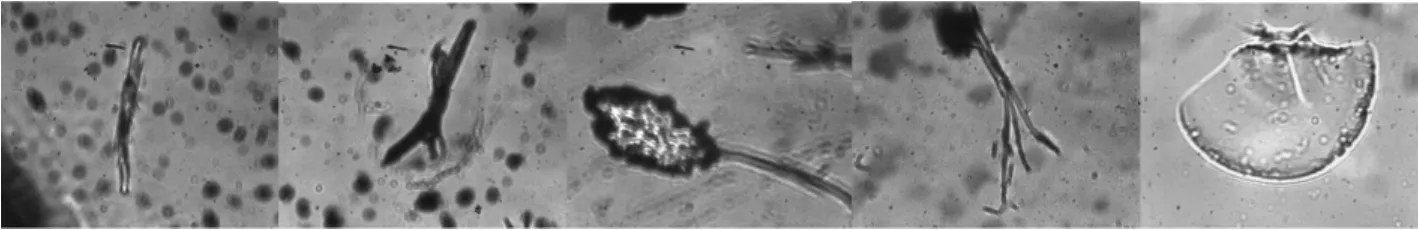
图2 膜面污染的微生物种类(没有杀菌处理)
2.6.2 腐殖酸配水中污染膜面的微生物种类 如图3所示。

图3 膜面污染的微生物种类(腐殖酸配水)
2.6.3 强化污染试验中微生物种类 强化污染试验中微生物种类如图4所示。

图4 膜面污染的微生物种类(强化污染试验)
2.6.4 杀菌处理后膜面洗脱液微生物种类 如图5所示。

图5 膜面污染的微生物种类(杀菌处理)
试验结果分析:根据微生物显微镜照片的形态特征发现,膜污染的微生物多以杆菌和丝状菌为主,其中杆菌多为大肠杆菌。大肠杆菌(Escherichia coli,E.coli)为革兰氏阴性短杆菌,大肠杆菌是人和许多动物肠道中最主要且数量最多的一种细菌,主要寄生在大肠内,与城市污水水质符合。说明在现有中水水质回用标准下,中水中微生物存在,并且在回用系统中会增殖,造成反渗透膜发生微生物污染。
2.7 超滤对微生物的去除性能
在膜集成技术中,反渗透的前一级预处理为超滤,超滤对进水微生物的去除效果直接影响反渗透膜面是否发生严重的微生物污染,所以研究超滤对微生物的去除效果成为反渗透的安全保障。
通常工业应用的超滤膜组件的切割分子量在100kDa左右,由表8可以看出,UF膜组件切割分子量(MWCO)为10万Da时,对应的绝对膜孔径约为0.01μm,而细菌、大肠杆菌和藻类等微生物的物理尺寸一般约0.02μm以上(如图6所示),所以从理论上UF过程对微生物的截留率能够达到100%。

表8 切割分子量和孔径尺寸的对换关系
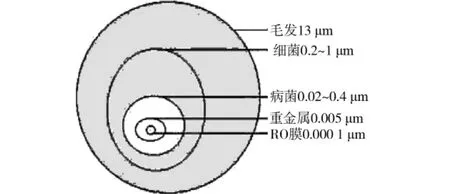
图6 膜孔大小与水中杂质的比较
通过实验室错流试验装置以不同切割分子量的超滤膜片进行中水错流过滤试验,在所取的中水中添加分离培养的高菌水,以高浓度细菌含量的配水进行超滤试验,对超滤进水和产水进行微生物指标分析,通过进出水细菌总数的变化来考察超滤的除菌效果。这个试验可以看作是实际工程在超滤之前杀菌处理异常的情况下的不利影响试验。试验结果见表9。
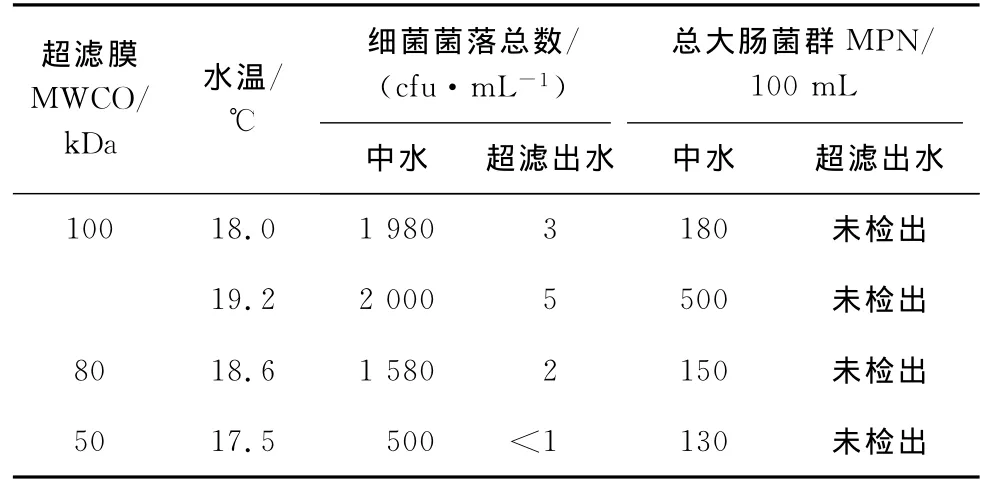
表9 超滤膜对微生物去除效率
在超滤没有进行杀菌处理的情况下,以高菌水进行试验,效果很好;超滤膜组件对细菌和大肠杆菌的截留试验结果表明,滤过水中细菌含量在5cfu/mL以下,能够完全截留原水中微生物,UF膜去除细菌的效果非常好。UF膜组件对细菌和大肠杆菌的截留率达到99.99%以上,而且滤过水的细菌指标基本不受原水细菌总数变化的影响,截留效率稳定。
通常实际中水回用工程中超滤之前需要进行杀菌处理,由于向原水中投加次氯酸钠氧化灭菌,并维持水中适当的余氯含量,能够持续抑制细菌繁殖,这样对反渗透的安全保障性和超滤膜面微生物污染的防止均起到作用,超滤出水微生物学指标完全满足RO系统进水要求。虽然超滤膜对细菌、微生物有很高的去除率,但仍达不到100%,在超滤产水中仍可以检测到微量细菌,在温度适宜条件下,几天之内便可在反渗透膜表面形成生物膜层。所以预处理系统的维护工作很重要。
3 结 论
1)超滤膜组件滤过水中细菌含量在5cfu/mL以下,UF膜去除细菌的效果非常好,能够完全截留原水中微生物。经过超滤处理的水,在SDI合格的情况下,并不能保证反渗透膜面避免微生物污染,甚至SDI<3的情况下,仍然可能在膜表面出现大量粘泥状生物膜,生物污染取决于水中细菌的存在性、繁殖状况和水中杂质、温度等条件。
2)微生物污染发展迅速,一旦膜上出现细菌群落,特别是在出现浓差极化的情况下,在短时间内,就会生成粘泥膜。水中有机物和胶体杂质成为微生物污染的促进因素。
3)中水深度回用污染的反渗透膜面上生物膜内的微生物以杆菌和丝状菌为主。
4)除盐水中,在没有微生物源和没有微生物生长和繁殖的必须营养物质的情况下,膜面基本不发生污染。
5)中水若在进入反渗透系统前不进行灭菌处理,微生物将以反渗透膜为载体借助反渗透浓水段的营养盐而繁殖生长,在水温适宜的条件下,微生物的生长更是迅速。
6)反渗透在停用期间微生物污染的可能性大,并且在已经污染的膜片表面微生物生长加重污染,实际设备通常为污染膜,一旦微生物附着在膜面,在微生物本身分泌、代谢产物的作用下是不易脱落的,微生物本身极强的环境适应性加重污染。
关于反渗透膜面微生物污染的研究还很不够,常规的含盐量、TOC、COD、pH、电导率等水质分析,并未给出生物污染隐患的线索。尚未建立SDI数据与生物污染之间的关系,微生物活性物质和有机物存在的复合污染有待深入研究。
目前常规RO生物监控的方案是采用一系列显微和培养技术,用培养法来检测水中的微生物含量,但这远远不能反映实际微生物的动态污染趋势和性质,所以研究动态监控手段也是今后研究的要点。
[1]Bes-piá A,Cuartas-uribe B,Mendoza-roca J A,et al.Study of the behavior of different NF membranes for the reclamation of a secondary textile effluent in rinsing processes[J].Journal of Hazardous Materials,2010,178:341-348.
[2]Malaeb L,George M A.Reverse osmosis technology for water treatment:state of the art review [J].Desalination,2011,267:1-8.
[3]Mosqueda-jimenez D B,Peter M H.Effect of biofiltration as pretreatment on the fouling of nanofiltration membranes [J].Desalination,2009,245:60-72.
[4]霰景刚.反渗透膜污染原因分析及清洗试验[J].东北电力技术,2006,(6):8-11.Xian J G.Analysis and processing of reverse osmosis membrane[J].Northeast Electric Power Technology,2006,6:8-11.
[5]Ivnitskya H,Katza I,Minzc D,et al.Characterization of membrane biofouling in nanofiltration processes of wastewater treatment[J].Desalination,2005,185:255-268.
[6]Miller D J,Araújo P A,Correia P B,et al.Short-term adhesion and long-term biofouling testing of polydopamine and poly (ethylene glycol)surface modifications of membranes and feed spacers for biofouling control[J].Water Research,2012,46:3737-3753.
[7]Peldszus S,HalléC,Peiris R H,et al.Reversible and irreversible low-pressure membrane foulants in drinking water treatment:Identification by principal component analysis of fluorescence EEM and mitigation by biofiltration pretreatment[J].Water Research,2011,45(16):5161-5170.
[8]Vrouwenvelder J S,van Loosdrecht M C M,Kruithof JC.A novelscenario for biofouling control of spiral wound membrane systems[J].Water Research,2011,45:3890-3898.
[9]Zhao Y,Song L F,Ong S L.Fouling of RO membranes by effluent organic matter(EfOM):Relating major components of EfOM to their characteristic fouling behaviors[J].Journal of Membrane Science,2010,349:75-82.
[10]Costerton W J,Lewandowski Z,Caldwell D E,et al.Microbial biofilms[J].Annual Review of Microbiology,2009,49:711-745.
[11]Ridgway H F,Flemming H C.Membrane biofouling in water treatment membrane processes in water treatment membrane processes [M].New York:McGraw-Hill,1996.
[12]Xu P,Bellona C,Drewes J E.Fouling of nano?ltration and reverse osmosis membranes during municipal wastewater reclamation:Membrane autopsy results from pilot-scale investigations[J].Journal of Membrane Science,2010,353:111-121.
[13]Huertas E,Herzberg M,Oron G,et al.Influence of biofouling on boron removal by nanofiltration and reverse osmosis membranes [J].Journal of Membrane Science,2008,318:264-270.
[14]Kim A S,Chen H Q,Yuan R.EPS biofouling in membrane filtration:An analytic modeling study[J].Journal of Colloid and Interface Science,2006,303:243-249.
[15]Vrouwenvelder J S,Manolarakis S A,van der Hoek J P,et al.Quantitative biofouling diagnosisin fullscale nanofiltration and reverse osmosis installations [J].Water Research,2008,42(19):4856-4868.
[16]Patching J W,Flemming G T A.Biofilms in medicine,industry and environmental biotechnology:characteristics,analysis and control[M].IWA Publishing,2003.
[17]Mohamed O S.Effect of dechlorination point location and residual chlorine on biofouling in a seawater reverse osmosis plant[J].Desalination,2002,143:229-235
[18]Mohamed O S,Jamaluddin A T,Tisan I A,et al.Biofouling in a seawater reverse osmosis plant on the Red Sea coast,saudi arabia [J].Desalination,2000,128:177-190.
[19]Vrouwenvelder J S,Manolarakis S A,Veenendaal H R,et al.Biofouling potential of chemicals used for scale control in RO and NF membranes [J].Desalination,2000,132:1-10.
[20]Vrouwenvelder J S,van der Kooij D.Diagnosis,prediction and prevention of biofouling of NF and RO membranes[J].Desalination,2001,139:65-71.
[21]Vrouwenvelder J S,Beyer F,Dahmani K.Phosphate limitation to control biofouling [J].Water Research,2010,44:3454-3466.
