主动脉壁内血肿的CT诊断
2013-11-13王嗣伟李若梅李萍珍费维嵩
李 群,王嗣伟,李若梅,李萍珍,费维嵩
(安徽省合肥市第二人民医院,安徽 合肥 230011)
主动脉壁内血肿(aortic intramural hematoma,IMH),亦称不典型主动脉夹层,因无明显内膜撕裂,与主动脉真腔无明显交通而得名,约占主动脉夹层的10.0%~12.8%[1]。IMH 发病率不高,但其临床症状、体征及危险程度与典型主动脉夹层相似,因此,早期诊断、及时治疗对其预后有着重要意义。MSCT对IMH的诊断及指导治疗有重要价值[2-3]。现回顾性分析我院2008~2011年4例IMH的影像资料,以进一步提高对其认识。
1 资料与方法
1.1 一般资料 本组4例中男2例,女2例;年龄50~71岁,平均59.2岁。3例发病前有突发胸痛,并向后背部放射;且胸部疼痛较为剧烈,伴有不同程度胸闷不适。1例以上腹部疼痛为主,并向后背部放射。4例均有高血压病史。IMH的诊断标准为主动脉壁呈“新月形”或“同心圆形”增厚,且增厚的血管壁≥5mm,增强扫描后其血管壁无强化,无明确的内膜片显示。参照主动脉夹层Stanford分型,升主动脉受累为A型;升主动脉不受累为B型。
1.2 仪器与方法 4例均行CT平扫及增强扫描。使用飞利浦 MX-8000D双排螺旋CT机,扫描范围上端包括胸廓入口,下端根据需要,最低包括盆腔,其中1例,增强扫描先扫腹部,再扫胸部。扫描参数:层厚6.5mm,层距5mm,螺距1,管电压120kV,管电流220~300mA,准直宽度为1.5mm。对比剂为非离子型对比剂碘海醇100ml,采用高压注射器经肘静脉团注,剂量1.5~2ml/kg体质量,流率为3~4ml/s,注射对比剂后延时20~25s行动脉期扫描,4例在动脉期扫描结束后30~35s加扫静脉期。
2 结果
4例均为B型,其中仅累及胸主动脉2例,累及至肾动脉上方2例。CT表现为主动脉壁新月形增厚3例,环形增厚1例,厚度为5.2~12.3mm,平扫呈略高或等密度,增强扫描后未见强化,内壁光滑,未见内膜撕裂形成双腔(见图1,2),内膜钙化伴有钙化内移1例(见图3)。1例主动脉粥样硬化伴壁内溃疡,增强扫描可见主动脉壁间有斑点状对比剂影(见图4)。2例合并胸腔积液,未见心包积液。
3 讨论
3.1 IMH的形成机制 IMH的形成机制较为复杂,目前认为可能有以下3种原因[4-5]:①主动脉营养血管或中膜滋养血管破裂在主动脉壁形成血肿,该血肿没有内膜破裂。②动脉硬化粥样斑块破裂,血液渗入主动脉壁中层,形成壁内血肿,该类血肿常发生在高龄、高血压患者,本组患者均为高龄、高血压患者,但仅1例伴动脉硬化,与文献[6]报道不符,可能与样本量小有关。以上2种观点已被手术及病理证实。③近年来,由微小内膜撕裂导致的IMH引起人们的重视,Park等[7]通过对37例A型IMH术后发现73%的患者有内膜小撕裂,但目前影像学还无法显示。
3.2 IMH的CT表现 IMH的CT表现包括直接征象、间接征象及并发征象。主动脉壁呈“新月形”或环形增厚≥5mm是最典型、直接的征象,通常血肿平扫为略高密度,亦可为等、低或混杂密度,增强扫描后,血肿不强化,亦未见撕裂内膜片[8]。本组主动脉壁环形增厚1例,新月形增厚3例,平扫3例为略高密度,1例为等密度;增强扫描后均未见强化,亦未见撕裂内膜片。间接征象为:①内膜钙化斑块内移,目前,增强扫描在国内许多医院还不作为急诊常规扫描,钙化内移是平扫判断是否有主动脉夹层或IMH最有价值的征象。本组1例见钙化内移后行CT增强扫描确诊。②主动脉粥样斑块穿透性溃疡,病变区血管断面溃疡部向腔外突出,呈“龛影样”改变。③动脉粥样硬化性改变,内膜渗漏,即增强扫描时显示为血肿内邻近真腔的细线样或点片状不规则强化区。本组1例。并发征象:心包积液、胸腔积液、主动脉夹层、主动脉瘤等。本组2例见胸腔积液,未见其他并发征象。上述征象再结合临床急性胸背痛病史,即可明确诊断为IMH。
3.3 IMH需与以下疾病进行鉴别 ①典型主动脉夹层,平扫时IMH与典型主动脉夹层很难鉴别;增强扫描时IMH不强化,无双腔及内膜分隔,与典型主动脉夹层很容易区别,但需要与假腔内充满大量血栓的主动脉夹层进行鉴别。由于主动脉夹层真假腔在横断扫描上常呈“D”字形或反“D”字形[9],而IMH管腔常呈圆形或近似圆形,两者在形态学上存在差异,增强扫描有助于鉴别;此外,主动脉夹层多沿主动脉呈“螺旋形”,而IMH大多较均匀环绕主动脉,增强扫描显示形态不同。再者,IMH可自然吸收,特别是B型,而典型主动脉夹层很难吸收,通过随访观察可以区别。②大动脉炎所致的动脉壁增厚,常发生在年轻女性,多血管受累,受累的胸、腹主动脉管壁增厚常呈跳跃性、节段性分布[10-11]。多伴有管腔狭窄或闭塞,且管腔狭窄具有向心性特点[10];而IMH常发生在高龄患者,平扫管壁增厚具有连续性,无跳跃性、节段性分布,无管腔狭窄及闭塞。增强扫描,IMH无强化,活动期大动脉炎管壁强化。③动脉粥样硬化所致管壁增厚,主动脉粥样硬化管壁增厚不规则,且主动脉粥样硬化钙化斑一般不移位,而IMH管壁内缘光滑,钙化内移≥5mm。④附壁血栓,壁内血肿沿主动脉长轴,病变较广泛,管腔多不扩张,管壁多较规则;血栓较局限,常伴血管扩张。此外,中晚期血栓常因机化、纤维化而不规则。
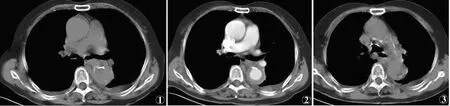
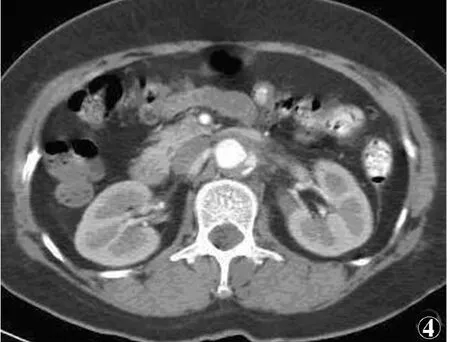
图1~3 同一患者图1 CT平扫示降主动脉环形增厚,血肿为略高密度 图2 增强扫描血肿未见强化,内壁光整,未见移位内膜片,可见主动脉硬化,两侧胸腔积液图3 CT平扫可见降主动脉新月形增厚,并见高密度钙化位于血肿内侧 图4 增强扫描显示腹主动脉壁新月形增厚,在增厚的壁内可见斑片状对比剂渗漏
3.4 IMH的预后 IMH的预后主要与受累主动脉直径、部位及是否伴有穿透性溃疡有关[4-6,12]。主动脉直径大于50mm的死亡率为50%,而小于50mm死亡率为2%。A型IMH的死亡率高于B型。发生于升主动脉且伴有溃疡的IMH容易进展,不伴溃疡的相对稳定,一方面血肿可以吸收,甚至可以消失,预后良好,另一方面血肿可以向主动脉真腔内穿破形成典型的主动脉夹层[13]。
总之,MSCT能够很好地显示IMH的直接、间接及并发征象,为临床医师制定合理的方案提供重要信息,应成为IMH诊断及随访的首选检查方法。
[1]金敬琳,戴汝平,何沙,等.主动脉不典型夹层的电子束CT诊断[J].中华放射学杂志,2001,35(10):740-742.
[2]张德智,马天璇,栾玲,等.主动脉壁内血肿的 MSCT诊断[J].中国医学影像学杂志,2008,16(2):132-134.
[3]黄源义,谢欢,鄔正宏,等.MSCT在主动脉壁内血肿诊断和转归中的应用[J].实用放射学杂志,2011,27(12):1823-1825.
[4]Macura KJ,Corl FM,Fishman EK,et al.Pathogenesis in acute aortic syndromes:aortic dissection,intramural hematoma,and penetrating atherosclerotic aortic ulcer[J].AJR Am J Roentgenol,2003,181:309-316.
[5]Svensson LG,Labib SB,Eisenhauer AC,et al.Intimal tear without hematoma:an important variant of aortic dissection that can elude current imaging techniques[J].Circulation,1999,99:1331-1336.
[6]彭剑峰,黄红梅,夏学文,等.主动脉壁内血肿的CT诊断价值[J].中国临床医学影像杂志,2011,22(5):360-362.
[7]Park KH,Lim C,Choi JH,et al.Prevalence of aortic intimal defect in surgically treated acute type A intramural hematoma[J].Ann Thorac Surg,2008,86:1494-1500.
[8]燕军,鲁强,张光奎,等.16层螺旋CT后处理技术在主动脉壁内血肿诊断中的应用[J].中国CT和 MRI杂志,2008,6(2):68-69.
[9]杨晓辉.主动脉壁内血肿的影像学诊断及鉴别诊断[J].放射学实践,2011,26(3):317-320.
[10]李蓓,史新平,陈文华,等.多层螺旋CT血管成像在多发性大动脉炎诊断中的临床价值[J].中国CT和MRI杂志,2010,8(5):58-60.
[11]余杨红,邓克学,许实成.多发性大动脉炎的多层螺旋CT诊断[J].安徽医科大学学报,2011,46(11):1221-1222.
[12]Ganaha F,Miller DC,Sugimoto K,et al.Prognosis of aortic intramural hematoma with and without penetrating atherosclerotic ulcer:a clinical and radiological analysis[J].Circulation,2002,106:342-348.
[13]张锐,姬尚义,王湘,等.主动脉壁内血肿的外科治疗[J].罕少疾病杂志,2009,16(6):12-14.
