芥菜籽对化学诱导小鼠大肠肿瘤形成过程中体内抗氧化状态的影响*
2013-11-12袁海锋李新艳朱明古
袁海锋 郭 文 李新艳 朱明古
芥菜籽(mustard seed,MS)是十字花科芸苔属植物芥菜的种子,其加工的产品芥末油和芥末粉是日常生活中常用的调味品。芥菜籽能否作为一种化学预防剂应用于大肠癌的预防,目前这方面的研究尚鲜见。本研究以氧化偶氮甲烷(azoxymethane,AOM)诱导的小鼠大肠肿瘤为研究对象,评价芥菜籽对化学诱导大肠肿瘤的预防作用,并观察其对小鼠体内自由基水平和抗氧化酶活性的影响,从自由基反应与肿瘤发生的角度探讨芥菜籽预防大肠癌发生的作用机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂 诱癌剂氧化偶氮甲烷(AOM)购自Sigma公司。超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、过氧化氢酶(catalase,CAT)测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)测定试剂盒及丙二醛(malondialdehyde,MDA)测定试剂盒均购自南京建成生物工程研究所。
1.1.2 实验动物 清洁级昆明品系小鼠购自南方医科大学动物实验中心。芥菜籽(MS)购自广州长合种子有限公司,在动物中心加工制成含5%MS和10%MS的颗粒饲料。昆明种小鼠,4周龄,体质量18~20 g,饲养于南方医院动物实验中心。
1.2 方法
1.2.1 实验分组及处理 60只昆明品系小鼠随机均分为:1)AOM模型组:皮下注射10 mg/kg,1次/周,共3次,标准饲料饮食;2)AOM+5%MS干预组:AOM诱发肿瘤同时给予含5%MS饲料饮食干预;3)AOM+10%MS干预组:AOM诱发肿瘤同时给予含10%MS饲料饮食干预;4)正常对照组:每周给予等量生理盐水皮下注射,标准饲料饮食。
1.2.2 观察指标和取材 实验结束时,摘眼球取血,检测抗氧化酶的活性和脂质过氧化产物的水平。颈椎脱臼处死,解剖小鼠大肠,肉眼仔细观察并记录肿瘤发生的部位、数目和大小,观察其他脏器有无转移病灶发生。肉眼观察后将肿瘤组织放入10%福尔马林溶液中固定。
1.2.3 HE染色 肿瘤组织标本在10%福尔马林溶液中固定24 h,脱水,石蜡包埋,4 μm厚连续切片,HE染色,中性树胶封片。
1.2.4 血清SOD、CAT、GSH-PX活性和MDA含量的检测 采用黄嘌呤氧化酶法检测SOD的活性;采用可见光分光光度法检测CAT的活性;采用化学比色法检测GSH-PX的活性;采用硫代巴比妥酸法检测血清过氧化脂质产物MDA的含量。具体操作严格按照试剂盒说明书。
1.3 统计学方法
采用SPSS 13.0统计软件进行分析。应用卡方检验(Chi-square test)比较各组间小鼠大肠肿瘤发生率的差异,多组间比较采用单因素方差分析(One-way ANOVA),组间多重比较采用SNK方法进行分析,所有分析结果取双侧P值,P<0.05为有显著性差异。
2 结果
2.1 一般状态观察
整个实验过程中,10%MS干预组有3只小鼠意外死亡,发生在实验的24、26、30周,解剖未发现肿瘤和特殊病变。MS干预组小鼠一般状态和营养状况明显好于AOM模型组小鼠。
2.2 肉眼观察
正常对照组小鼠未发现大肠肿瘤,其余各实验组小鼠肠黏膜均有不同程度的增厚、皱襞紊乱,大多向肠腔突出(图1)。其他脏器解剖均未发现肿瘤转移病灶,三组小鼠肿瘤发生率之间的差异有统计学意义(χ2=6.607,P=0.048)。
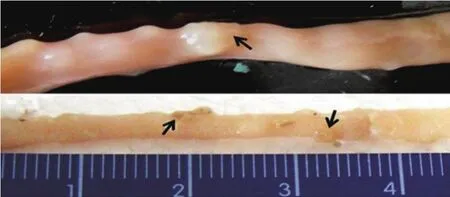
图1 AOM诱导的小鼠大肠肿瘤的大体形态(箭头所示)Figure 1 Morphology of AOM-induced colorectal tumors in mice
2.3 病理组织学检查
AOM模型组小鼠平均肿瘤数与5%MS干预组和10%MS干预组小鼠平均肿瘤数差异有统计学意义(表1)。三组小鼠大肠癌发生率之间的差异有统计学意义(χ2=6.787,P=0.034),以模型小鼠73.3%的发生率为最高,10%MS干预组的25.0%为最低。
2.4 芥菜籽对小鼠血清超氧化物歧化酶(SOD)活力的影响
AOM模型组小鼠血清SOD的活力明显低于正常对照组,有显著性差异(P<0.05);MS干预组小鼠血清SOD的活力与AOM模型组相比均有所提高,有显著性差异(P<0.05);其中10%MS干预组增加小鼠血清SOD活力的作用最明显,与5%MS干预组相比较有显著性差异(P<0.05,表2,图2)。
2.5 芥菜籽对小鼠血清过氧化氢酶(CAT)活力的影响
AOM模型组小鼠血清CAT的活力明显低于正常对照组,有显著性差异(P<0.05);MS干预组小鼠血清CAT的活力与AOM模型组相比均有所提高,有显著性差异(P<0.05);其中10%MS干预组提高小鼠血清CAT活力的效果最好,与5%MS干预组相比有显著性差异(P<0.05,表2,图3)。

表1 芥菜籽对氧化偶氮甲烷(AOM)诱导小鼠大肠肿瘤发生的影响Table 1 Effect of mustard seeds on AOM-induced colorectal cancer in mice
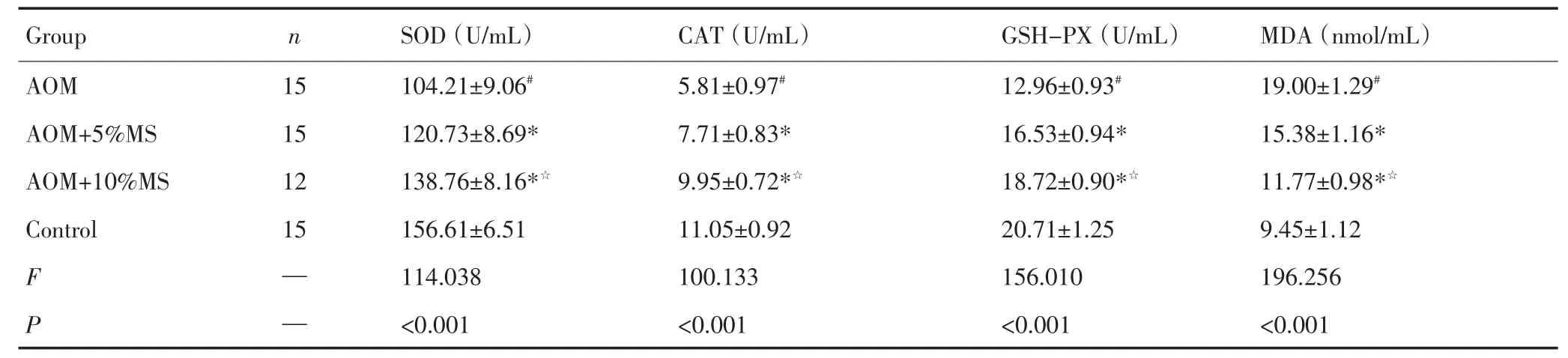
表2 芥菜籽对小鼠血清SOD、CAT、GSH-PX活力和MDA含量的影响Table 2 Effect of mustard seeds on SOD,CAT and GSH-PX activities and MDA content in the serum of mice
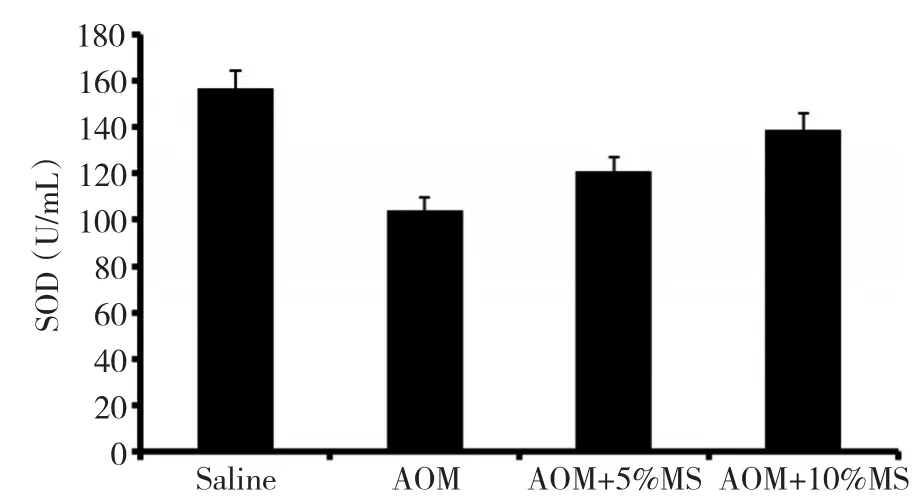
图2 芥菜籽对小鼠血清SOD活力的影响Figure 2 Effect of mustard seeds on SOD activity in mouse serum
2.6 芥菜籽对小鼠血清谷胱甘肽过氧化物酶(GSH-PX)活力的影响
AOM模型组小鼠血清GSH-PX的活力明显低于正常对照组,有显著性差异(P<0.05);MS干预组小鼠血清GSH-PX的活力与AOM模型组相比均有所提高,具有显著性差异(P<0.05);其中10%MS干预组增加小鼠血清GSH-PX活力的作用最明显,与5%MS干预组相比有显著性差异(P<0.05,表2,图4)。
2.7 芥菜籽对小鼠血清丙二醛(MDA)含量的影响
AOM模型组小鼠血清脂质过氧化产物及其降解产物-丙二醛(MDA)的含量明显高于正常对照组,有显著性差异(P<0.05);MS干预组小鼠血清MDA的含量与AOM模型组相比均有所下降,有显著性差异(P<0.05);其中10%MS干预组降低小鼠血清MDA的效果最明显,与5%MS干预组相比有显著性差异(P<0.05,表2,图5)。
3 讨论
近年来有研究发现,芥菜籽及其活性提取物均具有抗癌防癌的活性[1-3]。根据预实验结果,本实验芥菜籽浓度使用5%和10%。AOM诱导小鼠大肠癌的发生与人类大肠癌发生过程中细胞动力学、病理组织学和分子特征方面的变化特点非常相似,是大肠癌常用致癌剂[4-7]。
本实验结束时,AOM模型组小鼠大肠肿瘤发生率为86.7%,与以往文献报道的AOM诱导时间和肿瘤发生率相一致[8]。本研究结果表明,芥菜籽对AOM诱导的小鼠大肠肿瘤具有明显的化学预防作用,肿瘤的发生率降低了一半以上。
肿瘤发生是由于细胞电子平衡失调所致。自由基是一种缺乏电子的物质,进入人体后到处争夺电子,若夺去细胞蛋白分子的电子,使蛋白质接上支链发生烷基化,形成畸变的分子而致癌。该畸变分子由于本身缺少电子,又要去夺取邻近分子的电子,又使邻近分子也发生畸变而致癌。自由基不仅损伤细胞,在致癌和促癌过程中也起重要的作用[9]。自由基能引起细胞膜脂质过氧化,改变蛋白质、酶的活性,损伤线粒体,攻击DNA,诱导基因突变[10]。生物机体主要通过自由基清除酶来防止自由基损伤,目前已知生物体内的抗氧化酶主要包括超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶等,其可分别作用于自由基链锁反应的不同环节,在体内担负着清除自由基的重要任务。
本研究结果表明,在AOM化学致癌过程中,芥菜籽能提高体内抗氧化酶的活性,降低体内脂质过氧化的水平,从而减轻自由基对机体的损伤,预防细胞基因突变和癌变。以维生素E为代表的抗氧化剂缺点是在提高机体抗氧化能力的同时,却降低机体抗氧化酶的表达,因而长期服用这类抗氧化剂,并不能达到我们预计的保护效果。因而,使用一个既可以具有自身抗氧化能力、又具有提高抗氧化酶表达的纯天然保健食品,是目前市场上急需的产品。
本研究证实,芥菜籽不仅可以降低血清中自由基产物MDA,而且可以提高SOD、谷胱甘肽过氧化物酶、过氧化氢酶等主要抗氧化酶的活性,是一个兼顾抗氧化剂和抗氧化酶两个抗氧化系统调节特点、具有抗肿瘤的理想的保健食品。芥菜籽来源于天然植物,在我国产量较大,深入研究其抗癌防癌的作用机制,必将促进芥菜籽进一步的应用。
1 Half E,Arber N.Colon cancer:preventive agents and the present status of chemoprevention[J].Expert Opin Pharmacother,2009,10(2):211-219.
2 Forte A,De Sanctis R,Leonetti G,et al.Dietary chemoprevention of colorectal cancer[J].Ann Ital Chir,2008,79(4):261-267.
3 Ferrucci LM,Daniel CR,Kapur K,et al.Measurement of spices and seasonings in India:opportunities for cancer epidemiology and prevention[J].Asian Pac J Cancer Prev,2010,11(6):1621-1629.
4 Kauntz H,Bousserouel S,Gosse F,et al.Silibinin,a natural flavonoid,modulates the early expression of chemoprevention biomarkers in a preclinicalmodel of colon carcinogenesis[J].Int J Oncol,2012,41(3):849-854.
5 Guan F,Liu AB,Li G,et al.Deleterious effects of high concentrations of(-)-epigallocatechin-3-gallate and atorvastatin in mice with coloninflammation[J].Nutr Cancer,2012,64(6):847-855.
6 Aviello G,Romano B,Borrelli F,et al.Chemopreventive effect of the non-psychotropic phytocannabinoid cannabidiol on experimental colon cancer[J].J Mol Med(Berl),2012,90(8):925-934.
7 Kim JH,Hue JJ,Kang BS,et al.Effects of selenium on colon carcinogenesis induced by azoxymethane and dextran sodium sulfate in mousemodel with high-iron diet[J].Lab Anim Res,2011,27(1):9-18.
8 Rosenberg DW,Giardina C,Tanaka T.Mouse models for the study of colon carcinogenesis[J].Carcinogenesis,2009,30(2):183-196.
9 Santos IS,Ponte BM,Boonme P,et al.Nanoencapsulation of polyphenols for protective effect against colon-rectal cancer[J].Biotechnol Adv,2012[Epub ahead of print].
10 Esfahani A,Ghoreishi Z,Nikanfar A,et al.Influence of chemotherapy on the lipid peroxidation and antioxidant status in patients with acute myeloidleukemia[J].Acta Med Iran,2012,50(7):454-458.
