邻苯二甲酸二乙基己基酯对新生大鼠肺组织发育的影响
2013-11-12应燕芬胡小娅吴海山蔡晓红林振浪陈尚勤
应燕芬,胡小娅,梁 园,林 锦,吴海山,蔡晓红,林振浪,陈尚勤
(1.温州医学院附属第二医院育英儿童医院儿科,浙江温州 325027;2.浙江省台州医院儿科,浙江临海317000;3.Department of Neonatology,4.Department of Pathology,Mount Sinai School of Medicine,New York10029,USA)
邻苯二甲酸二乙基己基酯〔di-(2-ethylhexyl)phthalate,DEHP〕是一种增塑剂,被应用于医疗设备如血袋、静脉营养给药袋、气管插管、鼻饲管和深静脉置管中。研究表明,在成年和幼年动物中DEHP作为一种影响内分泌的环境干扰物,对生殖、肝、肾和肺发育等具有毒性作用[1-2]。基质金属蛋白酶(matrix metalloproteinases,MMP)是降解细胞外基质(extracellular matrix,ECM)的主要介质,与其特异性组织抑制剂即金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase,TIMP)在肺发育过程中共同扮演着重要的角色[3-4]。细胞和ECM的相互作用和ECM的重建对胎肺的发育至关重要,尤其是Ⅳ型胶原为主要成分的基底膜结构变化。MMP-9/TIMP-1主要作用于基底膜的Ⅳ型胶原。MMP-9的过量表达或MMP-9/TIMP-1的表达失衡均可导致肺发育受阻[5-7]。转化生子因子β(transforming growth factor β,TGF-β)是一组功能复杂的多肽生长因子,在肺支气管树分支生成过程和上皮细胞分化过程中起重要作用[8],其异常表达亦影响肺发育。本研究应用DEHP染毒新生大鼠,探讨DEHP对肺发育的影响,并从ECM重建角度探讨其可能的作用机制。
1 材料与方法
1.1 主要试剂和仪器
DEHP和玉米油,Sigma公司;RT-PCR逆转录试剂盒,加拿大Fermentas(MBI)公司;PCR引物,上海英骏生物工程公司合成;SYBR®Premix Ex TaqTMⅡ(Perfect Real Time)定量试剂盒,日本TaKaLa公司;Trizol RNA提取液、山羊抗大鼠MMP-9抗体和兔抗大鼠TGF-β1抗体,美国Santa Cruz公司;兔抗大鼠TIMP-1抗体,武汉博士德公司;辣根过氧化物酶标记山羊抗兔IgG多聚体或辣根过氧化物酶标记兔抗羊IgG多聚体PV试剂盒,美国GBI公司。实时荧光定量PCR仪,罗氏Light-Cycler®480实时荧光定量PCR系统。
1.2 实验动物和分组
SPF级Sprague-Dawley新生大鼠120只购自温州医学院实验动物中心,动物许可证号:SCXK(浙)2005-0019,在SPF级实验室内饲养。随机分为溶剂对照组及DEHP 10,100 和 750 mg·kg-1染毒组。DEHP染毒组于出生后第1天开始分别ip给予DEHP,溶剂对照组ip给予等体积玉米油,每天1次。每组1/2大鼠持续染毒14 d,另一半持续染毒21 d。各组大鼠出生体质量无明显差异,均母乳喂养。
1.3 肺组织标本制备
染毒结束后第2天,ip给予戊巴比妥钠35 mg·kg-1麻醉大鼠,每组随机取5只,固定,打开胸腔,结扎右主支气管,取出肺组织,用4%中性甲醛溶液经支气管给20 cm H2O的气道压力进行灌注固定,然后结扎右主支气管,置于4%中性甲醛溶液固定,48 h后脱水,石蜡包埋,沿肺叶纵轴切片,HE染色,光镜下观察组织病理改变;取鼠左肺组织,分离剪去肺门部大支气管血管,将肺新鲜标本用冷生理盐水漂洗去血迹后,滤纸吸干,用锡箔纸包裹好,1 min内迅速置于液氮中保存,转移至-80℃冰箱储存用于实时PCR检测MMP-9,TIMP-1和TGF-β1mRNA表达水平。
1.4 肺组织HE染色形态学观察和肺间质比例测定
制备肺组织石蜡切片,HE染色,显微镜下形态学观察并照相,使显微镜处于同一放大倍数(100倍)及电压,每张切片随机选择5个视野,测量肺间质比例。首先将切片中的大血管,支气管去除,用数字图像分析技术分割图片,调整照片,找到肺间质和肺泡对比最强烈的像素阈值T,T=100,根据每个图像位点的像素不同,可以分割图片为肺间质、肺泡和其他,每个视野肺间质的像素与总像素的比值表示肺间质比例。
1.5 实时荧光定量 PCR检测肺组织 MMP-9,TIMP-1和TGF-β1mRNA 表达
取100 mg新鲜组织,放到研磨器中,加入液氮充分研磨至粉末,加入1 ml Trizol,提取组织总RNA,紫外分光光度计测量 A260nm/A280nm,计算RNA的纯度和浓度。Primer 5.0软件设计引物,TGF-β1的上游引物为5'CCCCTGGAAAGGGCTCAACAC3',下游引物为 5'TCCAACCCAGGTCCTTCCTAAAGTC3',扩增产物长度为 136 bp;MMP-9的上游引物为5'ACCCCATGTATCACTACCACGAG3',下 游引物 为 5'ATAGTGCTGGCTGTGGGGTGTG3',扩增产物长度为91 bp;TIMP-1的上游引物为5'ATAGTGCTGGCTGTGGGGTGTG3',下游引物为5'TGATCGCTCTGGTAGCCCTTCTC3',扩增产物的长度为130 bp;内参β肌动蛋白的上游引物为5'TCATGAAGTGTGACGTTGACATCCGT3',下游引物为 5'CCTAGAAGCATTTGCGGTGCACGATG3',扩增产物的长度为285 bp。取总RNA 1 μl按逆转录操作说明书逆转录成 cDNA;取2 μl逆转录产物加入20 μl反应体系中,按以下反应条件扩增:95℃预变性30 s→95℃变性10 s→57℃退火10 s→72℃延伸20 s,40个循环,72℃采集荧光信号。用罗氏LightCycler®480实时荧光定量PCR系统进行实时PCR检测。以2-△Ct表示各组目标基因mRNA相对表达水平。△Ct=Ct目标基因-Ctβ肌动蛋白,Ct为扩增过程中荧光信号强度达到阀值的循环数。
1.6 免疫组化方法检测肺组织MMP-9,TIMP-1和TGF-β1蛋白表达
取肺组织标本经4%中性多聚甲醛固定,石蜡包埋,5 μm 连续切片,60℃烤片 2 h,梯度乙醇脱水,3%H2O2灭活内源性过氧化物酶,依次加入一抗(山羊抗大鼠MMP-9抗体、兔抗大鼠TGF-β1和TIMP-1抗体),二抗(辣根过氧化物酶标记羊抗兔IgG多聚体或辣根过氧化物酶标记兔抗羊IgG多聚体),DAB显色,脱水,透明,封片,镜检。以细胞浆中沉着棕黄色颗粒的细胞为阳性细胞。用Imagepro-plus6.0图像分析软件测定10个视野中阳性部位的积分吸光度(integrated absorbance,IA),计算IA平均值以表达待测蛋白的相对表达水平。IA值越大,蛋白表达水平越高。
2 结果
2.1 DEHP对新生大鼠肺发育形态和肺间质比例的影响

Fig.1 Effect of di-(2-ethylhexyl)phthalate(DEHP)given for 14 d(A)and 21 d(B)on lung histopathological changes in newborn rats(HE ×100).The newborn rats were ip given DEHP from the postnatal 1st day,once daily,for 14 or 21 d.The solvent control group(DEHP 0 mg·kg -1)was given equal volume of corn oil.1:solvent control group;2,3 and 4:DEHP 10,100 and 750 mg·kg-1 groups,respectively.
由图1和表1结果看出,DEHP染毒14d,溶剂对照组新生大鼠(图1A1)肺泡形态发育正常,未见炎症反应,未见出血;与溶剂对照组比较,DEHP 10 mg·kg-1组(图1A2)肺间质比例无显著性差异,肺泡未见明显炎症细胞浸润和出血;DEHP 100和750 mg·kg-1组(图 1A3 和 A4)可见肺间质增厚,肺泡隔增厚,间质细胞增多,肺间质比例增大(P<0.05)。DEHP 染毒 21 d ,DEHP 10,100 和750 mg·kg-1组(图1B2~B4)肺间质比例、肺泡大小和肺间质厚度与溶剂对照组(图1B1)相比无明显差异。

Tab.1 Effect of DEHP on lung interstitial tissue proportion of newborn rats
2.2 DEHP染毒对新生大鼠肺组织 MMP-9,TIMP-1和TGF-β1mRNA表达的影响
实时 PCR 结果显示,MMP-9、TIMP-1、TGF-β1和β肌动蛋白扩增产物的溶解曲线均为特异性单峰,扩增曲线呈“S”型,表明所用引物特异性较好。由表2可以看出,DEHP染毒14 d,随着染毒剂量的增加,新生大鼠肺组织MMP-9和TGF-β1mRNA表达增加(r=0.979,P<0.01;r=0.990,P<0.01),TIMP-1 mRNA 表达降低(r=0.904,P<0.01)。DEHP染毒21 d,随着染毒剂量的增加,MMP-9 和 TGF-β1mRNA 表达降低(r=0.878,P<0.01;r=0.935,P<0.01),TIMP-1 mRNA 表达增加(r=0.819,P<0.01)。

Tab.2 Effect of DEHP on expression of matrix metalloproteinase 9(MMP-9),tissue inhibitor of metalloproteinase-1(TIMP-1),and transforming growth factor-β1(TGF-β1)in lung tissue of newborn rats
2.3 DEHP染毒对新生大鼠肺组织 MMP-9,TIMP-1和TGF-β1蛋白表达的影响
由图2看出,新生大鼠肺组织MMP-9,TIMP-1和TGF-β1蛋白免疫组化染色阳性信号均为棕黄色颗粒,定位于胞浆。溶剂对照组肺组织MMP-9,TIMP-1和TGF-β1蛋白在上皮细胞和间质细胞均有表达 (图 2A1,B1,C1);DEHP 10,100 和750 mg·kg-1染毒14 d,MMP-9 和TGF-β1蛋白在肺泡上皮细胞、支气管上皮细胞、血管内皮细胞和肺泡间质细胞表达增加(图2A2~A4,C2~C4),TIMP-1蛋白表达减少(图2B2~B4)。图像分析结果见表3,可见DEHP染毒14 d,新生大鼠肺组织MMP-9和TGF-β1蛋白表达随着DEHP染毒剂量的增加而增加 (r=0.770,P<0.01;r=0.959,P<0.01),TIMP-1蛋白表达随着DEHP染毒剂量的增加而降低 (r=0.795,P<0.01)。
由图3看出,溶剂对照组新生大鼠肺组织MMP-9,TIMP-1和TGF-β1蛋白在上皮细胞和间质细胞均有表达(图3A1,B1,C1),DEHP 10,100 和750 mg·kg-1染毒 21 d,随 DEHP 染毒剂量的增加,MMP-9和TGF-β1蛋白在肺泡上皮细胞、支气管上皮细胞、血管内皮细胞和肺泡间质细胞表达减少(图3A2~A4,C2~C4),TIMP-1蛋白表达增加(图3B2~B4)。图像分析结果可见(表3),MMP-9和TGF-β1蛋白表达随着DEHP染毒剂量的增加而降低(r=0.904,P<0.01;r=0.819,P<0.01),TIMP-1蛋白表达随着DEHP染毒剂量的增加而增加 (r=0.619,P<0.01)。

Fig.2 Effect of DEHP given for 14 d on protein expression of MMP-9(A),TIMP-1(B)and TGF-β1(C)in lung tissue of newborn rats(×200).See Fig.1 for the rat treatment.1 -4:DEHP 0,10,100 and 750 mg·kg-1group.↑:immunostaining positive cells.
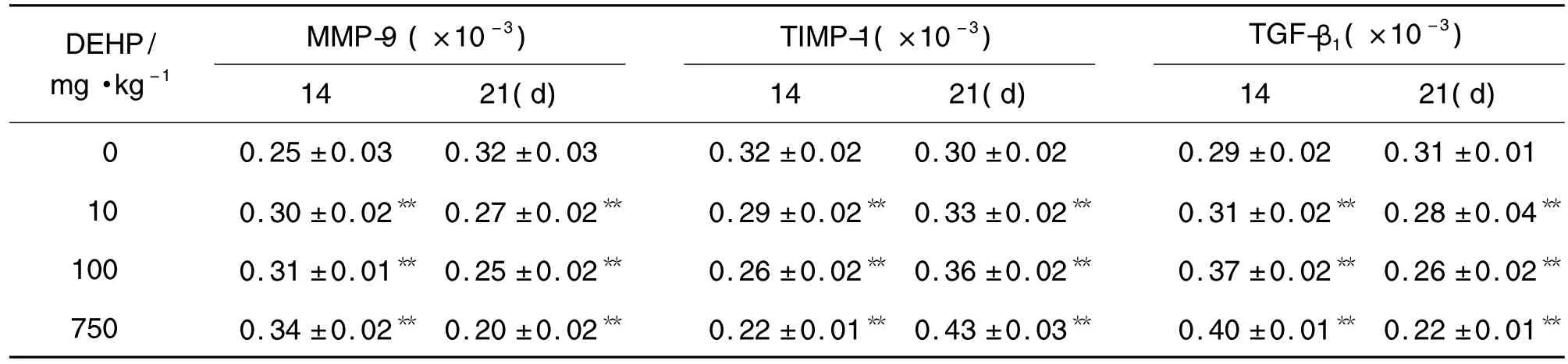
Tab.3 Effect of DEHP on protein expression of MMP-9,TIMP-1 and TGF-β1in lung tissue of newborn rats
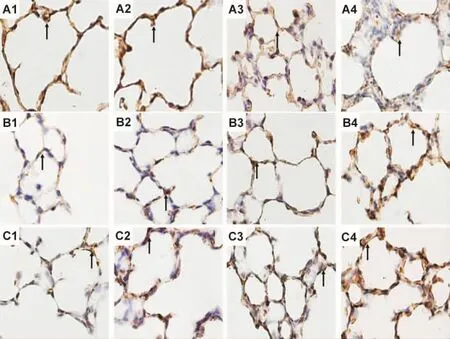
Fig.3 Effect of DEHP given for 21 d on protein expression of MMP-9(A),TIMP-1(B)and TGF-β1(C)in lung tissue of newborn rats(×200).See Fig.1 for the rat treatment.1 -4:DEHP 0,10,100 and 750 mg·kg-1groups.↑:immunostaining positive cells.
3 讨论
环境污染物DEHP在人类生活环境中广泛分布,其污染成为世界范围内威胁人类健康的重大问题。DEHP可通过多种途径进入人体,DEHP及其代谢物对机体生殖系统、肺和呼吸系统等均有毒性作用。目前其肺毒性的作用机制尚不清楚。肺泡发育以肺泡壁的变薄以及次级隔的长出、呼吸膜面积的成倍扩大为特征,此过程有赖于细胞、ECM的相互作用和ECM的重建。在肺血管的成熟中ECM的重建也至关重要。MMP-9能特异性地降解ECM中各型胶原、蛋白聚糖和弹性蛋白等[9]。因此,MMP-9/TIMP-1在肺发育过程中通过对ECM的重构而扮演重要角色[3-4],它们不仅参与胎肺发育早期呼吸道结构的形成和肺分枝形态的发生,而且还参与肺泡化过程中肺泡壁的变薄和胶原蛋白的沉积与更新,同时通过促进肺泡Ⅱ型上皮细胞的迁移以及向肺泡Ⅰ型上皮细胞分化并覆盖新形成的肺泡间隔,扩大呼吸膜内表面积,促进肺组织发育成熟。而在肺泡化后期,则有益于肺泡结构和功能的维持与稳定。TGF-β是一组功能复杂的多肽生长因子,在肺分支的形态生成过程和上皮细胞分化进而合成表面活性物质的成熟过程中起重要作用[8]。大量研究表明,TGF-β1与支气管肺发育不良有着密切的联系。过度表达的TGF-β1可以抑制肺泡Ⅱ型上皮细胞增殖、分化而导致新生鼠肺发育障碍[10-11]。据报道,母大鼠孕期暴露DEHP可导致新生大鼠尿道下裂,阴茎内 TGF-β1的表达增加,且呈剂量依赖性。同时 MMP-9 能激活 TGF-β1,TGF-β1选择性抑制MMP的表达,诱导TIMP的表达[12]。
本研究结果表明,ip给予新生大鼠DEHP染毒,DEHP对新生大鼠肺形态发育具有毒性作用,且与DEHP的染毒剂量呈一定的相关性。同时研究发现,DEHP染毒14 d,新生大鼠肺组织 MMP-9 mRNA和蛋白表达随DEHP染毒剂量增加而增加,DEHP 100和750 mg·kg-1组肺组织出现明显的病理改变,即肺泡数目减少,肺泡体积增大,肺间质增厚,肺泡发育受阻;该结果与本研究集体前期研究报道一致[13]。DEHP 染毒 21 d,新生大鼠肺组织MMP-9 mRNA和蛋白表达随DEHP染毒剂量增加而减少,DEHP 100和750 mg·kg-1组肺组织病理改变减轻,即肺泡间质变薄,肺泡隔变薄,肺间质比例接近溶剂对照组。导致该结果的原因之一可能是随着新生大鼠的发育,各器官功能逐步完善,如肝解毒作用加强;另外,随着大鼠发育其自身修复功能亦增强;原因之二是染毒14 d时新生大鼠间质性肺炎反应较重,染毒21 d时间质性肺炎反应较轻。因此推测,MMP-9过量表达可能是 DEHP肺形态发育毒性的作用机制之一。
TIMP-1是MMP-9特异性抑制剂。本研究结果表明,DEHP染毒14 d,新生大鼠肺组织 TIMP-1 mRNA和蛋白表达随着DEHP染毒剂量的增加而减少;DEHP染毒21 d,肺组织 TIMP-1 mRNA和蛋白表达随着DEHP染毒剂量的增加而增加;这与MMP-9表达的变化趋势相反。由此可见,TIMP-1对MMP-9的表达有调控作用,这与文献报道一致[14]。据报道,MMP-9/TIMP-1平衡关系的破坏势必影响肺组织正常发育,从而发生病理形态变化[15]。由此提示,MMP-9/TIMP-1失衡可能是DEHP肺毒性的作用机制之一。
本研究结果表明,DEHP染毒14 d,新生大鼠肺组织TGF-β1mRNA和蛋白表达随DEHP染毒剂量的增加而增加,DEHP 100和750 mg·kg-1组肺组织出现明显的病理改变,即肺泡数目减少,肺泡体积增大,肺间质增厚,肺泡隔增厚。DEHP染毒21 d,新生大鼠肺组织TGF-β1mRNA和蛋白表达随DEHP染毒剂量的增加而减少,DEHP 100和750 mg·kg-1组肺组织病理改变减轻,即肺泡间质变薄,肺泡隔变薄。由此提示,DEHP的肺毒性可能与其导致肺组织TGF-β1异常表达有关。
综上所述,DEHP染毒可以抑制新生大鼠肺形态发育,其作用机制可能与其影响肺组织MMP-9/TIMP-1平衡以及TGF-β1基因和蛋白表达有关。
[1]Wang KX,Cai HT.Practical Industrial Additives Book(实用工业助剂全书)[M].Beijing:Chemical Industry Press,2001:133-135.
[2]Giam CS,Chan HS,Neff GS,Atlas EL.Phthalate ester plasticizers:a new class of marine pollutant[J].Science,1978,199(4327):419-421.
[3]Vu TH,Werb Z.Matrix metalloproteinases:effectors of development and normal physiology[J].Genes Dev,2000,14(17):2123-2133.
[4]Fassina G,Ferrari N,Brigati C,Benelli R,Santi L,Noonan DM,et al.Tissue inhibitors of metalloproteases:regulation and biological activities[J].Clin Exp Metastasis,2000,18(2):111-120.
[5]Manji JS,O'Kelly CJ,Leung WI,Olson DM.Timing of hyperoxic exposure during alveolarization influences damage mediated by leukotrienes[J].Am J Physiol Lung Cell Mol Physiol,2001,281(4):L799-L806.
[6]Méhats C,Franco-Montoya ML,Boucherat O,Lopez E,Schmitz T,Zana E,et al.Effects of phosphodiesterase 4 inhibition on alveolarization and hyperoxia toxicity in newborn rats[J].PLoS One,2008,3(10):e3445.
[7]Franco-Montoya ML,Bourbon JR,Durrmeyer X,Lorotte S,Jarreau PH,Delacourt C.Pulmonary effects of keratinocyte growth factor in newborn rats exposed to hyperoxia[J].Am J Physiol Lung Cell Mol Physiol,2009,297(5):L965-L976.
[8]Bartram U,Speer CP.The role of transforming growth factor beta in lung development and disease[J].Chest,2004,125(2):754-765.
[9]Visse R,Nagase H.Matrix metalloproteinases and tissue inhibitors of metalloproteinases:structure,function,and biochemistry[J].Circ Res,2003,92(8):827-839.
[10]Zhao QQ,Deng C,Guo CB,Hua ZY,Feng J.Intra-amniotic endotoxin and postborn hyperoxic exposure upregulate transforming growth factor-β1and α-smooth muscle actin in newborn mice lung[J].Acta Acad Med Mil Tert(第三军医大学学报),2010,32(7):642-646.
[11]Jobe AH,Bancalari E.Bronchopulmonary dysplasia[J].Am J Respir Crit Care Med,2001,163(7):1723-1729.
[12]Liu X,Zhang DY,Wu SD,Xiong J,Wei GH.Di(2-ethylhexyl)phthalate induces hypospadic in mice and its effect on the expression of TGF-β1in genital ubercles[J].Chin J Pediatr Surg(中华小儿外科杂志),2008,29(9):565-568.
[13]Chen SQ,Chen JN,Cai XH,Chen GR,Gao Y,Ge RS,et al.Perinatal exposure to di-(2-ethylhexyl)phthalate leads to restricted growth and delayed lung maturation in newbornrats[J]. JPerinatMed, 2010, 38(5):515-521.
[14]Wei LQ,Dong Y,Li ZH.Effect of atorvastatin on MMP-9 and TIMP-1 levels in bronchoalveolar lavage fluid and serum of rats with bleomycin-induced pulmonary fibrosis[J].J Zhejiang Univ(Med Sci)〔浙江大学学报(医学版)〕.2011,40(1):64-70.
[15]Liu XY,Xu G,Xue XD.Dynamic expression and effects of MMP-9 and TIMP-1 on typeⅣcollagen in lung tissue of neonatal rats with hyperoxia-induced CLD[J].China J Mod Med(中国现代医学杂志),2008,18(16):2278-2282,2286.
