VND3207及其代谢产物在大鼠体内的药代动力学
2013-11-12王晓楠周平坤钱小红
王晓楠,关 华,周平坤,蔡 耘,3,钱小红
(1.北京工业大学生命科学与生物工程学院分子蛋白质组研究室,北京 100124;2.军事医学科学院放射与辐射医学研究所,北京 100405;3.北京蛋白质组研究中心,北京 102206)
随着科学技术的现代化,辐射与人们工作与生活联系更加紧密,在合理开发和利用资源的同时,也需要对过量的辐射进行有效地防护与治疗。Jansson等[1]发现,天然化合物香草醛(香兰素,vanillin)作为食品添加剂不但对机体和培养细胞安全无毒[1],而且能够抑制X线、γ线和紫外线诱导的染色体畸变,减轻 DNA 损伤[2-5],但其抗辐射作用的浓度相对较高,活性偏低[6]。据此,在前期研究的基础上筛选出毒性低、辐射防护作用更好的香草醛衍生物丁香醛(3,5-二甲氧基-4-羟基苯甲醛,syringaldehyde,4-hydroxy-3,5-dimethoxybenzaldehyde,VND3207)。
VND3207作为一种香草醛衍生物,具有防护高能粒子辐射损伤的抗辐射作用。药效学研究表明,VND3207能够稳定细胞基因组,减轻和修复α/γ射线诱导的DNA原初损伤,并对细胞凋亡具有良好的防护作用,而且在100倍的有效浓度下(0.5 mmol·L-1)几乎没有明显的细胞毒性,照射前和照射后给药均有效[6-7]。其药理作用机制可能与清除辐射产生的自由基并激活Akt信号通路有关[8]。VND3207作为防护电离辐射损伤的抗辐射新药,需要对其药代动力学性质进行研究,为药物的安全性和有效性提供理论基础和科学依据。因此,本研究建立了一种快速、准确、灵敏、专属的液质联用定量分析方法,用以同时测定大鼠血浆样品中原型药物VND3207及其代谢产物的浓度,并按照药代动力学定量分析的要求,对上述方法进行了相应的方法学确证。将该方法应用于VND3207临床前药代动力学研究,阐明了VND3207及其代谢产物丁香酸和丁香醇在大鼠体内的药代动力学过程和参数,并为丁香酸具有活性代谢物的潜质提供了理论依据。
1 材料与方法
1.1 试剂
香草醛标准品,批号:20111011,纯度>99%;VND3207标 准品,批 号:20110805,纯 度>99.98%,均由军事医学科学院放射与辐射医学研究所提供;3,5-二甲氧基-4-羟基苯甲酸,又名丁香酸(syringic acid)标准品,批号:110905,纯度>98%,购自北京偶合科技有限公司;3,5-二甲氧基-4-羟基苯甲醇,又名丁香醇(syringic alcohol)标准品,批号:10119558,纯度>97%,购自美国 ALFA化学试剂公司,化学结构见图1。乙腈,色谱纯和依地酸(乙二胺四乙酸)二钾,购自Sigma-Aldrich公司。纯净水,购自娃哈哈公司。甲酸,质谱分析纯,购自Fluka公司。羧甲纤维素钠,化学纯,购自国药集团化学试剂有限公司。
Fig.1 Chemical structures of VND3207(A),syringic acid(B),syringic alcohol(C)and vanillin(D).
1.2 仪器
4000 Q TRAP PLC/MS/MS Systems三级四级杆-离子阱混合型质谱仪,配有电喷雾(ESI)离子源和Analyst 1.5数据处理软件,购自美国Applied Biosystems公司;1260 Infinity型高效液相色谱仪(G1312C二元梯度泵、G1322A在线真空脱气机、G1367E WPS自动进样器、G1330B控温模块和G1316A柱温箱),购自美国Agilent Technologies公司;Model 11 Plus注射泵,购自美国 Harvard Apparatus公司;Sorvall Legend Micro 17型离心机,购自美国Thermo Scientific公司;3K30台式高速冷冻离心机,购自德国 Sigma公司;SANANT SPD 2010 Speed Vac浓缩仪,购自美国Thermo Scientific公司。
1.3 动物、给药及血样采集
健康 SD大鼠6只,SPF级,雄性,体质量210~230 g,分笼用标准饲料喂养,自由饮水,由北京军事医学科学院实验动物中心提供,动物许可证号:SCXK-(军)2007-004。用0.5%羧甲纤维素钠水溶液配成VND3207混悬液给药,空腹 ig给予0.7 ml,VND320770 mg·kg-1。分别于给药前和给药后1,5,10,15,25,40 min,1,1.5,2,3,4,6,8和 12 h 大鼠尾静脉采集全血 0.5 ml,20 μl 2%EDTA水溶液抗凝,1858×g离心10 min取上清液,血浆保存于-80℃待测。
1.4 标准曲线及质控样品的配制
用乙腈-水(1∶1,V/V)分别配制 VND3207,丁香酸,丁香醇和香草醛储存液,然后将VND3207,丁香酸,丁香醇储存液按比例混合,用乙腈-水(1∶1,V/V)稀释成浓度为:0.01,0.02,0.1,0.5,2.5,5和10 mg·L-1的溶液作为标准曲线工作液,香草醛用乙腈-水(1∶1,V/V)配制成 1 mg·L-1的溶液作为内标工作液。最后将20 μl样品工作液和10 μl内标工作液加入到80 μl空白血浆中,配制成浓度为2,4,20,100,500,1000 和2000 μg·L-1的血浆样品作为标准曲线。采用VND3207、丁香酸和丁香醇4,100 和 1000 μg·L-1为质控样品,进行方法学确证。
1.5 血浆样品预处理
标准曲线血浆样品,质控血浆样品和待测血浆样品各取 100 μl,分别加入 10 μl内标工作液和300 μl乙腈沉淀蛋白,涡旋震荡 1 min,15000 × g离心10 min,取350 μl上清液常温浓缩,移除全部溶剂,然后加入 30 μl甲酸-乙腈-水(0.1∶5∶95,V/V)重溶样品,涡旋震荡1 min,15000×g离心5 min,取上清液10 μl进行定量分析。
1.6 HPLC-MS/MS法测定 VND3207及其代谢产物的血药浓度
1.6.1 色谱条件
色谱柱为 Agilent ZORBAX Eclipse Plus C18column(2.1 mm ×50 mm,5 μm);流动相 A 为甲酸-水溶液(0.1∶100,V/V),流动相 B 为甲酸-乙腈溶液(0.1∶100,V/V),流速 400 μl·min-1,流动相(A∶B)洗脱梯度 0~0.5 min,95∶5~20∶80;0.5~2.5 min,20∶80~5∶95;2.5~3.5 min,5∶95;3.5~4 min,5∶95~95∶5,4~9 min,95∶5其中样品洗脱时间为4 min,色谱柱平衡时间为5 min,柱温为室温。
1.6.2 质谱条件
ESI离子源,扫描方式为正离子多反应监测(MRM)。定性离子反应分别为质荷比(mass-tocharge,m/z)183.0→123.1(VND3207),m/z 199.0→155.1(丁香酸),m/z 167.1→123.1(丁香醇),m/z 153.1→125.1(内标);定量离子反应分别为 m/z 183.0→155.1(VND3207),m/z 199.0→140.1(丁香酸),m/z 167.1→78.1(丁香醇),m/z 153.1→93.0(内标);驻留时间为200 ms;碰撞气压力N2为设为“Medium”;气帘气压力为20 psi;气体1压力为65 psi;气体2压力N2为50 psi;离子喷雾电压为5500 V;温度为650℃;入口电压为10 psi;出口电压为10 psi;去簇电压为45 V(m/z 183.0→123.1,183.0→155.1,153.1→93.0),57 V(m/z 199.0→155.1,199.0→140.1),47 V(m/z 167.1→123.1,167.1→78.1),50 V(m/z 153.1→125.1);碰撞电压为 15 V(m/z 183.0→123.1,153.1→93.0),19 V(m/z 183.0→155.1),13V(m/z 199.0→155.1),20V(m/z 199.0→140.1),22V(m/z 167.1→123.1,167.1→78.1),15 V(m/z 153.1→125.1)。
1.6.3 HPLC-MS/MS法测定VND3207及其代谢产物的方法学考察
以VND3207、丁香酸和丁香醇的色谱峰面积与内标峰面积比为纵坐标(Y),以VND3207、丁香酸和丁香醇的质量浓度与内标质量浓度比为横坐标(X),权重因子为 1/X2,进行线性回归,得VND3207、丁香酸和丁香醇的标准曲线回归方程。
用大鼠空白血浆配制VND3207、丁香酸和丁香醇4,100,1000 μg·L-1质控样品,每个浓度进行5样本分析,连续测定3 d,计算准确度、日内精密度与日间精密度。
分别用空白血浆和空白基质配制VND3207、丁香酸和丁香醇4,100 和1000 μg·L-1的质控样品,每个浓度进行5样本分析,根据基质加入前后和样品提取前后质谱信号响应的色谱峰面积比,计算基质效应与提取回收率。
用大鼠空白血浆配制VND3207、丁香酸和丁香醇4,100 和1000 μg·L-1的质控样品,每个浓度进行5样本分析,分别考察VND3207、丁香酸和丁香醇4,100 和1000 μg·L-1在 10℃自动进样器中放置6 h;血浆样品在室温放置3 h、血浆样品在-80℃冷冻保存30 d、血浆样品反复冻融2次以及血浆样品4℃冷藏保存35 d的稳定性。
1.7 统计学分析
标准曲线回归方程由权重1/X2最小二乘法校正求得。血药浓度的拟合计算由Analyst 1.5数据处理软件完成。血药浓度-时间数据及药代动力学参数的计算由Office Excel 2007软件完成,相关图表由Orign 6.0软件绘制。
2 结果
2.1 HPLC-MS/MS的方法学验证
2.1.1 VND3207、丁香酸和丁香醇的专属性与特异性
根据VND3207、丁香酸、丁香醇和内标的一级和二级全扫描质谱结果,分别确定定性和定量离子对。VND3207、丁香酸、丁香醇和内标的色谱峰保留时间分别为 2.79,2.68,2.60 和 2.78 min,表明VND3207、丁香酸和丁香醇不受血浆内源物质干扰,本方法具有一定专属性与特异性。
2.1.2 VND3207、丁香酸和丁香醇的校正标准曲线
VND3207、丁香酸和丁香醇定量标准曲线线性范围为2~2000 μg·L-1,标准曲线回归方程分别为Y=0.00541X+0.0108(r=0.9918),Y=0.00157X+0.00231(r=0.9980),Y=0.000294X+0.000442(r=0.9955),最低定量下线均为2 μg·L-1。
2.1.3 VND3207、丁香酸和丁香醇的准确度与精密度
VND3207、丁香酸和丁香醇 4,100和1000 μg·L-1定量的准确度在 91.2%~110.7% 之间,日内和日间精密度CV<15%,方法的准确度和精密度均符合生物样品血药浓度分析的要求。
2.1.4 基质效应与提取回收率
表1结果表明,基质对VND3207和内标的质谱信号响应有增强作用,对丁香酸和丁香醇的质谱信号响应有抑制作用。采用乙腈蛋白沉淀法处理血浆样品提取回收率较高,除 VND32074 μg·L-1提取回收率为(68.7±4.1)%外,VND3207,丁香酸和丁香醇的提取回收率均>92%,均CV<15%。
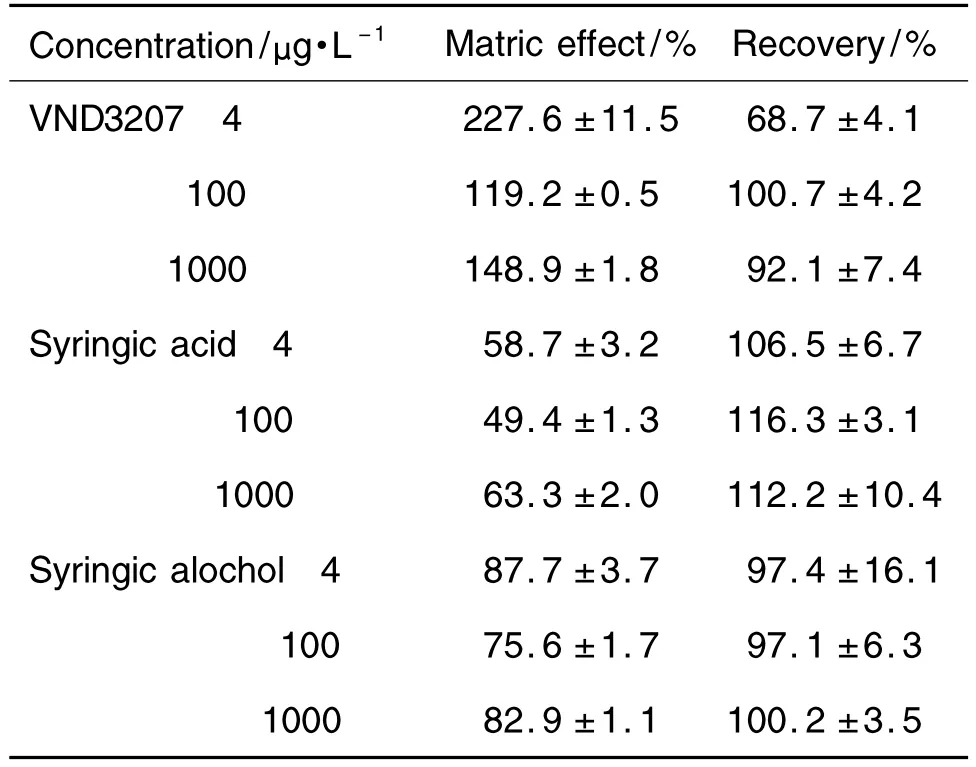
Tab.1 MatrixeffectandrecoveryofVND3207,syrangic acid and syringic alcohol in plasma of rats
2.1.5 稳定性
如表2所示,VND3207、丁香酸和丁香醇4,100和 1000 μg·L-1在 10℃自动进样器中放置 6 h;血浆样品在室温放置3 h、血浆样品在-80℃冷冻保存30 d血浆样品反复冻融2次以及准确度均在(87.5±9.4)%~(117.6±5.7)%(-80℃保存30 d丁香醇除外)。受试品4,100 和1000 μg·L-1质控样品定量分析的浓度分别为VND3207:3.8±0.1,105.1±2.6 和(932.2±20.3)μg·L-1,丁香酸:3.9±0.7,94.5±3.2 和(919.4±40.0)μg·L-1,丁香酸:4.1±0.3,103.3±3.1 和(957.5±34.0)μg·L-1;准确度均在 (91.1±3.3)%~(105.3±2.6)%以上稳定性的考察能够覆盖样品从采集到检测的时间,由检测结果分析,血浆样品在-80℃冷冻保存30 d后VND3207具有较好的稳定性,而丁香醇的含量明显降低,丁香酸的含量有所增高,因此应在血浆样品采集后尽快进行检测,不易长期保存。
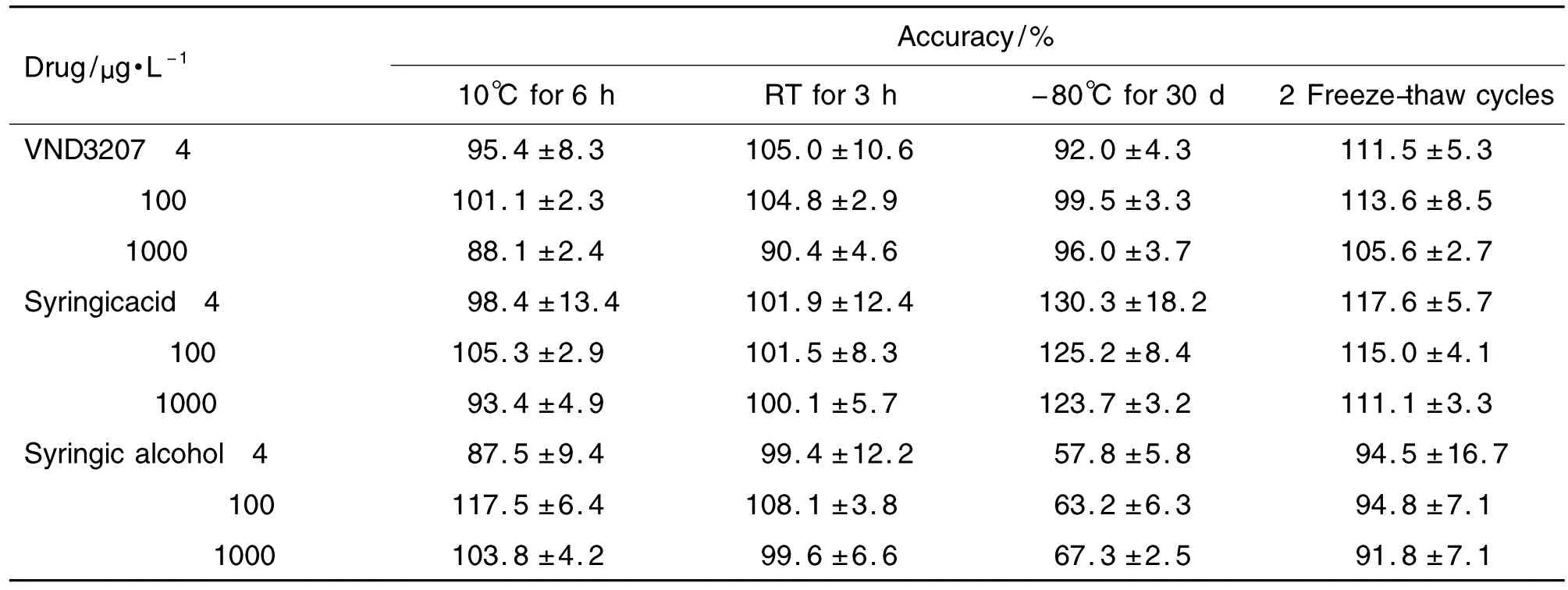
Tab.2 Stability of VND3207,syringic acid and syringic alcohol in plasma of rats
2.2 VND3207及其代谢产物的血药浓度和药代动力学
测定大鼠单次 ig给予VND320770 mg·kg-1后1,5,10,15,25,40 min,1,1.5,2,3,4,6,8和12 h血浆中VND3207及其代谢产物丁香酸和丁香醇的平均血药浓度-时间曲线(图2),计算药代动力学参数(表3)。
血浆中原型药物VND3207及其代谢产物丁香酸和丁香醇分别于3.2,13.3 和6.8 min达到最大峰浓度 1.44±0.88,28.82±12.23 和(0.33±0.14)mg·L-1,清除半衰期分别为 78.0±44.6,114.4±17.9 和(66.0±23.8)min,平均驻留时间分别为31.5±10.2,85.5±21.4 和 (39.5±7.7)min,VND3207在体内吸收和消除的速率快,体内驻留时间短。
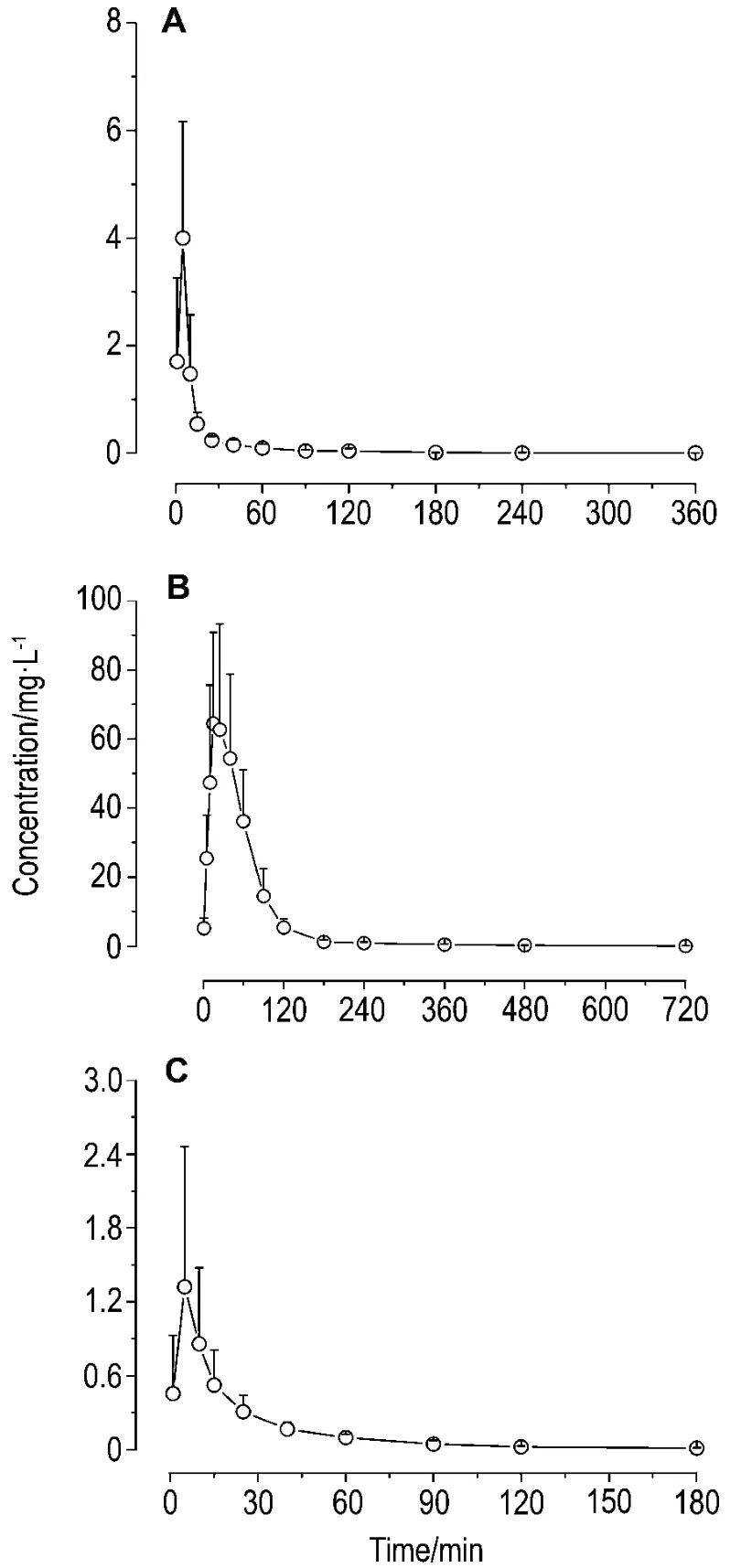
Fig.2 Concentration-time profiles of VND3207(A),syringic acid(B)and syringic alcohol(C)in plasma of rats.VND320770 mg·kg-1was ig given rats,and blood samples were collected and VND3207,syringic acid,and syringic alcohol concentrations in plasma were determined by HPLC-MS/MS.±s,n=6.
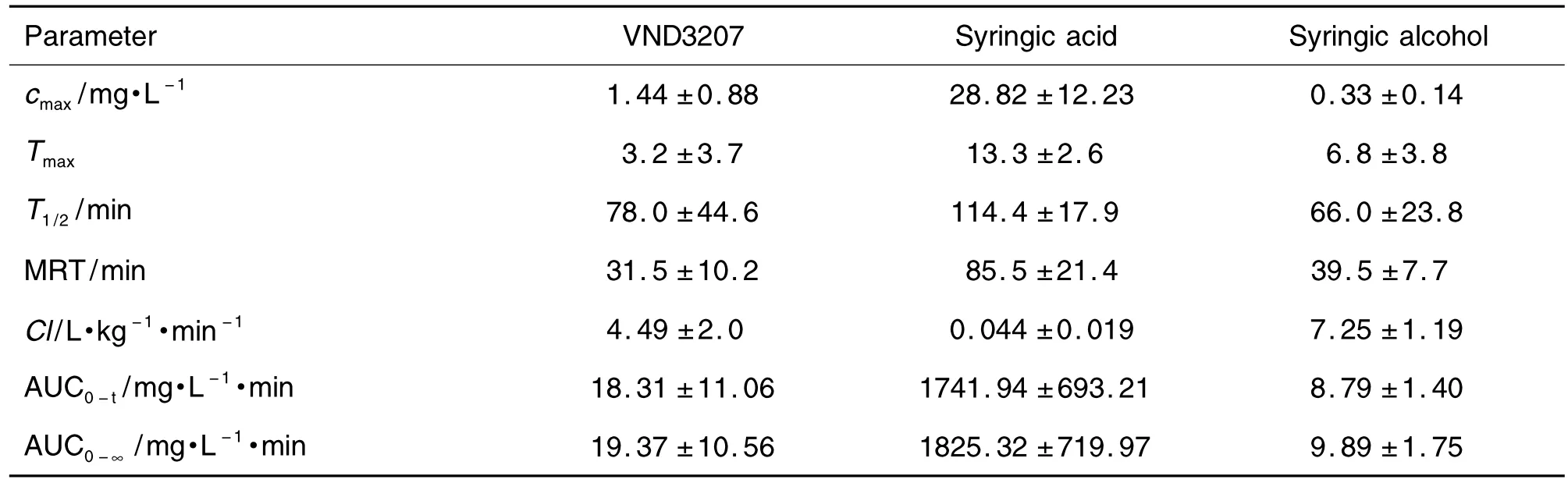
Tab.3 Pharmacokinetic parameters of VND3207,syringic acid and syringic alcohol in rat plasma after VND320770 mg·kg -1was ig given to rats
3 讨论
VND3207作为防护电离辐射损伤的抗辐射新药,对其药代动力学进行研究具有重要意义。在本研究中,首先对比了固相萃取法[9-10],乙酸乙酯萃取法[11],环己烷萃取法[12]和乙腈蛋白沉淀法对复杂基质样品中香草醛衍生物的提取效率。结果表明,乙腈蛋白沉淀法具有较好的提取特异性和较高的提取回收率,且成本低、操作简便,因此,采用乙腈蛋白沉淀法作为血浆样品制备方法。参考香草醛衍生物液质联用分析方法的相关文献报道[13-14],优化了不同流动相的组成、配比、pH值、流速、洗脱梯度等色谱条件,最终获得最佳的色谱峰形和检测灵敏度。
在此基础上,本实验室开展了VND3207及其代谢产物的药代动力学初步研究。结果表明,大鼠口服给药后VND3207被机体快速吸收,而达到血液循环的药量明显低于给药剂量,同时在血浆中检测到大量VND3207的氧化代谢产物丁香酸和少量的还原代谢产物丁香醇。可能是由于VND3207从胃肠道吸收后经过门静脉进入肝,在肝丰富的酶系作用下产生原药的首过效应,从而将大量的VND3207氧化为代谢物丁香酸。与原型药物VND3207相比,丁香酸在大鼠体内的AUC较高,T1/2和MRT时间更长、cmax浓度更大,前期药效学研究也发现,实验动物在被照射前30 min口服给予VND3207,仍具有较好的抗辐射作用,而口服给药25 min后VND3207的血药浓度已降为(105.1±64.6)μg·L-1,远比代谢产物丁香酸(23416.7±11193.3)μg·L-1的血药浓度低,因此,推测代谢产物丁香酸极有可能成为潜在的活性代谢物。由于丁香酸在大鼠体内的暴露量大于原药暴露量的10%,因此,对其药效学活性和药动学评价的相关研究工作已经开展,实验结论有待确定。
本实验首次建立了同时准确测定大鼠血浆中VND3207及其代谢产物的液质联用定量分析方法,并将该方法应用于VND3207及其代谢产物的药代动力学研究。初步的研究结果对新药研发过程中给药剂量的确定,药物制剂的研究,药物代谢途径的探讨等都具有参考价值。
致谢:感谢军事医学科学院微生物流行病研究所药学研究室程远国研究员协助完成动物实验。
[1]Jansson T,Zech L.Effects of vanillin on sister-chromatid exchanges and chromosome aberrations in human lymphocytes[J].Mutat Res,1987,190(3):221-224.
[2]Sasaki YF, Imanishi H, Watanabe M,Ohta T,Shirasu Y.Suppressing effect of antimutagenic flavorings on chromosome aberrations induced by UV-light or X-rays in cultured Chinese hamster cells[J].Mutat Res,1990,229(1):1-10.
[3]Imanishi H, Sasaki YF, Matsumoto K, Watanabe M,Ohta T,Shirasu Y,et al.Suppression of 6-TG-resistant mutations in V79 cells and recessive spot formations in mice by vanillin[J].Mutat Res,1990,243(2):151-158.
[4]Liu GA,Zheng RL.Protection against damaged DNA in the single cell by polyphenols[J].Pharmazie,2002,57(12):852-854.
[5]Maurya DK, Adhikari S, Nair CK, Devasagayam TP.DNA protective properties of vanillin against gamma-radiation under different conditions:possible mechanisms[J].Mutat Res,2007,634(1-2):69-80.
[6]Huang R,He XP,Xu QZ,Wang Y,Huang B,Zhou PK.Protection of vanillin derivative VND3207 on genome damage and apoptosis of human lymphoblastoid cells induced by γ-ray irradiation[J].Radiat Prot(辐射防护),2009,29(4):225-231.
[7]Chen QQ, Wang L, Shang ZF, Liu XD,Wang Y,Zheng H, et al. Radioprotection of vanillin derivative VND3207 against genomic DNA damage of human fibroblastoid cells induced by α particles[J].Sci Technol(科技导报),2010,28(4):31-36.
[8]Zheng H,Chen ZW,Wang L,Wang SY,Yan YQ,Wu K,et al.Radioprotection of 4-hydroxy-3,5-dimethoxybenzaldehyde(VND3207)in culture cells is associated with minimizing DNA damage and activating Akt[J].Eur J Pharm Sci,2008,33(1):52-59.
[9]Danielle R,Kevin R,Shimon L.Determination of phenolic compounds in olives by reversed-phase chromatography and mass spectrometry[J].J Chromatogr A,1999,832:87-96.
[10]Adahchour M,Vreuls RJ,van der Heijden A,Brinkman UA.Trace-level determination of polar flavour compounds in butter by solid-phase extraction and gas chromatography-mass spectrometry[J].J Chromatogr A,1999,844(1-2):295-305.
[11]Mahler S,Edwards PA,Chisholm MG.HPLC identification of phenols in Vidal Blanc wine using electrochemical detection[J].J Agric Food Chem,1988,36:946-951.
[12]Valdez JS,Martin DK,Mayersohn M.Sensitive and selective gas chromatographic methods for the quantitation of camphor,menthol and methyl salicylate from human plasma[J].J Chromatogr B Biomed Sci Appl,1999,729(1-2):163-171.
[13]Dinelli G,Carretero AS,Di Silvestro R,Marotti I,Fu S,Benedettelli S,et al.Determination of phenolic compounds in modern and old varieties of durum wheat using liquid chromatography coupled with time-of-flight mass spectrometry[J].J Chromatogr A,2009,1216(43):7229-7240.
[14]Abdul HL,Shahabuddin M,Aisha N,Khalid MK,Arfa Y.Determination of free phenolic acids and antioxidant activity of methanolic extracts obtained from fruits and leaves of Chenopodium album[J].Food Chem,2011,126:1850-1855.
