高表达受体活性修饰蛋白1对血管紧张素Ⅱ和降钙素基因相关肽诱导的A10细胞降钙素受体样受体膜分布的影响
2013-11-12唐江琼郑元斌秦又发陈临溪秦旭平
孙 飞,唐江琼,郑元斌,秦又发,陈临溪,秦旭平
(1.南华大学药物药理研究所,湖南衡阳 421001;2.成都军区昆明总医院药剂科,云南昆明 650032)
降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是辣椒素敏感性感觉神经末梢释放的神经肽,在调节心血管功能方面发挥重要作用。前期研究证实,一定浓度的CGRP能抑制血清或血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)诱导大鼠血管平滑肌细胞(vascular smooth muscle cell,VMSC)的增殖[1-2]。CGRP功能发挥是通过其受体而实现的。CGRP受体是由降钙素受体样受体(calcitonin receptor-like receptor,CRLR),受体活性修饰蛋白1(receptor activity modifying protein 1,RAMP 1),受体组分蛋白(receptor component protein,RCP)3个组分组成。目前研究表明,对CGRP的应答作用主要是磷酸化CRLR的过程,而RAMP1的主要作用是糖基化CRLR和作为一种分子伴侣蛋白,将CRLR 转运至胞 膜 上[3-4]。有 实 验 证 实,增 加RAMP1表达可以加强VSMC对CGRP的应答作用[5-6]。本实验观察高表达 RAMP1 后,CGRP 对AngⅡ诱导的VSMC增殖及CRLR蛋白表达的影响。
1 材料与方法
1.1 菌株和质粒
大肠杆菌E.coli DH5α由南华大学生物化学教研室胡小波博士馈赠;pCDNA3.1/+质粒由本实验室保存。
1.2 主要试剂
CGRP,AngⅡ和 MTT,购自 Sigma公司;DMEM培养基和胎牛血清,购自Gibco公司;BCA Protein Assay Kit,购自 HyClone-PIERCE Biotechnology公司;RAMP1(兔多克隆抗体)、CRLR(山羊多克隆抗体)一抗及Western blotting Luminol Reagent,均购自Santa Cruz公司;β肌动蛋白一抗(兔多克隆抗体)及二抗(HRP-兔抗山羊和HRP-山羊抗兔),购自博士德公司;无内毒素质粒小提试剂盒,购自百泰克;GenClean琼脂糖凝胶DNA回收试剂盒和DNA快速连接试剂盒,均购自上海捷瑞生物公司;LipofectamineTM2000转染液和Trizol试剂,购自Invitrogen公司;EcoRI和BamHI内切酶、RevertAidTMFirst Stand cDNA Synthesis Kit,购自Fermentas LIFE SCIENCES公司;通用PCR试剂,购自上海生工生物工程有限公司;其他实验所需试剂均为分析纯。
1.3 主要仪器
Mini PROTEANR 3 cell,美国;凝胶成像系统(Alphalmager TM 2200,美国),Centrifuge5810/5810R型离心机,德国;IX70型荧光倒置显微镜,日本;TRANS-BLOTR SD SEMI-DRY TRANSFER CELL,美国;MyCyclerTM Thermal cycler,美国。
1.4 大鼠血管平滑肌细胞株A10细胞培养
A10购自ATCC。常规培养于含10%胎牛血清的DMEM培养液中,置于37℃ 5%CO2恒湿恒温培养箱中培养。待细胞长满后进行传代培养用于实验。
1.5 pCDNA3.1(+)-RAMP1 载体构建
从A10细胞中提取总RNA进行RT-PCR,获取带有酶切位点(EcoRⅠ和BamHⅠ)的RAMP1的开放阅读框,再经过酶切、连接、转化至 E.coli DH5α中,挑单克隆经初步鉴定后,送北京诺赛生物公司测序。
1.6 细胞转染
将对数生长期的A10细胞消化接种于24孔板中,每孔1×105个细胞,待细胞长至80%融合时,换成完全培养基进行转染。转染前1 h用PBS洗2次,每孔加上500 μl opti-MEM培养基。按转染试剂产品说明书提供的方法,用脂质体LipofectamineTM2000介导将带有RAMP1的基因载体转染入A10细胞,转染4 h后换成10%FBS培养基,24 h后按1∶10比例进行传代,再常规培养24 h后各组加入500 μl G418500 mg·L-1进行筛选,3 d更换1次筛选培养基。2周后可见克隆形成,将单克隆胰酶消化移至25 ml培养瓶中扩大培养(G418250 mg·L-1),冻存细胞。
1.7 细胞分组处理
取生长良好的对数生长期的正常细胞(无质粒转染)、仅转染 pCDNA3.1(+)细胞〔pCDNA3.1(+)〕及转染 pCDNA3.1(+)-RAMP1质粒的细胞〔pCDNA3.1(+)-RAMP1〕,PBS 洗2 次,胰蛋白酶消化后,用含10%FBS的DMEM制成细胞悬液,接种于96孔板,置于37℃、5%CO2培养箱中培养24 h后,更换为含0.1%FBS的DMEM培养24 h使细胞同步化,按照分组,3种细胞分别用AngⅡ 100 nmol·L-1、CGRP 100 nmol·L-1和CGRP(预处理30 min)+AngⅡ处理24 h。
1.8 MTT法检测A10细胞存活率
取1.7 处理的细胞,PBS 洗3 次,加20 μl MTT 5 g·L-1处理4 h 后,加 DMSO 振荡10 min,用酶联免疫仪在波长570 nm处读取吸光度(absorbance,A)值,根据公式计算细胞存活率,存活率(%)=A处理组/A对照组×100%。
1.9 逆转录 PCR检测RAMP1和CRLR mRNA水平
取1.7处理的细胞,提取细胞总RNA。细胞总RNA的提取按Trizol抽提试剂说明书进行。逆转录反应按RevertAidTMFirst Stand cDNA Synthesis Kit说明书进行。PCR 反应体系组成:9.5 μl ddH2O,12.5 μl 2 ×PCR Master,1 μl cDNA,上下游引物分别是:RAMP1为 5'-CGGGATCCACGGGGCTCTGCTTGCCATG-3'和5'-CCCGGAATTCCTACACGATGCCCTCTGTGCG-3';CRLR为5'-CAGCAGGAACCGAGTCAA-3'和5'-AGGCAGGAAGCAGAGGAA-3';β肌动蛋白为5'-CACCCGCGAGTACAACCTTC-3'和5'-CCCATACCCACCATCACACC-3'。取各引物 1 μl(10 μmol·L-1),混匀后,短速离心,按以下条件进行反应:预变性94℃ 5 min,变性 94℃ 40s,退 火 40s(RAMP1:65℃,β肌动蛋白:62℃,CRLR:62℃),延伸72℃ 40 s,进行30个循环,最后72℃延伸10 min。结束后,取产物5 μl,1.0%琼脂糖凝胶电泳(80 V,40 min),用灰度扫描目标条带的积分吸光度值(integrated absorbance,IA)与内标IA比值的半定量法分析目的基因的表达变化。
1.10 Western印迹法检测RAMP1和CRLR蛋白水的水平
取1.7处理的细胞,提取细胞总蛋白。用细胞裂解液裂解细胞,收集蛋白质,采用BCA法测定细胞蛋白质含量。蛋白质变性后每孔上样65 g,经SDS-PAGE(RAMP1:12%;CRLR:10%,β肌动蛋白:10%)电泳后,10 V,400 mA半干式电转至PVDF膜上(RAMP1:10 V,20 min;CRLR:10 V,40 min;β 肌动蛋白:10 V,25 min)。TBST(Tris·Cl 50 mmol·L-1,pH 7.6,NaCl 150 mmol·L-1,0.1%Tween 20)配制的5%脱脂牛奶室温摇床封闭1 h,加入一抗(RAMP1效价为1∶100;CRLR 为1∶200;β 肌动蛋白为1∶1000)4℃孵育过夜,TBST洗膜4次(每次10 min)后加入辣根过氧化物酶标记的山羊抗兔二抗(效价为1∶1000)或兔抗山羊二抗(1∶1000),室温下摇床孵育2 h,TBST洗膜4次(每次15 min),暗室中加发光剂A、B混液各200 μl于PVDF膜上激发荧光后压片30 min后显影、定影,洗片晾干后,用灰度扫描目标条带与内标IA比值的半定量法来分析靶蛋白表达的变化。
1.11 免疫荧光检测RAMP1和CRLR的膜分布
取1.7处理的细胞,PBS洗3次(5 min×3);4%多聚甲醛室温固定30 min后,PBS洗3次(5 min×3);0.1%TritonX-100处理 10 min后,PBS洗3次(5 min×3);5%BSA封闭1 h后,加入一抗〔RAMP1(1 ∶30);CRLR(1∶60)〕4℃过夜,PBS洗3次(5 min×3),避光加入荧光标记的荧光二抗〔FITC标记的驴抗兔IgG(1∶20);TRITC标记的驴抗山羊(1∶60)〕室温下2 h后,PBS避光洗3次(5 min×3)。倒置荧光显微镜下观察,RAMP1带表现为绿色荧光,CRLR带表现为红色荧光。
1.12 统计学处理
2 结果
2.1 转染RAMP1细胞的鉴定
图1A结果显示,pCDNA3.1(+)-RAMP1转染组细胞中RAMP1 mRNA水平明显高于无转染的正常细胞和pCDNA3.1(+)转染组细胞(P<0.05)。图1B 结果显示,pCDNA3.1(+)-RAMP1组细胞中RAMP1蛋白水平高于正常细胞和pCDNA3.1(+)组(P<0.05)。这表明用脂质体能成功地将RAMP1基因转染于A10细胞并能正常表达。

Fig.1 Determination of receptor activity modifying protein 1(RAMP1)gene expression by RT-PCR(A)and protein expression by Western blotting(B)in A10 cells.A2 and B2 were the semiquantitative result of A1 and B1,respectively.Lane 1:normal cells;lane 2:pCDNA3.1(+)cells;lane 3:pCDNA3.1(+)-RAMP1 cells.±s,n=3.*P<0.05,compared with normal cells;#P<0.05,compared with pCDNA3.1(+)cells.
2.2 高表达RAMP1对CGRP抑制AngⅡ诱导的A10细胞存活的影响
图2 结果显示,转染对3种细胞的存活率无影响。但单独用CGRP、AngⅡ处理细胞或两者合并则能显著增加3组细胞的存活率(P<0.05)。CGRP处理使pCDNA3.1(+)-RAMP1细胞存活率明显高于其他两组细胞,差异有统计学意义(P<0.05),提示高表达RAMP1能增加CGRP对静止期细胞的增殖活性;AngⅡ能增加3组细胞的存活率,但组间无明显差异,说明 RAMP1高表达对AngⅡ引起的细胞存活率无影响;高表达RAMP1用CGRP预处理细胞30 min,再加入AngⅡ培养作用24 h,细胞存活率明显低于单纯AngⅡ处理组(P<0.05),说明高表达RAMP1能增强CGRP抑制AngⅡ诱导的A10细胞增殖作用。
2.3 高表达RAMP1对CRLR表达的影响
图3结果显示,正常细胞、pCDNA3.1(+)细胞和 pCDNA3.1(+)-RAMP1细胞经 AngⅡ和(或)CGRP处理24 h后,CRLR mRNA水平无统计学意义(图3A);无血清或AngⅡ对3种细胞的CRLR蛋白表达无差异,单独使用CGRP处理使RAMP1高表达组细胞中CRLR蛋白表达增加(P<0.05),而 RAMP1高表达组细胞用 CGRP预先处理30 min再加入AngⅡ处理24 h后,细胞CRLR蛋白表达低于其他两组(P<0.05)(图3B)。
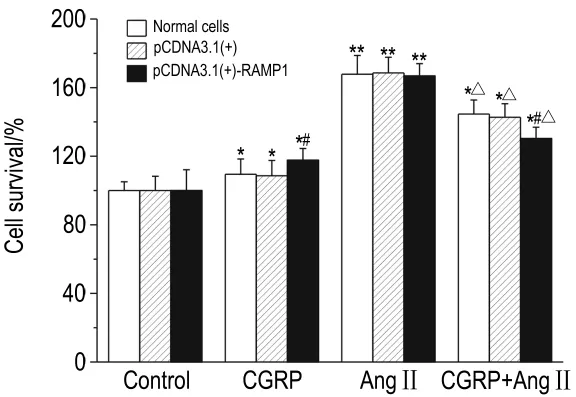
Fig.2 Effect of RAMP1 overexpression on A10 proliferation by MTT.Three kinds of cells were treated with AngⅡ,CGRP or CGRP+AngⅡfor 24 h .±s,n=5.*P<0.05 ,**P<0.01,compared with the cells of control group;#P<0.05,compared with corresponding pCDNA3.1(+)cells with the same treatment;△P<0.05,compared with the cells of AngⅡtreated group.

Fig.3 Effect of RAMP1 overexpression on expression of CRLR gene(A)and protein(B)in A10 cell by RT-PCR(A)and Western blotting(B).A2 and B2 were semiquantitative result of A1 and B1,respectively.a:normal cells;b:pcDNA3.1(+)transfected cells;c:pcDNA3.1(+)-RAMP1 cells.Lane 1:normal control group;lane 2:CGRP group;lane 3:AngⅡ group;lane 4:CGRP+AngⅡgroup.±s,n=3.*P<0.05 ,**P<0.01,compared with normal control group;#P<0.05 ,compared with pCDNA3.1(+)cells with the same treatment;△P<0.05,compared with AngⅡ group.
2.4 高表达RAMP1对CRLR在细胞膜上分布的影响
免疫荧光检测RAMP1和CRLR的膜分布结果(图4)显示,使用无血清或CGRP后,正常细胞和pCDNA3.1(+)细胞中的两种蛋白主要分布于胞核周围的胞浆区域(图4A,B:a1~a3,b1~b3),而高表达RAMP1组细胞中RAMP1与CRLR在膜上分布增加(图4A,B:c1~c3);单独使用AngⅡ或联合使用CGRP和AngⅡ处理的3种细胞,其RAMP1和CRLR在膜上都有分布(图4C,D),且高表达组细胞中RAMP1与CRLR在膜上分布(图4C,D:c1~c3)多于正常细胞和空载体转染组细胞,说明细胞高表达RAMP1能促进CRLR向膜转移。
3 讨论
本实验结果表明,高表达 RAMP1能增强CGRP抑制AngⅡ诱导的A10细胞增殖作用,其作用可能是通过增加CRLR的膜分布从而增强CGRP敏感性来实现。从本实验可以看出,静止期细胞无论是否高表达RAMP1,细胞的存活率均无改变,但给予CGRP和(或)AngⅡ均能促使细胞增殖(存活率增加),AngⅡ对未转染的正常细胞、pCDNA3.1(+)质粒转染细胞或 pCDNA3.1(+)-RAMP1细胞的增殖作用最强,但3种细胞增殖率无差异;而在CGRP处理组细胞,高表达RAMP1组细胞的存活率却显著高于未转染组和空载体组,这说明高表达RAMP1能增加对CGRP的应答作用。
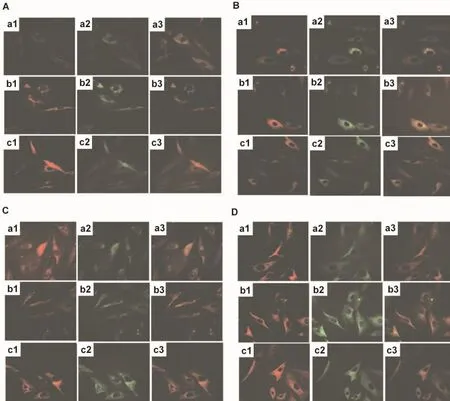
Fig.4 Distribution of RAMP1 and CRLR on normal A10 cell membrane(a1 -a3),pCDNA3.1(+)transfected cells(b1 -b3)and pCDNA3.1(+)-RAMP1 cells(c1 -c3).A:normal control group;B:CGRP treated group;C:AngⅡtreated group;D:CGRP+AngⅡtreated group.
目前已明确CGRP受体活化是由RAMP1和CRLR介导的。CRLR主要以3种形式存在:即50 ku,66 ku和110 ku。但是,本实验只检测到了CRLR的66 ku和50 ku形式,而并没有检测到110 ku的二聚体形式。本实验结果显示,无论是在正常细胞、pCDNA3.1(+)质粒转染细胞或 pCDNA3.1(+)-RAMP1细胞,无论有无CGRP和(或)AngⅡ处理,各组细胞的中CRLR mRNA水平没有变化,但是经CGRP和(或)AngⅡ处理的3种细胞CRLR(66 ku)的蛋白表达水平与未经CGRP或AngⅡ处理的细胞却显著增加,说明CGRP或AngⅡ能增加细胞CRLR的表达。但是CRLR蛋白之间的变化并不是因为高表达RAMP1所引起的,而可能是由于CGRP或AngⅡ引起细胞增殖导致的,这一推测已在其他研究中得到证实[7]。本实验室前期结果也表明,RAMP1高表达可延长CGRP和AngⅡ诱导的VSMC的倍增时间[8]。对上述现象的解释,Cueille等[9]认为可能与CRLR基因启动子序列中的一个反式作用元件低氧诱导因子1α(hypoxiainducible factor-1 alpha,HIF-1α)表达增加有关,认为HIF-1α表达增加加强了CRLR的转录后调节,进而使CRLR蛋白表达水平升高,CRLR的启动子序列中除了包含HIF-1α的顺式作用元件外,还有Sp-1、Pit-1和糖皮质激素结合位点[10]。所以猜想该实验结果很有可能是CGRP或AngⅡ增加了CRLR启动子序列中某个调节元件的表达,从而加强了CRLR的转录后调节,使CRLR蛋白表达水平升高。另外,在本实验中需要说明的是,在联合使用CGRP和AngⅡ后,RAMP1高表达细胞的CRLR(66 ku)蛋白表达水平低于未转染的正常细胞和空载体转染细胞;而单独使用CGRP处理后,高表达RAMP1细胞的CRLR(66 ku)蛋白表达水平高于未转染组和空载体组;这表明在静止期细胞,CGRP能通过增加CRLR的表达增加细胞的生存率,而在CGRP预处理细胞能抑制细胞的增殖,使单位体积细胞的数量减少,从而高表达 RAMP1细胞的CRLR(66 ku)蛋白总体水平降低,但这并不能说明单个细胞CRLR的表达降低。
本实验的免疫荧光结果显示,在无血清和CGRP处理因素的条件下,未转染组和空载体组细胞中的RAMP1和CRLR大多分布于胞核周围的胞浆区域,而高表达组中的这两个蛋白在膜上的分布增加;单独使用AngⅡ或联合使用CGRP的3种细胞,其两种蛋白都趋向于膜上分布,尤其在高表达组中,这种趋势更加明显。这一结果表明高表达RAMP1增强CGRP的抗增殖作用可能是通过增加CRLR膜分布,从而增强CGRP受体对CGRP的敏感性起作用。
RAMP1促进CRLR的膜分布的机制还不完全清楚。已证实,血管平滑肌细胞中存在CRLR和3种 RAMP[11],即 RAMP1,RAMP2 和 RAMP3,3 种亚型之间与CRLR结合存在竞争。所以当RAMP1表达增加时,可能增加了RAMP1与CRLR结合的竞争力,加强了对CGRP的应答作用。除此之外,Héroux等[12]用双分子荧光互补和化学发光共振能量转移等技术证实:RAMP1和CRLR都能形成同源二聚体存在与内质网上。但是,只有当一分子的RAMP1与CRLR的同源二聚体形成异源三聚体时,才能被转运至胞膜上。另外,RAMP1也存在同源二聚体形式,其功能不清。推测RAMP1·RAMP1在调节功能型CGRP受体形成方面起重要作用;其次,RAMP1同源二聚体主要分布于内质网中。研究发现内质网分泌蛋白,如VIP36和ERGIC-53,能以同源二聚体的形式转运其他蛋白,RAMP1与这些分泌蛋白有着相同的膜拓扑结构[13-14],提示同源二聚体RAMP1可能与转运CRLR到细胞膜有关。总之,弄清RAMP1调节CGRP受体活化机制对发现心血管药物的作用靶点有重要意义。
[1]Li Y,Fiscus RR,Wu J,Yang L,Wang X.The antiproliferative effects of calcitonin gene-related peptide in different passages of cultured vascular smooth muscle cells[J].Neuropeptides,1997,31(5):503-509.
[2]Qin XP,Ye F,Hu CP,Liao DF,Deng HW,Li YJ.Effect of calcitonin gene-related peptide on angiotensinⅡ-induced proliferation of rat vascular smooth muscle cells[J].Eur J Pharmacol,2004,488(1-3):45-49.
[3]Hilairet S,Bélanger C,Bertrand J,Laperrière A,Foord SM,Bouvier M.Agonist-promoted internalization of a ternary complex between calcitonin receptor-like receptor,receptor activity-modifying protein 1(RAMP1),and beta-arrestin[J].J Biol Chem,2001,276(45):42182-42190.
[4]Sexton PM,Albiston A,Morfis M,Tilakaratne N.Receptor activity modifying proteins[J].Cell Signal,2001,13(2):73-83.
[5]Zhang Z,Dickerson IM,Russo AF.Calcitonin gene-related peptide receptor activation by receptor activity-modifying protein-1 gene transfer to vascular smooth muscle cells[J].Endocrinology,2006,147(4):1932-1940.
[6]Sabharwal R,Zhang Z,Lu Y,Abboud FM,Russo AF,Chapleau MW.Receptor activity-modifying protein 1 increases baroreflex sensitivity and attenuates angiotensininduced hypertension[J].Hypertension,2010,55(3):627-635.
[7]Li J, Wang DH. Development of angiotensinⅡ-induced hypertension:role of CGRP and its receptor[J].J Hypertens,2005,23(1):113-118.
[8]Zheng YB,Qin XP,Sun F,Tang JQ,Liao DF.Construction of receptor activity modifying protein gene vector and effect on proliferation of rat VSMC[J].J Univ South China(Med Ed)〔南华大学学报(医学版)〕,2010,38(1):1-5.
[9]Cueille C,Birot O,Bigard X,Hagner S,Garel JM.Posttranscriptional regulation of CRLR expression during hypoxia[J].Biochem Biophys Res Commun,2005,326(1):23-29.
[10]Nikitenko LL,Smith DM,Bicknell R,Rees MC.Transcriptional regulation of the CRLR gene in human microvascular endothelial cells by hypoxia[J].FASEB J,2003,17(11):1499-1501.
[11]Fukai N,Shichiri M,Ozawa N,Matsushita M,Hirata Y.Coexpression of calcitonin receptor-like receptor and receptor activity-modifying protein 2 or 3 mediates the antimigratory effect of adrenomedullin[J].Endocrinology,2003,144(2):447-453.
[12]Héroux M,Hogue M,Lemieux S,Bouvier M.Functional calcitonin gene-related peptide receptors are formed by the asymmetric assembly of a calcitonin receptor-like receptor homo-oligomer and a monomer of receptor activity-modifying protein-1[J].J Biol Chem,2007,282(43):31610-31620.
[13]Appenzeller C,Andersson H,Kappeler F,Hauri HP.The lectin ERGIC-53 is a cargo transport receptor for glycoproteins[J].Nat Cell Biol,1999,1(6):330-334.
[14]Fiedler K, Parton RG, Kellner R, Etzold T,Simons K.VIP36,a novel component of glycolipid rafts and exocytic carrier vesicles in epithelial cells[J].EMBO J,1994,13(7):1729-1740.Abstract:OBJECTIVE To investigate the effect of overexpression of receptor activity modifying protein 1(RAMP1)on distribution of the calcitonin receptor like receptor(CRLR)in vascular smooth muscle cell(VSMC)in order to reveal the antiproliferative mechanism of calcitonin gene-related peptide(CGRP)for VSMC.METHODS pCDNA3.1(+)-RAMP1 eukaryon expression vector was successfully constructed by digestion,ligation,transform and transfected to the mouse VSMC cell line A10.After that the normal cells,pCDNA3.1(+)cells and pCDNA3.1(+)-RAMP1 cells were treated by AngⅡ,CGRP and CGRP+AngⅡ for 24 h.The proliferation of cell line A10 was determined by MTT assay while mRNA and proteins levels of CRLR and RAMP1 were determined by RT-PCR and Western blotting,respectively.The distribution of RAMP1 and CRLR in cell line A10 was observed by immunofluorescence.RESULTS Proliferation was not significant in three kinds of cells treated by 0.1%FBS or AngⅡ.Proliferation in RAMP1 overexpression cell higher than in normal cells and the pCDNA3.1(+)cells treated by CGRP groups(P<0.05),but lower than treated by CGRP+AngⅡ(P<0.05).Cells treated with CGRP and AngⅡdecreased the CRLR proteins expression in RAMP1 overexpression group(P<0.05)while the difference of mRNA levels of CRLR in each group had no significance.However,after treated with 0.1%FBS or CGRP,the RAMP1 and CRLR proteins were distributed into cytoplasm in normal cells and pCDNA3.1(+)cells,but the membrane distribution of RAMP1 and CRLR in pCDNA3.1(+)-RAMP1 cells were higher than that of normal and pCDNA3.1(+)cells treated by AngⅡ or CGRP+AngⅡ.CONCLUSION Overexpression of RAMP1 significantly enhances the inhibitory effect of CGRP on proliferation of VSMC induced by AngⅡ.The mechanism may be related to the increased distribution of CRLR in the membrane induced by RAMP1.
