橄榄叶提取物对实验性兔关节软骨损伤的修复作用
2013-11-12宫德正耿成燕姜丽平王丽辉吉村宽辛仲来福
宫德正,耿成燕,姜丽平,王丽辉,吉村宽辛,仲来福
(大连医科大学1.机能学实验室,2.中日合作医药科学研究所,3.病理学教研室,辽宁大连 116044,4.Eisai Food & Chemical Co.,Ltd.,Nihonbashi,Chuo-ku,Tokyo103-0027,Japan)
齐敦果(Olea earopaea)属木科(oleaceae),常绿阔叶乔木,又名洋橄榄或油橄榄。欧洲原产,我国引种,多栽培于长江以南。橄榄叶提取物(olive leaves extract,OLE)是从橄榄叶中提取的天然酚类物质,具有非常强的抗氧化[1]和抗动脉粥样硬化[2]作用,并可预防癌症[3]。据报道,橄榄叶具有降血压和抗微生物等作用[4]。有文献报道,榨橄榄时所产生的橄榄汁能明显降低脂多糖处理BALB/c小鼠血清肿瘤坏死因子α(tumor necrosis factorα,TNF-α)水平,也能明显降低脂多糖处理人单核细胞THP-1细胞TNF-α的分泌,认为橄榄汁可能是一种治疗炎症的有效成分,如风湿性关节炎和骨关节炎[5]。OLE是否对关节软骨损伤有修复作用目前国内外尚无文献报道。本研究通过对兔左后膝关节软骨手工钻洞制备兔关节软骨损伤模型,观察OLE对关节软骨损伤的修复作用。
1 材料与方法
1.1 药物和主要试剂
OLE由日本Eisai食品与化学有限公司提供,实验时用水溶解。其主要组成包括22%羟基酪醇,4%多酚,67%糖类,2%脂质,4%强热残留物和1%水。番红O和阿尔辛蓝购自Sigma公司。
1.2 实验动物和分组
12只健康新西兰白兔,16周龄,体质量2.00~2.55 kg,由大连医科大学实验动物中心提供,动物许可证号:SCXK(辽)2002-0002。用前检疫1周,单笼饲养,随机分为模型对照组和OLE治疗组,每组6只,雌雄各半。将OLE用蒸馏水溶解,OLE治疗组按照成年兔每天120 ml·kg-1饮水量自由饮水足量给予 OLE 500 mg·kg-1,连续 21 d;模型对照组给予等体积蒸馏水。动物室温度保持在23~25℃,相对湿度50%~60%,每天 12 h光照。
1.3 动物模型制备
静脉给予戊巴比妥钠40 mg·kg-1给兔实施麻醉,在兔左后膝关节处剪毛,用0.05%氯己定和75%乙醇消毒。在靠近膝关节内侧面,从股骨向胫骨结节方向做一个垂直的皮肤切口。切开关节囊,通过人工脱臼的方法,把髌骨推向前侧面,充分暴露膝关节的软骨。用手钻在关节软骨上打直径3 mm、深4 mm的3个洞。1个在滑车嵴中间,另2个在股骨末梢的滑车槽上。然后用生理盐水冲洗伤口和关节囊。关节囊用人工可吸收(3-0)缝合线缝合,同时皮下组织和皮肤用尼龙线(3-0)缝合。手术后1周内用聚维酮碘(聚乙烯吡咯烷酮碘)对伤口消毒,每天1次;用盐酸土霉素10 mg·kg-1肌内注射抗感染,每天2次。
1.4 兔软骨损伤部位的肉眼观察
实验期间,每天观察兔腹泻和饮食情况及皮毛颜色,每周测体质量1次。手术后3周,iv给予戊巴比妥钠80 mg·kg-1,实施安乐死。打开膝关节后,用单盲法肉眼观察3个损伤部位(洞)软骨的愈合情况。手术洞愈合的程度进行如下评分:愈合<50%,计为0分,50%~60%计为1分,60%~80%愈合计为2分,80%~100%愈合计为3分,然后计算总评分[6]。同时观察关节囊里滑液量和混浊度。当关节滑液有以细胞为内容物增加时进行涂片染色和琼脂培养。
1.5 兔关节软骨组织病理学检查
兔安乐死后,取手术侧膝关节用10%甲醛固定,固定后切片,厚5 mm,用5%醋酸振摇1 d脱钙,脱钙后用中性5%硫化钠浸泡1 d,然后进行石蜡包埋,切片,厚5 μm。HE染色进行组织学检查。用单盲法光镜下观察3个损伤部位(洞)软骨的再生情况。手术洞软骨再生的程度进行如下评分:无软骨缺失(损伤部位全部由再生软骨填充)计为0分;局限性缺失计为1~2分;较大范围软骨缺失计为3分;全面的软骨缺失计为4分,然后计算总评分[7]。
1.6 兔关节软骨蛋白聚糖(proteoglycan,PG)和糖胺聚糖(glycosaminoglycan,GAG)合成的测定
同1.5方法取手术侧膝关节,制备石蜡切片,用番红O和阿尔辛蓝染色。番红O染色所形成的红色代表PG,阿尔辛蓝染色所形成的蓝色代表GAG[8]。把用番红O和阿尔辛蓝染色关节软骨损伤部位和正常无损伤部位的图片通过彩色数码相机输入电脑并通过Image-pro plus 4.5(Media Cybernetics)把影像数字化。随机选取6个区域,通过影像处理技术计算每个区域番红O染色形成的红色平均光密度和阿尔辛蓝染色形成的蓝色平均光密度,分别代表关节软骨 PG和GAG的合成量[8]。
1.7 兔股二头肌和股内侧大收肌肌肉质量比率的测定
兔安乐死后,分别取出手术侧和无手术侧股二头肌和股内侧的大收肌,称重。肌肉质量的比率(%)=手术侧肌肉质量/无手术侧肌肉质量 ×100%。
1.8 统计学分析
2 结果
2.1 橄榄叶提取物对兔身体状况的影响
两组兔在实验期间体质量无差异(表1),饮食正常,皮毛光亮,无腹泻。两组兔手术侧膝关节关节囊内滑液清亮,滑液量无差异。表明OLE无毒性作用,兔无感染。
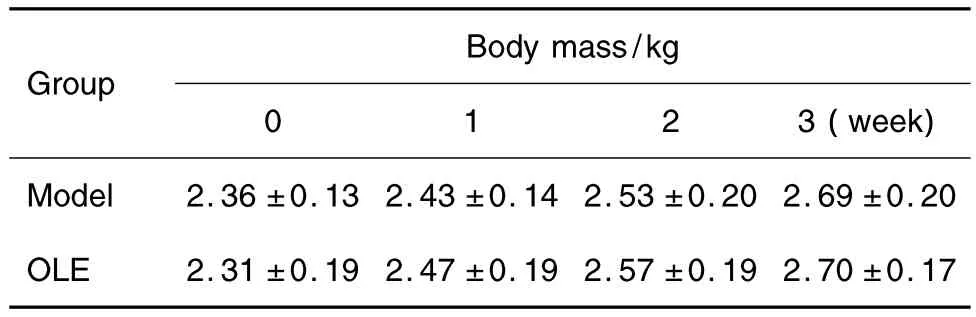
Tab.1 Effect of olive leaves extract(OLE)on body mass of rabbits with experimental cartilage injuries
2.2 橄榄叶提取物对兔软骨损伤愈合的影响
人工制备兔左膝关节软骨损伤,肉眼观察结果表明,手术3周后,OLE治疗组3个洞的愈合评分和总评分均明显高于模型对照组(P<0.05)(表2),表明OLE能促进损伤关节软骨的愈合。
2.3 橄榄叶提取物对兔软骨损伤后软骨再生的影响
组织病理学检查结果表明,模型对照组软骨损伤部位缺乏新生软骨,并有毛细血管增生和纤维原细胞增殖,在大部分部位无新生的软骨组织(图1A)。OLE治疗组损伤部位成熟软骨组织和连接组织混合再生,或大量成熟的软骨组织在损伤部位再生,再生的软骨组织周围被增殖的纤维软骨细胞所环绕(图1B)。在3个损伤部位(洞)均随机选取6个区域并对软骨损伤后软骨再生情况进行组织学评分,模型对照组为 17.3±3.0,OLE 治疗组为8.7±0.6,OLE治疗组明显低于模型对照组(P<0.05),表明OLE具有促进软骨损伤后软骨组织再生的作用。

Tab.2 Effect of OLE on healing degree of holes at operated sites of rabbits with experimental cartilage injuries

Fig.1 Effect of OLE on cartilage regeneration of rabbits with experimental cartilage injuries(HE ×200).See Tab.1 for rabbit treatment.A:model control;B:OLE 50 mg·kg -1.Arrows show regenerated cartilage tissue.
2.4 橄榄叶提取物对兔软骨损伤后软骨基质PG和GAG合成的影响
由图2A,B和表3可见,OLE治疗组软骨损伤部位(黑色箭头所指)番红O染色的平均光密度比模型对照组高(P<0.05);正常软骨无损伤部位(绿色箭头所指)番红O染色的平均光密度与模型对照组比较无明显变化。表明OLE能促进软骨损伤修复部位软骨基质中PG的合成。
由图2C,D和表3可见,OLE治疗组软骨损伤部位(黄色箭头所指)和正常软骨无损伤部位(粉色箭头所指)阿尔辛蓝染色的平均光密度与模型对照组比较无显著性差异。

Fig.2 Effect of OLE on cartilage matrix formation of rabbits with experimental cartilage injuries(×200).See Tab.1 for rabbit treatment.Green arrow:safranin O staining of normal cartilage area for PG;black arrow:safranin O staining of restored area for PG;yellow arrow:alcian blue staining of restored area for GAG;pink arrow:alcian blue staining of normal cartilage area for GAG.A and C:model group;B and D:OLE 50 mg·kg -1.A and B:safranin O staining;C and D:Alcian blue staining.
2.5 橄榄叶提取物对软骨损伤后兔肌肉质量比率的影响
由表4可见,OLE治疗组股内侧大收肌质量比率与模型对照组比较无明显变化;股二头肌质量比率较模型对照组升高(P<0.05),提示OLE具有抗炎镇痛作用,可维持膝关节运动功能,防止肌肉废用性萎缩。

Tab.3 Effect of OLE on proteoglycan(PG)and glycosaminoglycan(GAG)synthesis in cartilage matrix formation of rabbits with experimental cartilage injuries

Tab.4 Effect of OLE on mass of lateral great and biceps femoris muscle of rabbits with experimental cartilage injuries
3 讨论
本研究结果表明,通过自由饮水给予兔OLE 500 mg·kg-1,连续21 d,能明显促进实验性关节软骨损伤的修复。实验期间饮食情况正常,皮毛光亮,无腹泻,两组兔体质量无差异。表明该剂量对兔无毒副作用,该结果与文献报道一致[9]。
肉眼观察结果表明,OLE治疗组软骨损伤部位的愈合比模型对照组更为显著。组织学检查结果表明,OLE治疗组在软骨损伤部位不仅有大量再生的成熟软骨组织,而且再生的软骨组织周围环绕大量增殖的未分化的软骨胚胎细胞。模型对照组在软骨损伤部位几乎看不见再生的软骨,仅有大量再生的纤维组织。表明OLE具有促进软骨损伤修复的作用。
正常关节软骨由软骨基质和镶嵌在软骨基质陷窝内的软骨细胞组成,软骨细胞只占1%,软骨基质占99%。软骨的基质由胶原纤维、PG和水构成,其中胶原纤维占20%~25%,PG占5%~10%,水占70%~75%。PG主要由GAG和蛋白组成,PG镶嵌于胶原纤维网状结构中,形成了水合性极强的黏稠胶体,使软骨坚硬而富有弹性[10]。随着年龄的增长或者软骨遭到破坏时,软骨细胞不能有效合成PG,最终导致关节损伤和骨性关节炎[11]。为了探讨OLE对关节软骨损伤修复的可能机制,本研究应用番红O染色在软骨组织切片上对PG进行半定量分析,以反映软骨基质的变化,发现OLE治疗组关节软骨损伤修复部位软骨基质中PG与模型对照组比较明显增加,正常无软骨损伤部位软骨基质中PG与模型对照组比较无明显变化。表明OLE能明显促进软骨损伤修复部位软骨基质中PG的合成。用阿尔辛蓝染色结果表明,OLE治疗组软骨损伤修复部位GAG合成与模型对照组比较无明显变化,可能与GAG参与PG的合成有关。
本研究集体已研究报道,OLE具有抗炎和镇痛作用,其作用机制可能与抑制TNF-α和白细胞介素1 mRNA的表达有关[12]。本研究结果表明,OLE可预防肌肉萎缩,考虑与其抗炎镇痛作用和增加PG合成有关。股内侧大收肌和股二头肌与肢体运动相关。大收肌司职膝关节的伸展运动,膝关节伸展为了减轻疼痛。股二头肌司职膝关节弯曲运动。当膝关节弯曲时,髌骨强烈压在关节滑车上,可引起剧烈疼痛导致股二头肌废用性萎缩,关节软骨损伤恢复被延迟。OLE可能具有抗炎镇痛作用,避免因膝关节弯曲引起剧痛导致股二头肌废用性萎缩,间接促进软骨损伤的修复。
综上所述,OLE能够促进人工关节软骨损伤的修复并增加关节软骨基质中PG的合成。OLE对关节软骨损伤和骨性关节炎等疾病可能具有预防和治疗作用。
[1]Paiva-Martins F,Gordon MH.Isolation and characterization of the antioxidant component 3,4-dihydroxyphenylethyl 4-formyl-3-formylmethyl-4-hexenoate from olive (Olea europaea)leaves[J].J Agric Food Chem,2001,49(9):4214-4219.
[2]González-Santiago M,Martín-Bautista E,Carrero JJ,Fonollá J,Baró L,Bartolomé MV,et al.One-month administration of hydroxytyrosol,a phenolic antioxidant present in olive oil,to hyperlipemic rabbits improves blood lipid profile,antioxidant status and reduces atherosclerosis development[J].Atherosclerosis,2006,188(1):35-42.
[3]d'Ischia M, Panzella L, Manini P, Napolitano A.The chemical basis of the antinitrosating action of polyphenolic cancer chemopreventive agents[J].Curr Med Chem,2006,13(26):3133-3144.
[4]Savournin C,Baghdikian B,Elias R,Dargouth-Kesraoui F,Boukef K,Balansard G.Rapid high-performance liquid chromatography analysis for the quantitative determination of oleuropein in Olea europaea leaves[J].J Agric Food Chem,2001,49(2):618-621.
[5]Bitler CM,Viale TM,Damaj B,Crea R.Hydrolyzed olive vegetation water in mice has anti-inflammatory activity[J].J Nutr,2005,135(6):1475-1479.
[6]Tamai Y,Miyatake K,Okamoto Y,Takamori Y,Sakamoto K,Minami S.Enhanced healing of cartilaginous injuries by N-acetyl-d-glucosamine and glucuronic acid[J].Carbohydrate Polymers,2003,54(2):251-262.
[7]Sellers RS, Zhang R, Glasson SS,Kim HD,Peluso D,D'Augusta DA,et al.Repair of articular cartilage defects one year after treatment with recombinant human bone morphogenetic protein-2(rhBMP-2)[J].J Bone Joint Surg Am,2000,82(2):151-160.
[8]Gao GX,Wei XC,Li K,Wei JP.Different staining methods for rat knee articular cartilage[J].J Clin Rehabil Tissue Eng Res(中国组织工程研究与临床康复),2010,14(24):4385-4389.
[9]Christian MS,Sharper VA,Hoberman AM,Seng JE,Fu L,Covell D,et al.The toxicity profile of hydrolyzed aqueous olive pulp extract[J].Drug Chem Toxicol,2004,27(4):309-330.
[10]Muir H.Adult Articular Cartilage[M].New York:Grune&Stratton,1973:100-131.
[11]Thonar EM,Bjornsson S,Kuettner KE.Age-related changes in cartilage proteoglycans[M]∥Kuettner KE,Schleyerbach R,Hascall VC.Articular Cartilage Biochemistry.New York:Raven,1986:273-287.
[12]Geng CY,Gong DZ,Jiang LP,Cao J,Yoshimura H,Zhong LF.Effects of OLE on carrageenan-induced acute inflammation and hyperalgesia in rats[J].Nat Prod Res Dev(天然产物研究与开发),2011,23(5):931-934.
