豹皮樟总黄酮体外对酒精性脂肪肝大鼠肝细胞脂肪变性的影响
2013-11-12胡成穆解雪峰刘洪峰
胡成穆,曹 琦,解雪峰,刘洪峰,丁 琦,李 俊
(安徽医科大学药学院安徽天然药物活性研究省级实验室,安徽合肥 230032)
酒精性脂肪肝(alcoholic fatty liver,AFL)是因长期、大量饮用乙醇类饮料所致的肝细胞内脂质蓄积超过肝湿重5%的肝损害性疾病。乙醇本身具有热量,长期大量摄入,不仅损害脂肪氧化,还可刺激脂肪形成,引起脂质代谢紊乱。肝由多种细胞组成,肝细胞在AFL的形成中起着至关重要的作用,营养过剩或某种物质缺乏均可导致肝细胞损害[1],而脂质在肝细胞内蓄积是所有肝疾病发病的先决条件[2]。
豹皮樟(Litsea coreana Leve),又名老鹰茶,系樟科木姜子属毛豺皮樟的嫩梢和叶片,是我国南方各民族民间长期饮用的一种植物代用茶,具有清凉止渴和解毒消肿等功效。豹皮樟中含有多种活性成分,经本院天然药物化学教研室提取分离鉴定,确定了豹皮樟的有效部位为总黄酮,分别鉴定为槲皮素-3-O-β-D-半乳糖苷、山柰酚-3-O-β-D-葡萄糖苷、槲皮素-3-O-β-D-葡萄糖苷和山柰酚-3-O-β-D-半乳糖苷[3],含量超过51.5%。前期研究表明,豹皮樟总黄酮 (total flavonoids of L.coreana Leve,TFLC)对AFL具有一定的保护作用[4],为进一步探讨TFLC的作用机制,本研究以AFL大鼠肝灌流,分离培养肝细胞,观察TFLC对肝细胞脂质生成及脂肪分化相关蛋白(adipose differentiation-related protein,ADRP)和过氧化物酶体增殖物激活受体γ(peroxisome proliferators activated receptor γ,PPARγ)表达的影响。
1 材料与方法
1.1 动物、药品、试剂和仪器
Sprague-Dawley(SD)大鼠,雄性,体质量160~200 g,安徽医科大学实验动物中心提供(普通级),标准颗粒饲料喂养,合格证号:皖医实动准字第01号。TFLC由安徽医科大学药学院提取,使用时均研细后用无血清DMEM溶解后过滤灭菌;谷胱甘肽(glutathione,GSH),上海源聚生物科技有限公司;DMEM培养基干粉,美国Gibco公司;Ⅳ型胶原酶和Trizol,美国Invitrogen公司;新生牛血清,杭州四季青公司;兔抗鼠ADRP多抗和鼠抗PPARγ单抗,美国Santa Cruz公司;HRP标记的羊抗小鼠IgG和山羊抗兔IgG抗体,北京中杉金桥公司;丙氨酸转氨酶(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate aminotransferase,AST)活性测定试剂盒,南京建成公司;甘油三酯(triglycerides,TG)含量测定试剂盒,北京福瑞生物工程公司;细胞角蛋白18(cytokeratin 18,CK18)抗体,北京博奥森公司;PCR逆转录试剂盒,美国 Promega公司。CO2恒温培养箱,美国Shellab公司;多功能显微镜,日本Olympus公司;PCR仪9700,美国ABI公司。
1.2 AFL大鼠模型的制备、肝灌流和肝细胞分离
大鼠正常饲养1周后,自由饮用乙醇饮料(含18%蔗糖),其乙醇浓度从5%开始,每个浓度维持1周,依次增加为 10%,15%,20%,25%,30%,35%至40%,40%持续至第12周;正常对照组摄正常饮食12周。造模12周体质量为250~300 g的AFL大鼠6只,同期正常大鼠2只。按照Seglen的原位两步灌流法[5]并稍加改动分离肝细胞:大鼠禁食16 h,ip 10%水合氯醛麻醉,消毒,剖开腹腔,分离肝门静脉,插麻醉导管并结扎,分离下腔静脉插入另一根麻醉导管,灌注预温37℃不含Ca2+和Mg2+的Hank液,灌注至下腔静脉流出的液体变清时,开始灌注37℃预温消化酶(0.05%Ⅳ型胶原酶),在位灌流待肝变软呈土黄色,表面呈现龟裂状,压之凹陷不易恢复,停止灌注。分离肝,移至超净台内用无菌镊撕开肝表面的包膜,抖落肝细胞,预冷的D-Hanks培养液制成肝细胞悬液,100目尼龙网筛滤去细胞团块及组织纤维,滤液4℃,34×g离心5 min,3次,完全DMEM(含10%血清)调整细胞浓度,制成5×108L-1的肝细胞悬液。
1.3 大鼠肝细胞的鉴定
CK18是成熟肝细胞的标志,可用于鉴定肝细胞。取灌流获取的肝细胞1×106L-1加入0.4%锥虫蓝(终浓度0.04%),镜下观察,死细胞被染成明显的蓝色,活细胞拒染呈无色透明状。细胞爬片,肝细胞培养48 h,4%多聚甲醛固定,3%H2O2灭活内源性过氧化物酶,0.1%Triton X-100冰上破膜,血清封闭,一抗(兔抗大鼠CK18多克隆抗体1∶400)4℃过夜,二抗(HRP标记山羊抗兔 IgG抗体1∶800)37℃湿盒1 h(避光),DAB显色,苏木素复染,脱水,封片。
1.4 MTT法测定肝细胞存活
调整肝细胞密度为5×108L-1,接种至96孔板培养16 h后,正常大鼠肝细胞分为正常对照组、正常 +TFLC 1,10 和 100 mg·L-1组;AFL 大鼠肝细胞分为 AFL模型对照组、AFL+TFLC 1,10和100 mg·L-1及 AFL+GSH 10 mmol·L-1对照组,各设3个复孔,培养42 h,于每孔加入MTT溶液(5 g·L-1)20 μl,37℃继续培养 4 h 后终止培养,吸弃上清,加 DMSO 150 μl,振荡10 min,使甲臜颗粒充分溶解。空白DMSO孔调零,酶联免疫检测仪570 nm波长处测定每孔吸光度(A)值,求其平均值。
1.5 肝细胞ALT和AST活性测定
AFL细胞分为AFL模型组、AFL+TFLC 1,10和100 mg·L-1及 AFL+GSH 10 mmol·L-1组,正常大鼠肝细胞为正常对照组,于6孔培养板培养48 h,收集细胞培养液,参照试剂盒方法测定ALT和AST活性。
1.6 肝细胞内TG含量测定
细胞分组同1.5。药物作用48 h的细胞,弃上清,PBS细胞洗3遍,加入胰酶消化,收集细胞悬液,反复冻融裂解细胞,超声细胞粉碎机裂解细胞2 min,离心取上清,按试剂盒说明书方法检测上清中TG含量。
1.7 逆转录PCR法测定肝细胞ADRP和PPARγ mRNA表达
细胞分组同1.5。肝细胞与药物作用48 h,Trizol一步法提取肝总RNA。按试剂盒说明书逆转录,ADRP引物序列,正义:5'-CTTGTGTCCTCCGCTTATGTCAGT-3';反 义:5'-CTGCTCCTTTGGTCTTATCCACCA-3',349 bp。PPARγ 引物序列,正义:5'-ATTCTGGCCCACCAACTTCGG-3';反义:5'-TGGAAGCCTGATGCTTTATCCCCA-3',339 bp。β 肌动蛋白引物序列,正义:5'-CAGTAACAGTCCGCCTAGAA-3';反义:5'-GATTACTGCTCTGGCTCCTA-3',175 bp。引物由上海生物工程技术公司合成。ADRP和PPARγ反应条件分别为:57℃复性,37个循环和56℃复性,35个循环。琼脂糖凝胶上电泳,紫外灯下观察并扫描。凝胶成像系统对拍摄的照片进行密度扫描,以目的基因条带积分吸光度值对β肌动蛋白积分吸光度值的比值表示目的基因mRNA相对表达水平。
1.8 免疫组化方法测定肝细胞ADRP和PPARγ蛋白表达
细胞分组同1.5。肝细胞与药物作用48 h,4%多聚甲醛固定,3%H2O2灭活内源性过氧化物酶,PBS洗3次,(PPARγ需0.1%Triton X-100冰上破膜),PBS洗3次,血清封闭,一抗(兔抗鼠ADRP多抗1∶300,鼠抗 PPARγ 单抗1∶500)4℃过夜,PBS洗3次,二抗(HRP标记山羊抗兔IgG和羊抗小鼠IgG抗体1∶800)37℃湿盒1 h(避光),DAB显色,苏木素复染,脱水,封片。随机选取5个视野,以胞膜和(或)胞质出现明显的棕黄色和(或)黄棕色颗粒的细胞为阳性细胞,计数阳性细胞百分数。
1.9 统计学分析
2 结果
2.1 大鼠肝细胞的鉴定
常规锥虫蓝拒染法鉴定细胞活率在80%以上。光镜下,正常肝细胞为圆形(图1A),细胞核位于细胞正中,可见到双核的肝细胞。免疫细胞化学染色显示,CK18阳性着色部位在胞核和胞浆,呈棕黄色颗粒(图1B)。
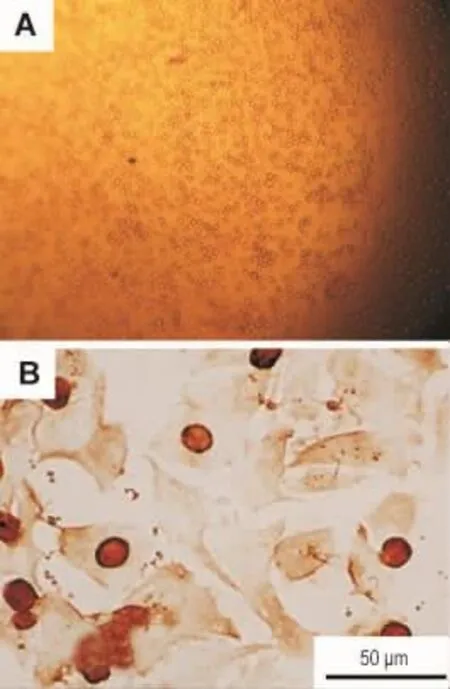
Fig.1 Identification of primary cultured rat hepatocytes.A:hepatocytes cultured for 4 h(×100),Trypan blue staining;B:hepatocytes immunochemistry stained with cytokeratin 18(CK18)antibody.
2.2 TFLC对正常和AFL大鼠肝细胞存活的影响
表1结果显示,TFLC作用48 h对正常大鼠肝细胞存活无明显影响。与正常大鼠肝细胞比较,AFL模型大鼠肝细胞存活减少(P<0.05);与AFL模型大鼠肝细胞比较,TFLC 100 mg·L-1作用48 h能显著增加AFL大鼠肝细胞存活(P<0.05),与GSH 10 mmol·L-1作用相当。
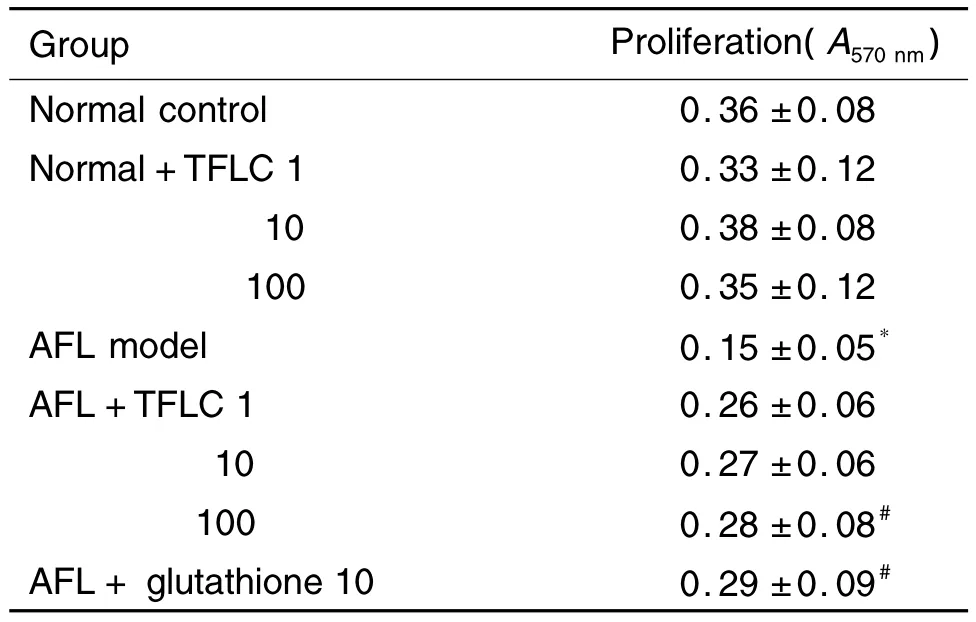
Tab.1 Effect of total flavone of L.coreana(TFLC)on proliferation of hepatocytes in normal and alcoholic fatty liver(AFL)model rats
2.3 TFLC对AFL大鼠肝细胞培养液中ALT和AST活性的影响
如表2结果显示,与正常大鼠肝细胞相比,细胞培养48 h的AFL模型大鼠肝细胞培养液中ALT和AST活性均明显升高(P<0.05);TFLC 10 和100 mg·L-1作用48 h可降低AFL大鼠肝细胞培养液中ALT和AST活性(P<0.05),与GSH 10 mmol·L-1作用相当。
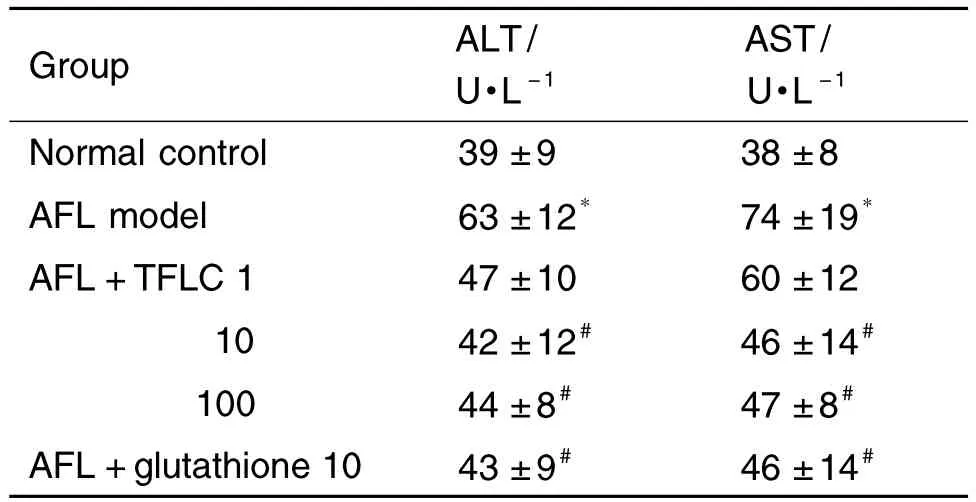
Tab.2 Effect of TFLC on activities of alanine aminotransferase(ALT)and aspartate aminotransferase(AST)in hepatocytes of AFL model rats
2.4 TFLC对AFL大鼠肝细胞内TG含量的影响
由表3看出,与正常大鼠肝细胞比较,培养48 h的AFL模型大鼠肝细胞内TG含量明显增加(P<0.05);TFLC 10 和100 mg·L-1作用48 h 可减少AFL大鼠肝细胞内TG含量(P<0.05),与GSH 10 mmol·L-1作用相当。

Tab.3 Effect of TFLC on content of triglycerides(TG)in hepatocytes of AFL model rats
2.5 TFLC对AFL大鼠肝细胞ADRP mRNA和蛋白表达的影响
与正常肝细胞相比,AFL大鼠肝细胞ADRP mRNA表达明显增多(数据略)。如图2所示,与AFL模型大鼠肝细胞相比,TFLC 10 mg·L-1作用48 h能明显降低 ADRP mRNA表达(P<0.05),与GSH 10 mmol·L-1作用相当。
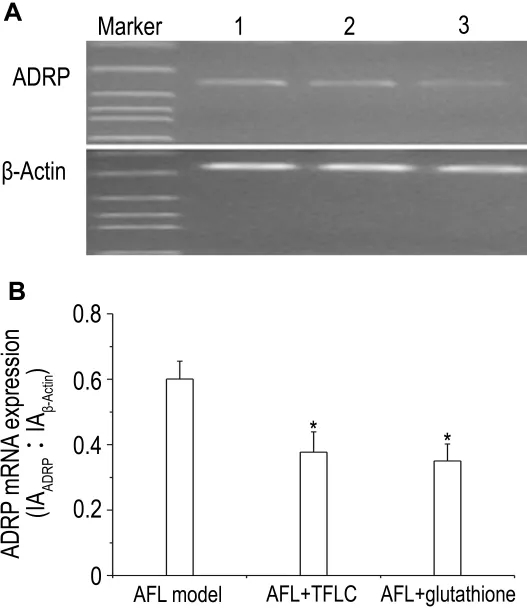
Fig.2 Effect of TFLC on adipose differentiation-related protein(ADRP)mRNA expression in hepatocytes of AFL model rats.See Tab.1 for cell treatment.A:representative RT-PCR for ADRP expression.B:RT-PCR quantitative analysis result of A.IA:integrated absorbance.Lane 1:AFL model;lane 2:AFL+TFLC 10 mg·L -1;lane 3:AFL+glutathione 10 mmol·L -1.±s,n=3.*P<0.05,compared with AFL model group.
由图3和图4看出,正常大鼠的肝细胞有少量ADRP阳性表达(图3A),AFL模型组ADRP阳性表达肝细胞明显增多(P<0.01)(图3B),AFL+TFLC 100 mg·L-1组(图 3E)和 AFL+ 谷胱甘肽10 mmol·L-1组(图3F)ADRP阳性表达细胞明显减少(P<0.01)。
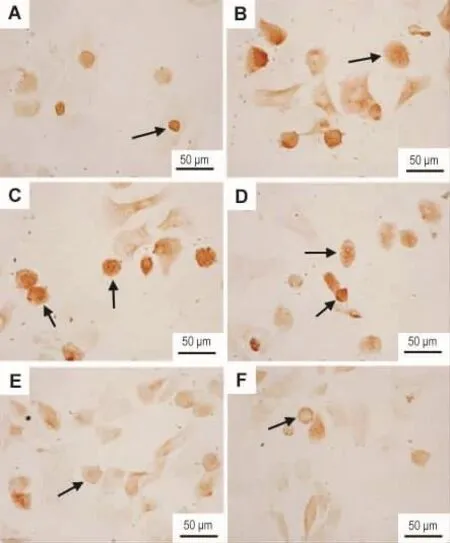
Fig.3 Effect of TFLC on ADRP expression in hepatocytes of AFL model rats(SP).See Tab.1 for cell treatment.A:normal;B:AFL model;C - E:AFL+TFLC 1,10 and 100 mg·L -1;F:AFL+glutathione 10 mmol·L -1.Arrows show ADRP positive cells.
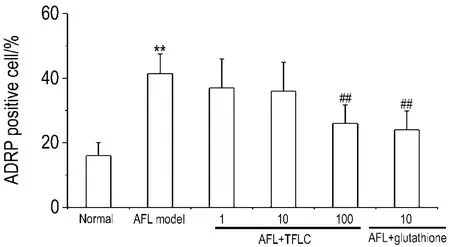
Fig.4 Effect of TFLC on ADRP protein expression in hepatocytes of AFL model rats .See Tab.1 for cell treatment.±s,n=3.**P<0.01,compared with normal group;##P<0.01,compared with AFL model group.
2.6 TFLC对AFL大鼠肝细胞PPARγ mRNA和蛋白表达的影响
如图5所示,与正常肝细胞相比,AFL大鼠肝细胞PPARγ mRNA表达明显增多(数据略)。与AFL模型大鼠肝细胞相比,TFLC作用48 h能明显降低AFL大鼠肝细胞PPARγ mRNA表达(P<0.01)。
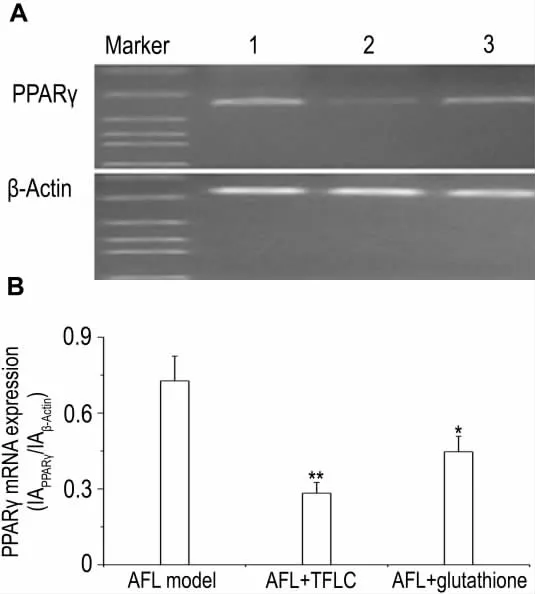
Fig.5 Effect of TFLC on peroxisome proliferator-activated receptorγ(PPARγ)mRNA expression in hepatocytes of AFL model rats.See Tab.1 for cell treatment.The intensity of PPARγ mRNA bands was normalized to that of β-actin.B was the semiquantitative result of A.Lane 1:AFL model;lane 2:AFL+TFLC 10 mg·L -1;lane 3:AFL+glutathione 10 mmol·L -1.±s,n=3.*P<0.05,**P<0.01,compared with AFL model group.
如图6和图7所示,正常组肝细胞可见少数PPARγ阳性表达细胞,着色较淡(图6A);模型组可见较多阳性表达细胞,胞核着色较深(图6B)。与 AFL 模型组相比,AFL+TFLC 100 mg·L-1组(图 6E)和 AFL+ 谷胱甘肽 10 mmol·L-1组(图6F)PPARγ阳性表达肝细胞明显减少(P<0.05),
表达程度降低。
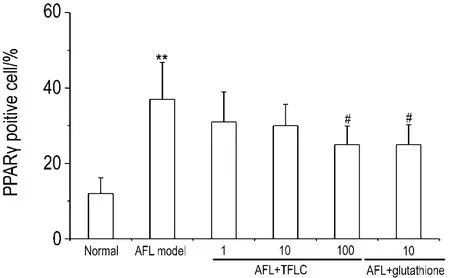
Fig.7 Effect of TFLC on PPARγ protein expression in hepatocytes of AFL model rats.See Tab.1 for cell treatment.±s,n=3.**P<0.01,compared with normal group;#P<0.05,compared with AFL model group.
3 讨论
AFL是酒精性肝病(alcoholic liver disease,ALD)的早期阶段,发展为肝纤维化和肝硬化的危险性比单纯性脂肪肝高。本研究以18%的蔗糖为溶媒,以浓度递增的方式加入乙醇,让大鼠逐渐适应,建立AFL大鼠模型。慢性乙醇摄入可导致实验动物血脂水平增加,肝脂肪沉积[6]。
肝细胞具有丰富的酶系及多种特异性功能,体外培养用于药理学研究具有许多优点,在一定时间内离体培养细胞具有体内肝功能[7]。胶原酶二步灌流法[8]是目前原代肝细胞分离的常用方法,本研究经适当改进后成功分离大鼠原代肝细胞。慢性乙醇摄入导致AFL大鼠肝细胞内脂肪沉积,TG有不同程度增加。肝细胞损伤,增殖反应下降,ALT和AST水平升高。
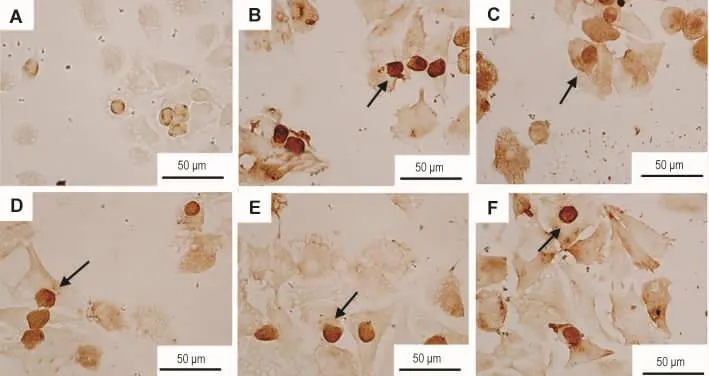
Fig.6 Effect of TFLC on PPARγ protein expression in hepatocytes of AFL model rats(SP).See Tab.1 for cell treatment.A:normal;B:AFL model;C-E:AFL+TFLC 1,10 and 100 mg·L-1;F:AFL+glutathione 10 mmol·L-1.↑:PPARγ positive cells.
ADRP,又名亲脂素(adipophilin),相对分子质量为48 ku,是脂肪细胞早期分化及脂质积聚的标志。ADRP具有调节脂质代谢的作用,可作为载体协助脂肪酸进入细胞,浓度和时间依赖性地促进长链脂肪酸的摄取。ADRP高表达可促进细胞胞浆内游离脂肪酸增多,增加肝TG的沉积,可使细胞内的脂滴数目增多,体积增大。抑制ADRP的表达能增加脂肪酸的β氧化。ADRP反义寡核苷酸可减少肝的TG和甘油二酯水平,增强胰岛素的作用[9]。免疫组化方法比油红O染色技术对实验者要求更少,同时ADRP免疫组化方法比HE染色或油红O染色更易发现微小脂滴,ADRP阳性表达可作为AFL形成的标志[10]。
PPARγ是主要表达于脂肪、肝和骨骼肌等组织的核转录因子,其目标基因直接参与脂肪细胞的分化成熟,并影响体内脂肪的合成及蓄积。PPARγ可刺激前脂肪细胞分化为脂肪细胞,诱导肝细胞脂肪酸重新合成引起脂质蓄积[11],增加肝细胞的脂肪合成,并参与葡萄糖稳态的调节[12]。ADRP作为PPARγ的目标基因,表达增高可促进PPARγ的表达和肝脂肪变性[13]。
本研究采用两步灌流法获取大鼠原代肝细胞,MTT方法检测肝细胞活性。TFLC对正常肝细胞增殖反应无明显影响,但能增强AFL模型大鼠肝细胞增殖反应,抑制AFL大鼠肝细胞ALT和AST活性,降低AFL大鼠肝细胞内TG的含量。本研究结果发现,AFL大鼠肝细胞ADRP和PPARγ阳性表达细胞数增多,程度加重,TFLC干预后肝细胞ADRP和PPARγ阳性表达的细胞数和表达量均明显减少。TFLC可减少肝细胞内TG的沉积,对AFL大鼠肝细胞脂肪变性有抑制作用,可能与其改善肝细胞活性、调控肝细胞ADRP和PPARγ的表达、降低肝细胞TG的积聚有关。
[1]Straub BK,Stoeffel P,Heid H,Zimbelmann R,Schirmacher P.Differential pattern of lipid droplet-associated proteins and de novo perilipin expression in hepatocyte steatogenesis[J].Hepatology,2008,47(6):1936-1946.
[2]Yang YM,Han CY,Kim YJ,Kim SG.AMPK-associated signaling to bridge the gap between fuel metabolism and hepatocyte viability[J].World J Gastroenterol,2010,16(30):3731-3742.
[3]Chen YP,Cheng WM,Li J.Analyse on the chemical constituents from flavonoids of Litsea coreana L.[J].Acta Univ Med Anhui(安徽医科大学学报),2008,43(1):45-47.
[4]Hu CM,Cao Q,Lv XW,Cheng WM,Li R,Li J.Protective effects of total flavonoids from Litsea coreana on alcoholic fatty liver in rats associated with down-regulation adipose differentiation-related protein expression[J].Am J Chin Med,2012,40(3):599-610.
[5]Mathijs K, Kienhuis AS, Brauers KJ, Jennen DG,Lahoz A,Kleinjans JC,et al.Assessing the metabolic competence of sandwich-cultured mouse primary hepatocytes[J].Drug Metab Dispos,2009,37(6):1305-1311.
[6]Huang CH, Chang YY, Liu CW, Kang WY,Lin YL,Chang HC,et al.Fruiting body of Niuchangchih(Antrodia camphorata)protects livers against chronic alcohol consumption damage[J].J Agric Food Chem,2010,58(6):3859-3866.
[7]Wang YG,Yang MH,Ma ZC,Liang QD,Tan HL,Xiao CR,et al.Effects of 18β-glycyrrhizic acid and 18α-glycyrrhizic acid on mRNA and protein expression of cytochrome P4503A in cultured rat primary hepatocyte[J].China J Chin Mater Med(中国中药杂志),2009,34(3):307-311.
[8]Yu CH,Leng XS,Wei YH,Liu JC,Du RY.The effect of collagenase and duration of liver perfusion on isolation of rat hepatocytes[J].Chin J Exp Surg(中华实验外科杂志),2000,17(6):541-542.
[9]Varela GM, Antwi DA, Dhir R, Yin X, Singhal NS,Graham MJ,et al.Inhibition of ADRP prevents diet-induced insulin resistance[J].Am J Physiol Gastrointest Liver Physiol,2008,295(3):G621-G628.
[10]Mak KM,Ren C,Ponomarenko A,Cao Q,Lieber CS.Adipose differentiation-related protein is a reliable lipid droplet marker in alcoholic fatty liver of rats[J].Alcohol Clin Exp Res,2008,32(4):683-689.
[11]Labruna G,Pasanisi F,Nardelli C,Caso R,Vitale DF,Contaldo F,et al.High leptin/adiponectin ratio and serum triglycerides are associated with an ″at-risk″phenotype in young severelyobesepatients[J].Obesity(Silver Spring),2011,19(7):1492-1496.
[12]Chen W,Wang LL,Liu HY,Kang JL,Li S.Peroxisome proliferator-activated receptor β agonist, GW501516,ameliorates insulin resistance in glucose intolerant mouse model[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2008,22(2):88-94.
[13]Yamazaki T,Shiraishi S,Kishimoto K,Miura S,Ezaki O.An increase in liver PPARγ2 is an initial event to induce fatty liver in response to a diet high in butter:PPARγ2 knockdown improves fatty liver induced by high-saturated fat[J].J Nutr Biochem,2011,22(6):543-553.
