重楼皂苷的制备及其抗A型流感病毒活性
2013-11-12蒲秀瑛张伟杰王恒瑞
蒲秀瑛,刘 宇,李 言,张伟杰,王恒瑞
(1.兰州理工大学生命科学与工程学院,甘肃兰州 730050;2.中国农业科学院兰州畜牧与兽药研究所,甘肃兰州 730050)
流感是由流感病毒引起的严重危害人类健康的急性呼吸道传染病。目前,防治流感的药物虽有离子通道M2阻滞剂和神经氨酸酶抑制剂,但存在耐药性和副作用等问题。由于流感病毒的抗原变异和跨种重组,疫苗也会失去预防作用。因此,抗流感病毒药物的研究已迫在眉睫。重楼(Paris polyphylla)是百合科重楼属植物的泛称,现代药理实验研究表明,重楼具有抗肿瘤、抗菌、消炎、镇痛、镇静、止咳和平喘等作用[1-4]。此外,虽然医学教材《中医学》中明确记载,重楼对亚洲A型流感病毒(influenza A virus,IAV)有较强的抑制作用,但目前国内外对重楼的研究仍主要集中于其抗肿瘤作用,未见其抗流感作用的研究报道。本研究结合现代提取和纯化工艺,从重楼中提取重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ,观察其在体内外抗IAV的作用,探讨重楼皂苷防治流感的作用,为重楼皂苷的临床试验提供理论依据。
1 材料与方法
1.1 动物、细胞和病毒株
昆明种小鼠,体质量18~22 g,雌雄各半,购自兰州大学动物实验中心,动物许可证号:SCXK(甘)2009-0004。MDCK细胞(狗肾传代细胞),由甘肃省疾病预防控制中心流感病毒实验室提供。细胞生长液为含10%胎牛血清的DMEM,维持液为含2%胎牛血清的 DMEM;病毒分离液为含胰蛋白酶40 mg·L-1的MEM,购自Gibco公司。IAV 鼠肺适应株(A/PR/8/1934),由中国疾病预防控制中心提供,经10日龄鸡胚尿囊腔接种培养传代,微量血凝实验滴定病毒效价。血凝效价1∶256的病毒株用于体外实验,Reed-Muench法测定其半数感染量(median infective dose,TCID50)为10-4.59/0.1 ml,体外实验时病毒攻击量为100×TCID50[5]。1∶512的病毒株用于体内实验,小鼠病毒半数致死量(LD50)为 10-3.5/0.05 ml,体内感染小鼠的病毒攻击量为10×LD50。
1.2 药材、试剂和仪器
重楼购于四川成都荷花池中药材市场,经甘肃省药品检验所鉴定为百合科重楼属植物云南重楼〔Paris polyphylla Smith var. yunnanensis(Franch.)Hand.-Mazz.〕的干燥根茎;奥司他韦(oseltamivir)由宜昌长江药业有限公司生产,国药准字H20065415;重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ对照品购于中国药品生物制品检定所。
胎牛血清:杭州四季青生物工程材料有限公司;胰蛋白酶:福建华灿生物科技有限公司;MTT和二甲亚砜(DMSO):Sigma公司;乙腈为色谱纯,美国Fisher公司;乙醇和甲醇等其他试剂:北京化工厂,均为分析纯。RE-52A型旋转蒸发仪:北京东南仪诚实验室设备有限公司;KP-01真空泵:无锡市四方真空设备有限公司;柱层析用硅胶,粗孔,60~200目,青岛海洋化工厂;高效液相系统:美国瓦里安公司;高效液相色谱仪,宁波市镇海玻璃仪器厂;3517-2型 CO2培养箱:美国 Shellab公司;IX71-F22PH 3型倒置显微镜:日本Olympus公司;生物安全柜:上海瑞仰净化装备有限公司;Thermo Multiskan MK3型酶标仪:芬兰雷勃公司。
1.3 重楼皂苷的制备
1.3.1 重楼总皂苷的提取
重楼药材500 g,碎成小块状,95%乙醇抽提,浓缩后将提取物溶于水中,滤除不溶物后于水溶液中加石油醚脱脂,萃取除去脂溶性杂质后,再用正丁醇进一步萃取,减压浓缩得总皂苷粗品48 g。
1.3.2 总皂苷的硅胶柱层析分离
硅胶800 g,氯仿湿法装柱,静置过夜。总皂苷20 g,加甲醇溶解,加硅胶适量搅拌,挥干溶剂,置柱顶端,以氯仿-甲醇-水梯度洗脱,洗脱过程中以薄层色谱法检查各收集部分,合并相同组分,得2个主要部分。
1.3.3 单体皂苷的分离
采用反相液相色谱分离得到的2个部分,甲醇-水系统洗脱,回收甲醇,水液冷冻干燥,得到4个单体。检测条件:MPG-ODS型色谱柱(150 mm×4 mm),流动相为甲醇∶水=80∶20(V/V),于210 nm处检测,柱温为35℃。对以上4个单体分别进行红外光谱、核磁共振氢谱、核磁共振碳谱和快速原子碰撞质谱,并与文献[6]和[7]进行了比对,分别鉴定为重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ。
1.4 重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ纯度的测定
色 谱 柱 为 ChromsphereC18(4.6 mm ×150 mm,5 μm)不锈钢柱,流动相为乙腈∶水=85∶15(V/V),检测波长为210 nm,柱温为35℃,流速为 1 ml·min-1,进样量为 20 μl。精密称取重楼皂苷Ⅰ对照品10.0 mg,置25 ml容量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为对照品溶液。精密吸取对照品溶液 3,6,9,12,15 和 18 μl按上述色谱条件测定,以峰面积为纵坐标(Y),重楼皂苷Ⅰ浓度为横坐标作标准曲线,得回归方程 Y=5×105X-765776,r=0.999。吸取浓度为 1 mg·L-1的重楼皂苷Ⅰ供试品溶液10 μl,注入高效液相色谱仪,分别测定其峰面积,重复3次得平均值,根据回归方程计算样品中重楼皂苷I的纯度。重楼皂苷Ⅱ,Ⅵ和Ⅶ的纯度测定方法与此相同。
1.5 MTT法[8]测定重楼皂苷和奥司他韦细胞毒性
将重楼皂苷Ⅰ,Ⅱ,Ⅵ,Ⅶ和奥司他韦用细胞维持液稀释成不同浓度待用。将MDCK细胞用含10%胎牛血清的DMEM培养液稀释成细胞悬液(5×108L-1),加入 96孔平底培养板内,每孔0.1 ml(含5×104细胞)。再向各孔中分别加入不同浓度的重楼皂苷Ⅰ,Ⅱ,Ⅵ,Ⅶ和奥司他韦0.1 ml,重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ终浓度为 6.25,12.5,25,50 和100 mg·L-1,奥司他韦的终浓度为 10,20,40,80 和160 mg·L-1,每浓度设 4 复孔,37℃,5%CO2培养箱培养。同时设正常细胞对照组。每天观察细胞生长和形态变化。高浓度药物组细胞呈现破碎、收缩、死亡和细胞量减少等现象;低浓度药物组细胞形态无明显改变。培养至第5天,测定重楼皂苷和奥司他韦对MDCK细胞的毒性作用。不能产生细胞病变的最大药物浓度视为最大无毒浓度。
1.6 重楼皂苷体外抗IAV活性的测定[9-10]
分别选取各自的最大无毒浓度为最高质量浓度,再依次2倍倍比稀释。重楼皂苷Ⅰ终浓度为50,25,12.5 和6.25 mg·L-1;重楼皂苷Ⅱ终浓度为12.5 和 6.25 mg·L-1;重楼皂苷Ⅵ终浓度为6.25和3.13 mg·L-1;重楼皂苷Ⅶ终浓度为12.5 和6.25 mg·L-1。每个浓度设 8 个复孔,每孔100 μl。同时设病毒对照组(只加病毒,不加药物)、细胞对照组(不加病毒,不加药物)和阳性药物对照组(加病毒和奥司他韦40 mg·L-1)。每孔加入0.1 ml IAV,IAV量为100×TClD50。将MDCK细胞悬液2 ×108L-1接种于 96 孔板中,每孔 0.1 ml,培养2 d形成单层细胞后根据IAV病毒复制周期进行以下体外抗病毒实验。
1.6.1 重楼皂苷对IAV的直接灭活作用
将0.1ml不同浓度的重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ以及奥司他韦分别和0.1ml IAV混合,37℃,5%CO2孵育培养 2 h。弃 0.1 ml混合液后加入0.1 ml上述细胞悬液,吸附2 h后,弃上清,换用维持液,每孔 0.2 ml,继续培养。
1.6.2 重楼皂苷对IAV吸附、侵入细胞的阻断作用
加入上述MDCK细胞悬液,待长成单层后,分别加入0.1 ml不同浓度重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ以及奥司他韦,37℃,5%CO2孵育培养1 h后,弃含药维持液,每孔加入流感病毒液,每孔0.1 ml,吸附2 h,弃病毒液换用维持液,每孔0.2 ml。继续培养。
1.6.3 重楼皂苷对IAV增殖的抑制作用
加入上述MDCK细胞悬液,待长成单层后,先加入0.1 ml IAV,37℃,5%CO2孵育培养1 h后,弃上清液,分别加入0.1 ml不同浓度重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ以及奥司他韦,37℃,5%CO2孵育培养1 h,补充细胞维持液 0.1 ml,37℃,CO2恒温箱继续培养。以上各孔待病毒对照孔中细胞病变达+++(细胞病变占单层细胞的50%~75%),再进行MTT染色,在酶标仪490 nm波长处测吸光度值(A),并计算各供试品在不同加药方式下对IAV的抑制率。按相同方法,重复做3次。抑制率(%)=(A加药组-A病毒对照组)/A病毒对照组×100%
1.7 重楼皂苷Ⅰ对体内感染IAV小鼠的保护作用
由于最终所制备的重楼皂苷Ⅱ,Ⅵ和Ⅶ样品量不足以进行体内抗IAV实验,故本实验只观察重楼皂苷Ⅰ对体内感染IAV小鼠的保护作用[11-12]。根据对重楼皂苷Ⅰ所进行的小鼠急性毒性实验结果,选择重楼皂苷Ⅰ的剂量为5和10 mg·kg-1,分别为其 LD50的0.1 和0.2 倍。
将小鼠随机分为模型对照、阳性药物对照奥司他韦3 mg·kg-1及重楼皂苷Ⅰ 5 和10 mg·kg-1组,每组10只,各组在乙醚轻度麻醉下滴鼻法感染10×LD50IAV鼠肺适应株50 μl,感染后4 h开始分别ig给予重楼皂苷Ⅰ和奥司他韦,每天分2次给药,连续5 d,另设正常对照组给予等容积无菌蒸馏水。自给药后每天观察并记录小鼠发病情况(行为、反应、运动、呼吸、心率、毛发和体质量等指标)和死亡数,共观察14 d。生命延长率(%)=〔(给药组平均存活天数-模型对照组平均存活天数)/模型对照组平均存活天数×100%〕。
1.8 统计学分析
2 结果
2.1 重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ的纯度
采用HPLC法测定分离得到的重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ的纯度分别为95.3%,90.2%,92.4%和86.8%。
2.2 重楼皂苷对MDCK细胞的毒性
重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ以及奥司他韦分别低于50,12.5,6.25,12.5 和 40 mg·L-1对靶细胞MDCK无细胞毒性,表明以上各化合物在上述浓度范围内对MDCK细胞无毒性作用(数据略)。
2.3 重楼皂苷对IAV的直接灭活作用
从表1可以看出,与正常细胞对照组相比,病毒对照组A490nm显著下降(P<0.01);与病毒对照组比较,重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ及奥司他韦各浓度组A490nm明显升高(P<0.01),提示重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ具有良好的体外杀灭IAV的作用。
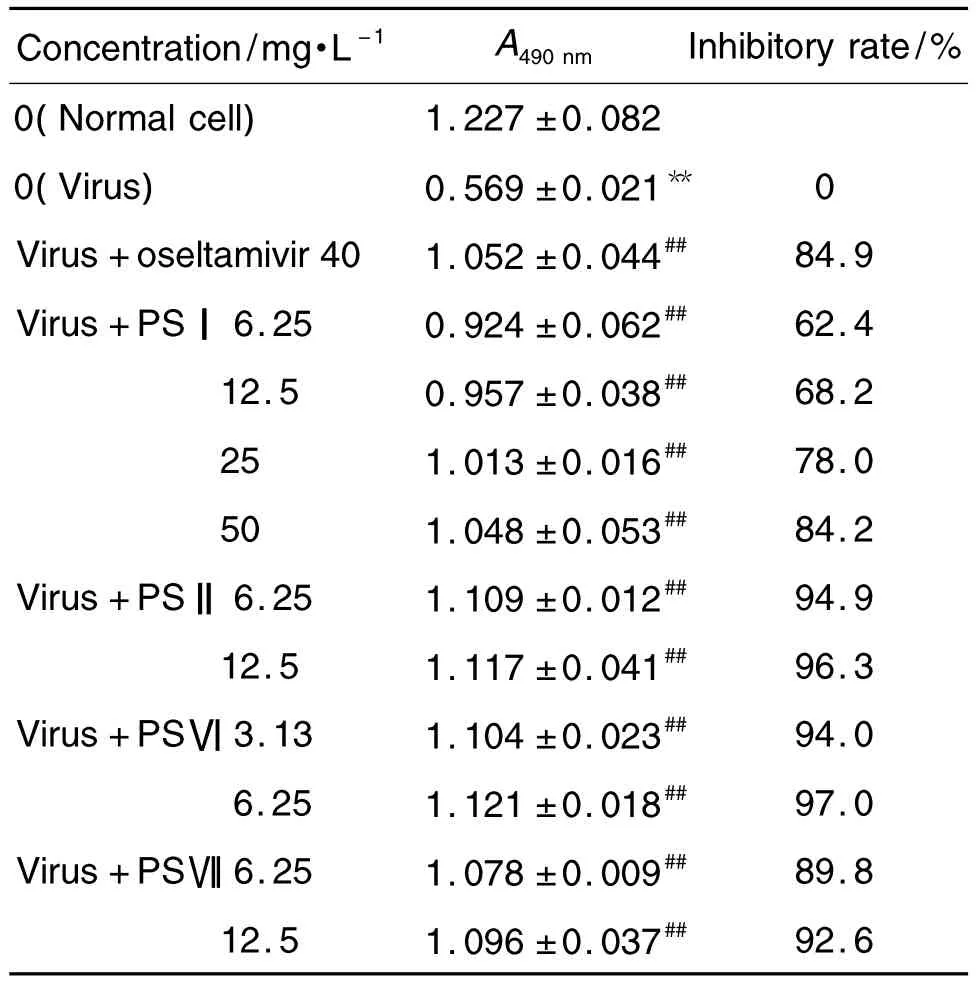
Tab.1 Direct inactivation of influenza A virus(IAV)by polyphylla saponin(PS)
2.4 重楼皂苷对IAV吸附和侵入细胞的阻断作用
从表2可以看出,与正常细胞对照组相比,病毒对照组A490nm显著降低(P<0.01);与病毒对照组相比,重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ及奥司他韦各浓度组A490nm明显升高(P<0.01),提示重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ在体外条件下具有阻断IAV吸附和侵入靶细胞的作用。

Tab.2 Prevention effect of PS on IAV from adsorbing with MDCK cells
2.5 重楼皂苷对IAV增殖的抑制作用
由表3可见,与正常细胞对照组相比,病毒对照组A490nm显著降低(P<0.01);与病毒对照组相比,重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ及奥司他韦各浓度组A490nm明显升高(P<0.01),提示重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ在体外条件下具有抑制IAV在靶细胞内增殖的作用。
2.6 重楼皂苷Ⅰ对IAV感染小鼠的保护作用
由表4可见,模型对照组小鼠IAV感染6 d后,小鼠活动和采食明显减少,呼吸和心率加快,平均存活时间仅为(8.5±0.3)d;重楼皂苷Ⅰ 5和10 mg·kg-1组IAV感染小鼠的死亡数量明显减少,平均存活时间较模型对照组延长(P<0.01),生命延长率分别为 49.4%和 55.3%,与奥司他韦3 mg·kg-1组相近,提示重楼皂苷Ⅰ对IAV感染小鼠具有明显的保护作用。
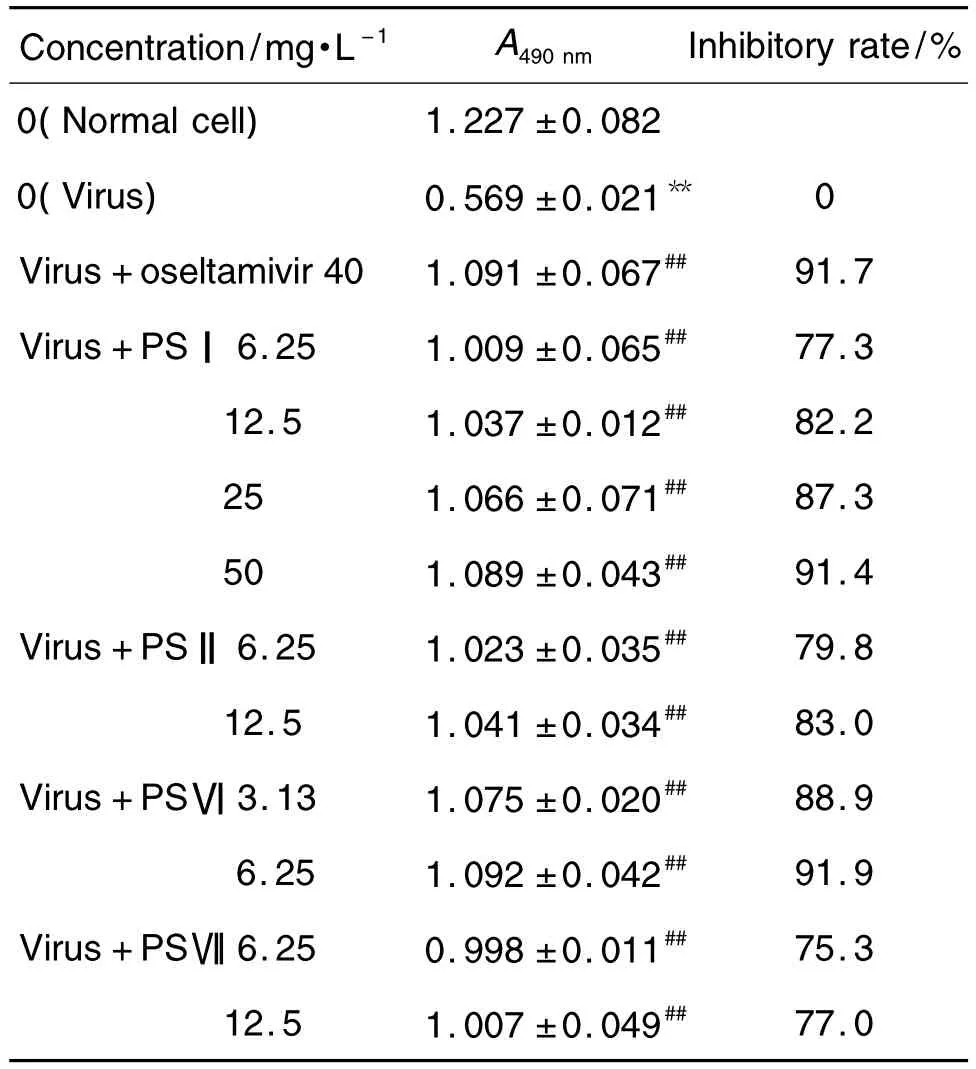
Tab.3 Inhibitory effect of PS on reproduction of IAV in MDCK cells
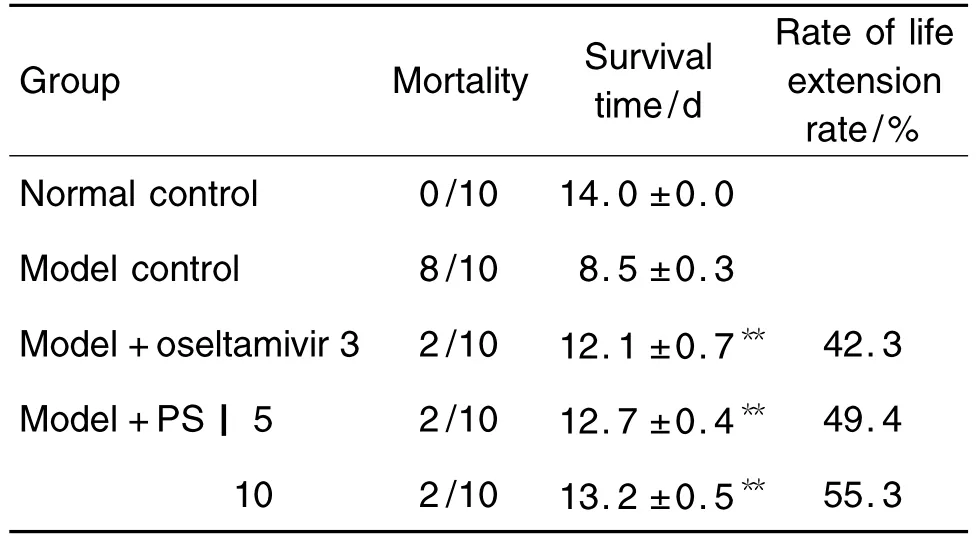
Tab.4 Protection of PSⅠ on mice infected with IAV
3 讨论
在短短的几年里,世界多个国家先后发生禽流感病毒跨越种属屏障,使人们清楚地认识到加强和完善对流感这类呼吸道传染性疾病的预防、控制和治疗具有重大科学意义和实际应用价值[13]。但由于流感病毒表面抗原的变异,迄今尚无理想的防治药物。重楼作为一味珍贵的中药材可用于治疗咽喉肿痛、毒蛇咬伤和跌打伤痛等。现代药理研究表明,该植物还具有止血、抗肿瘤和免疫调节等广泛的药理作用,极具潜在的开发价值。
本研究从云南重楼中提取、分离出重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ,经HPLC测定其纯度分别为95.3%,90.2%,92.4%和86.8%。MTT 法测定其体外抗IAV活性。结果表明,重楼皂苷Ⅰ 6.25,12.5,25和50 mg·L-1,重楼皂苷Ⅱ 6.25 和 12.5 mg·L-1,重楼皂苷Ⅵ 3.13 和 6.25 mg·L-1及重楼皂苷Ⅶ6.25和12.5 mg·L-1对 IAV 均有显著的直接灭活作用,尤其重楼皂苷Ⅵ6.25 mg·L-1和重楼皂苷Ⅱ12.5 mg·L-1对 IAV 的抑制率可高达 97% 和96.3%。其次,重楼皂苷Ⅰ,Ⅱ,Ⅵ和Ⅶ还可通过抑制IAV与MDCK细胞的吸附和融合,以及抑制靶细胞内的IAV复制,从而发挥其抗IAV的作用。至于其作用机制,尚有待进一步研究。
本研究还通过滴鼻感染IAV制备流感病毒小鼠模型,以进一步从整体水平验证重楼皂苷抗IAV的作用。由于重楼皂苷Ⅰ提取率和纯度相对较高,故只观察了重楼皂苷Ⅰ对体内感染IAV小鼠的保护作用。研究结果表明,感染模型对照组小鼠死亡率达8/10,正常对照组全部存活,表明该模型制备成功。给IAV感染小鼠每天ig给予重楼皂苷Ⅰ5和10 mg·kg-1连续5 d,从给药第1天开始至第14天,小鼠死亡率均降至2/10,且存活时间由(8.5±0.3)d延长到(12.7±0.4)和(13.2±0.5)d,生命延长率分别为 49.4%和 55.3%,与奥司他韦3 mg·kg-1作用相近。上述结果提示,重楼皂苷Ⅰ体内应用也具有抗IAV的作用。该作用与奥司他韦3 mg·kg-1作用相近,可能还与其抗炎杀菌和免疫增强等作用有关。
综上所述,重楼皂苷Ⅱ,Ⅵ和Ⅶ在体外具有明显的抗IAV作用,重楼皂苷Ⅰ在体内外均具有明显的抗IAV作用。重楼皂苷Ⅱ,Ⅵ和Ⅶ在体内是否同样具有抗IAV作用尚待进一步研究。
[1]Kosuge T,Yokota M,Sugiyama K,Yamamoto T,Ni MY,Yan SC.Studies on antitumor activities and antitumor principles of Chinese herbs.Ⅰ.Antitumor activities of Chinese herbs[J].J Pharm Soc Jpn(Yakugaku Zasshi),1985,105(8):791-795.
[2]Wang Q,Xu GJ,Jiang Y.Analgesic and sedative effects of Chinese drug Rhizoma Paridis[J].China J Chin Mater Med(中国中药杂志),1990,15(2):45-47,64.
[3]Luo G,Wu TK,Zhou YL,Zhou SQ.Primary study on stanching effect of Paris Phyllin C[J].Pharmacol Clin Chin Mater Med(中药药理与临床),1988,4(2):37-40.
[4]Ouyang LM, Huang XM, Wu XW, Zhang B,Liu HS.Experimental study on anti-white candida of traditional Chinese herbal drugs in vitro[J].Chin J Inf Tradit Chin Med(中国中医药信息杂志),2000,7(3):26-27.
[5]Yin Z,Liu JH.Animal Virology(动物病毒学)[M].2nd ed.Beijing:Science Press(科学出版社),1997:279-280.
[6]Chen CX,Zhou J.Studies on the saponin components of plants in Yunnan.Ⅴ.Steroid glycosides and β-ecdysone of Paris polyphylla Sm.var.yunnanensis(Fr.)H-M.[J].Acta Bot Yunnan(云南植物研究),1981,3(1):89-93.
[7]Chen CX, Zhang YT, Zhou J. Studies on the saponin components of plants in Yunnan.Ⅵ.Steroid glycosides of Paris polyphylla Sm.var.yunnanensis(Fr.)H-M(2)[J].Acta Bot Yunnan(云南植物研究),1983,5(1):91-97.
[8]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].JImmunolMethods, 1983, 65(1-2):55-63.
[9]Wang XY,Liu ZS,Jiang HZ,Liu LH,Lan AJ.Inhibitory effect of monomeric hypericin on human cytomegalovirus in vitro[J].Med J Wuhan Univ(Med Sci)(武汉大学学报:医学版),2006,27(3):303-306.
[10]Liu XL,Zhang Y,Liu XL.Anti-coxsackievirus B3effects of Sophora flavescens alkaloids in vitro[J].J Shenyang Pharma Univ(沈阳药科大学学报),2006,23(11):724-730.
[11]Gong XY,Qu XB,Wang ZY.Protective effect of Fuzheng Chuyi granules on the mice infected with influenza virus[J].Tradit Chin Drug Res Clin Pharmacol(中药新药与临床药理),2006,17(3):184-185.
[12]Geng ZH,Liu L,Li TS.Protective effect of pediatric asthma granules on the mice infected with influenza virus[J].J Pathogen Biol(中国病原生物学杂志),2008,3(8):579-581.
[13]Wells DL, Hopfensperger DJ, Arden NH,Harmon MW,Davis JP,Tipple MA,et al.Swine influenza virus infections.Transmission from ill pigs to humans at a Wisconsin agricultural fair and subsequent probable person-to-person transmission[J].JAMA,1991,265(4):478-481.
