去甲斑蝥素诱导人卵巢癌SK-OV-3细胞发生有丝分裂期阻滞与凋亡
2013-11-12李瑞婧洪兴福季媛媛孙震晓
李瑞婧,洪兴福,季媛媛,孙震晓
(北京中医药大学中药学院生物制药系,北京 100102)
斑蝥素(cantharidin)是从中药斑蝥(Mylabris)中提取的一种抗肿瘤活性成分,曾用于原发性肝癌等的治疗,但由于对泌尿系统强烈的刺激作用,限制了其在临床上的使用。去甲斑蝥素(norcantharidin,NCTD)系斑蝥素的结构同类物,是在对斑蝥素构效关系的研究基础上,由呋喃及顺丁烯二酸酐通过Diles-Alder反应催化加氢合成制得,是我国自行研制生产的新型抗肿瘤药物。NCTD与斑蝥素相比,缺少1,2位上的两个甲基,其毒性作用较低,基本消除了对泌尿系统的刺激性,保留了抗癌和升高白细胞的作用[1],现临床上主要用于肝癌等恶性肿瘤的治疗[1-3]。
前期体外细胞毒研究发现,NCTD能够诱导肝癌等肿瘤细胞发生有丝分裂期阻滞和细胞凋亡[4-6]。近年来,国内外对NCTD的抗癌机制研究主要集中在阐明其诱导肿瘤细胞凋亡途径上,如研究NCTD对肿瘤细胞凋亡信号通路中某些信号分子,如 Bcl-2、Bax、Bcl-xl、CD95、胱天蛋白酶 9、胱天蛋白酶3、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、核孤儿受体,即睾丸受体3(testicular receptor 3,TR3)等的影响[7-12],而对NCTD引起的细胞周期阻滞机制及其与细胞凋亡的关系研究较少[13-15]。卵巢癌发生率近年成上升趋势,死亡率高,特效药少。目前,临床上尚未使用NCTD治疗卵巢癌,有关NCTD对卵巢癌细胞作用的研究工作少见报道。前期研究工作表明,人卵巢癌SK-OV-3细胞株为NCTD敏感细胞株,以其为研究对象,既可以深入研究NCTD的抗癌作用,如引起细胞发生G2/M期阻滞机制及其与细胞凋亡的关系,同时也为将来临床上使用NCTD治疗卵巢癌提供参考。
1 材料与方法
1.1 化合物、试剂及主要仪器
人卵巢癌SK-OV-3细胞株,购自中国医学科学院细胞库;胎牛血清和RPMI 1640培养基、青霉素与链霉素,购自美国 Gibco公司,胰蛋白酶、NCTD、碘化丙啶(propidium iodide,PI),购自美国Sigma公司;山羊抗兔二抗Alexa Fluor 488、山羊血清购自美国Invitrogen公司;兔抗α微管蛋白,购自美国Epitomics公司,RNaseA,购自德国Merck公司,细胞凋亡检测试剂盒,购自中国北京宝赛生物技术有限公司,其他如甲醇、Triton X-100、姬姆萨染料、二甲亚砜(DMSO)、四甲基偶氮唑蓝(MTT)等为国产分析纯试剂。
MCO-18AIC(UV)型饱和湿度培养箱为日本Sanyo公司产品;ECLIPSE TE2000-S型倒置显微镜为日本Nikon公司产品;Spectra Max190型酶标仪为美国Molecular Devices公司产品;Epics XL型流式细胞仪为美国Beckman Coulter公司产品;ZEISS 510 META型共聚焦显微镜为日本Olympus公司产品;TDL-50B型离心机为中国Anke公司产品。
1.2 NCTD溶液配制
以双蒸水溶解并稀释,NCTD配成60 mol·L-1贮存液,过滤除菌,分装后-20℃贮存。每次临用前新鲜解冻,使用时用RPMI 1640培养基稀释母液至所需各浓度。
1.3 细胞培养
SK-OV-3细胞采用常规培养,在含l0%(V/V)灭活胎牛血清(FBS)、青霉素100 kU·L-1和链霉素100 mg·L-1的 RPMI 1640 培养液中,37℃,5%CO2的饱和湿度培养箱中培养,2~3 d换液传代1次,取对数生长期细胞进行相关实验。
1.4 细胞形态学观察[16-17]
取1.3培养的细胞,按照处理分为正常对照和NCTD 60 μmol·L-1处理SK-OV-3 细胞6,12 和24 h组;采用Giemsa染色观察正常对照组和NCTD组细胞的细胞核及染色体等,随机选取1000个细胞,计算单个核、多个核及核碎裂、有丝分裂相细胞所占比例。
1.5 MTT比色法检测细胞存活率[18]
取对数生长期细胞,以每孔1×103个细胞终密度接种于96孔培养板,分为空白对照组(1640培养基)和 NCTD 30,60,120 和 240 μmol·L-1组,分别培养24,48,72 h后,每孔加150 μl MTT工作液,置37℃,5%CO2培养箱中孵育6 h,每孔加入DMSO 150 μl,震摇 10 min,在 550 nm 波长处读取吸光度值(A),计算抑制率,抑制率(%)=(1-NCTD处理组A值/空白对照组 A值)×100%。利用SPSS17.0统计处理软件回归分析方法计算半数抑制浓度(IC50)。每个样本至少重复3个孔,实验重复3次。
1.6 流式细胞术检测细胞周期阻滞
NCTD 60 μmol·L-1作用于对数生长期的SK-OV-3细胞后,分别收集6,12,24 h加药组和正常对照组的细胞,用PBS(pH 7.2)洗涤2次,70%冰乙醇固定,4℃保存过夜。800×g离心5 min弃去固定液,500 μl PBS重悬,加入 RNaseA至终浓度20 mg·L-1,37℃水浴,45 min。加入 PI染液至终浓度50 mg·L-1,4℃避光染60 min。流式细胞仪检测1×104个细胞,ModFit LT软件分析细胞周期,上机前常规进行光路流路校准。
1.7 间接免疫荧光显微术结合共聚焦显微镜观察细胞内纺锤体形态的变化
[19]将干净无荧光血盖片置于无菌六孔板里,按每孔5×105个密度接种细胞,培养至细胞汇合到70%~80%时,取出血盖片,清洗后于-20℃甲醇固定20 min,再用 pH 7.4的 0.1%Triton X-100-PBS孵育30 min,山羊血清工作液封闭30 min,加一抗37℃孵育2 h,再用二抗室温孵育1 h,取出血盖片,吸去水分,95%甘油封片,共聚焦显微镜下观察。
1.8 流式细胞仪测定SK-OV-3细胞凋亡
分别收集 NCTD 60 μmol·L-1作用 12 和 36 h的SK-OV-3全细胞及机械振荡分离的有丝分裂期细胞和间期细胞〔(5~10)×106个〕,4℃,800×g离心10 min后,弃上清。加入1 ml预冷的PBS,4℃,800×g离心10 min后,弃上清,重复洗2次。按照细胞凋亡检测试剂盒使用说明书操作[20],将细胞重悬于200 μl结合缓冲液,加入10 μl AnnexinⅤ-FITC 轻轻混匀后,避光室温反应15 min或4℃反应30 min,上机前 5 min 加入300 μl结合缓冲液以及 5 μl PI,校准光路后,上机检测。
1.9 统计学处理
2 结果
2.1 NCTD对SK-OV-3存活的影响
如图1所示,NCTD对细胞的抑制率随浓度增加及作用时间的延长而增加,表明NCTD对SK-OV-3细胞的生长有抑制作用,且在实验条件下NCTD对SK-OV-3细胞的生长抑制作用呈现时间(P<0.05)和浓度依赖性(P<0.05)。NCTD作用SK-OV-3细胞24,48 和72 h 的 IC50分别是(261.3±2.4)μmol·L-1,(48.3±1.7)μmol·L-1和(10.9±1.0)μmol·L-1。
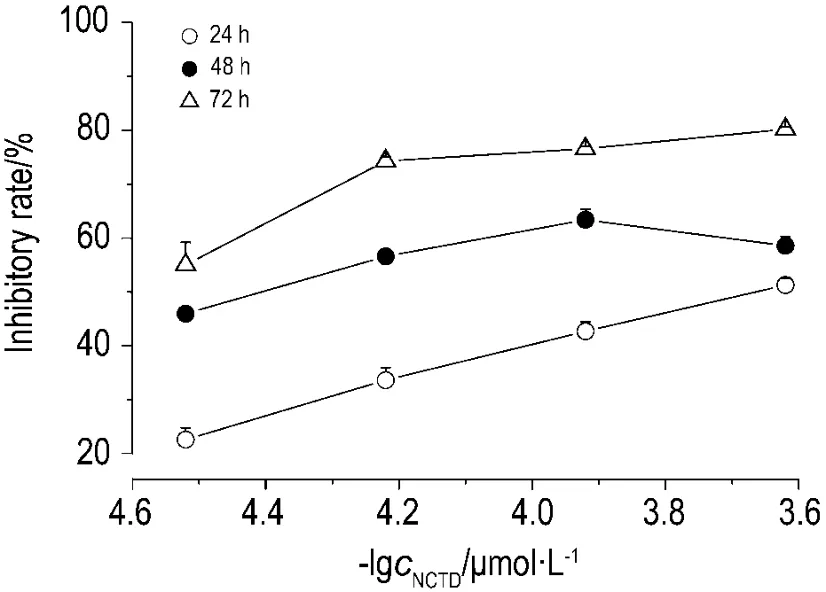
Fig.1 Effect of norcantharidin(NCTD)on SK-OV-3 cell survival.±s,n=3.
2.2 NCTD对SK-OV-3细胞周期的影响
根据细胞毒实验结果,选择 NCTD 60 μmol·L-1分别作用于SK-OV-3细胞0,6,12和24 h,利用流式细胞术检测细胞周期分布,结果如图2所示。NCTD作用于SK-OV-3细胞0,6,12和24 h,细胞逐渐表现G2/M期阻滞,随作用时间延长阻滞作用增强。
2.3 NCTD对SK-OV-3细胞形态的作用
倒置相差显微镜观察结果显示(图3),NCTD 60 μmol·L-1作用 6 h(图 3C)后,细胞形态发生了明显的变化,与正常对照组(图 3A,3B)相比,NCTD处理组与部分细胞收缩、变圆,与周围细胞脱离,细胞间隙增大;12 h后(图3D),部分细胞变圆、浮起,细胞变圆浮起的数量随时间的延长也相应增加;24 h时(图3E,3F),部分细胞发生明显变形。Giemsa染色(图4)见与正常对照组(图4A)相比,NCTD作用于 SK-OV-3细胞6 h(图 4B)、12 h(图4C)和24 h(图4D)后,有丝分裂相细胞数量明显增多,部分呈现前中期的形态特征,部分有丝分裂相阻滞的细胞中,异常凝集的染色质散乱地分布于细胞质中。并且随着药物作用时间的延长,多个核细胞及核碎裂细胞数量更为增加。
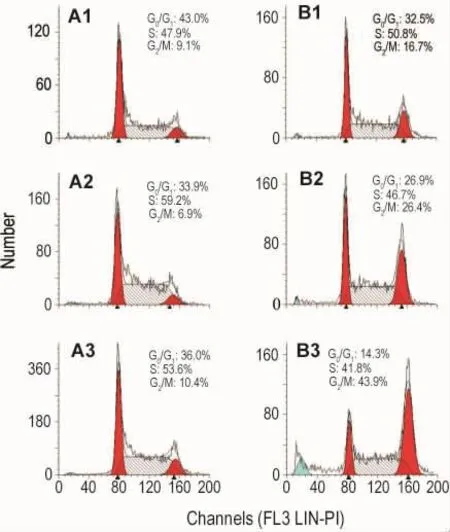
Fig.2 Effect of NCTD on SK-OV-3 cell cycle by flow cytometry.A1-A3:SK-OV-3 cells at 6,12,and 24 h,respectively;B1 - B3:NCTD 60 μmol·L -1treated for 6,12,and 24 h,respectively.
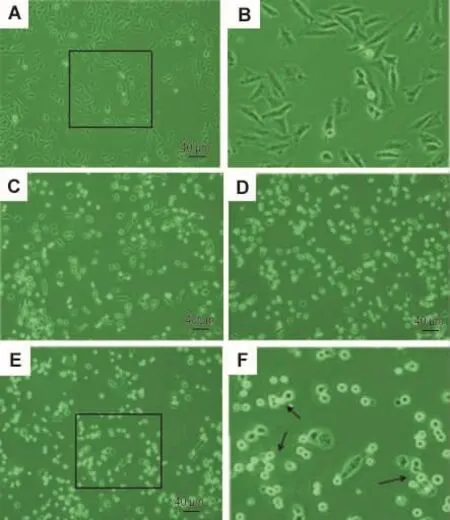
Fig.3 Effect of NCTD on morphological changes of SK-OV-3 cells.A and B:normal control group,B is a partially enlarged detail of A;C:NCTD 60 μmol·L -1treated for 6 h;D:NCTD 60 μmol·L-1treated for 12 h;E and F:NCTD 60 μmol·L-1 treated for 24 h,F is a partially enlarged detail of E.Arrows stand for apoptosis cells.
2.4 NCTD对SK-OV-3细胞内微管分布及纺锤体的影响
如图5和图6所示,细胞形态,正常对照组中细胞贴壁良好,铺展成单层,细胞呈多角形,显绿色荧光的微管沿细胞分布,构成胞质骨架,显红色的细胞核单一、完整(图5A1~A3)。图6A1~A3为对照组一个处于有丝分裂中期的细胞,纺锤体轮廓可见。NCTD组的细胞变圆,微管排列发生变化,没有明显极性(图5B1~B3),图6B1~B3为NCTD组一个处于有丝分裂中期的细胞,可见细胞纺锤体出现坍塌,结构发生明显紊乱,图6C1~C3显示NCTD组一个有丝分裂期细胞出现染色体多极分离的现象。
2.5 NCTD对SK-OV-3细胞凋亡的影响
如图7流式结果所示,NCTD作用12 h,细胞凋亡率为20.4%,作用36 h,细胞凋亡率为62.3%。可见随着药物作用时间延长,细胞的凋亡率增加。
利用温和的机械震荡法分离NCTD处理12 h的NCTD细胞,把细胞分成悬浮和贴壁两类,分别测定两类细胞中凋亡细胞的比率,然后分别继续作用24 h,即NCTD作用36 h,测定两类细胞中凋亡细胞的比率(图8),同时通过Giemsa染色观察细胞核的变化,统计悬浮和贴壁细胞中单核、多个核及核碎裂、有丝分裂期细胞所占比例。结果发现,NCTD作用SK-OV-312 h,悬浮细胞多个核或核碎裂细胞所占比例相对较大,为7.6%,且凋亡细胞比例达69.1%,而贴壁细胞以单个核细胞为主,所占比例高达89.3%,凋亡细胞占15.3%;Giemsa染色发现,悬浮细胞处于分裂期的细胞占到56.2%,贴壁细胞中没有找到处于分裂期的细胞。NCTD继续作用24 h后,悬浮细胞组凋亡细胞比例减少,占47.4%,而贴壁细胞组凋亡细胞比例增加,占53.6%。说明NCTD诱导SK-OV-3细胞凋亡可不依赖G2/M期阻滞。
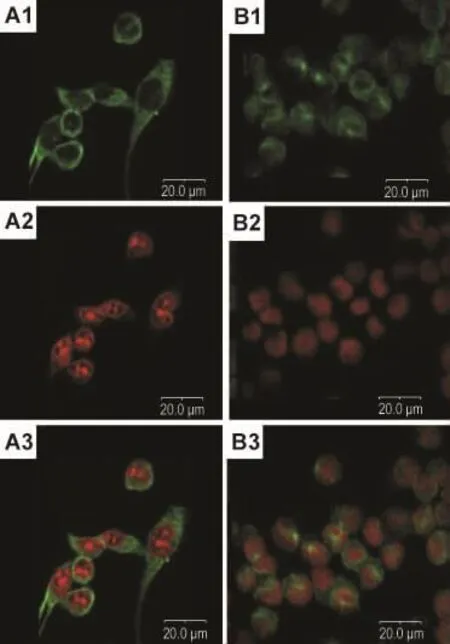
Fig.5 Effect of NCTD onabnormalmicrotubule arrangement of SK-OV-3 cells.A1-A3:SK-OV-3 cells at 8 h group;B1-B3:NCTD 60 μmol·L-1treated for 8 h group.The green fluorescence in A1 and B1 shows the intracellular localization of microtubule.The red fluorescence in A2 and B2 shows the intracellular localization of nuclei.
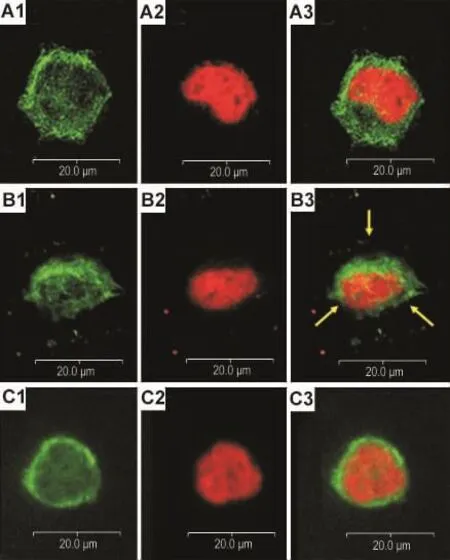
Fig.6 Effect of NCTD on aberrant mitotic spindles of SK-OV-3 cells.A1-A3:SK-OV-3 cells at 8 h group;B1-B3 and C1 - C3:NCTD 60 μmol·L -1treated for 8 h group,respectively.The green fluorescence in A1,B1 and C1 shows the intracellular localization of microtubules.The red fluorescence in A2,B2 and C2 shows the intracellular localization of nuclei.
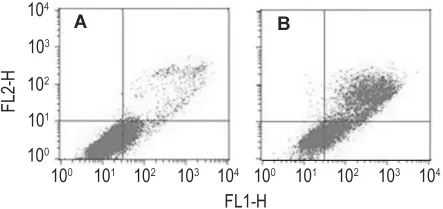
Fig.7 Effect of NCTD on SK-OV-3 apoptosis.A:NCTD 60 μmol·L -1treated for 12 h group;B:NCTD 60 μmol·L -1treated for 36 h group.
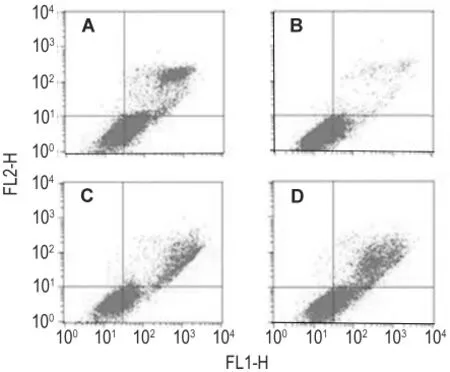
Fig.8 Effect of NCTD on apoptosis of adherent cells and non-adherent SK-OV-3 cells.A:NCTD 60 μmol·L -1 treated for 12 h-non-adherent group;B:NCTD 60 μmol·L -1treated for 12 h-adherent group;C:NCTD 60 μmol·L -1treated for 36 h-non-adherent group;D:NCTD 60 μmol·L-1treated for 36 hadherent group.
3 讨论
研究表明,NCTD低剂量对SK-OV-3细胞的生长就有显著的抑制作用,且存在着明显的时间和剂量依赖性。NCTD可以引起细胞发生明显的G2/M期阻滞,同时,NCTD影响SK-OV-3细胞内微管的分布,引起纺锤体形成失败,推测 NCTD引起的SK-OV-3细胞发生G2/M期阻滞与其干扰细胞内微管及纺锤体组装有关。NCTD可以诱导SK-OV-3细胞凋亡,实验发现,NCTD引起的SK-OV-3细胞凋亡可以不依赖细胞G2/M期阻滞。
众多研究发现,引起细胞周期阻滞和诱导细胞凋亡是一些抗肿瘤药物的重要机制。正常细胞和肿瘤细胞的增殖都依赖于细胞周期的运行,肿瘤治疗的中心环节就是干扰肿瘤细胞的细胞周期,从而使肿瘤细胞增殖速率减慢或诱导肿瘤细胞走向死亡。流式细胞术测定结合细胞形态学观察发现,细胞在NCTD作用下发生明显的G2/M期阻滞,为进一步探讨细胞G2/M期阻滞机制,我们利用间接免疫荧光术在共聚焦显微镜下观察NCTD对人卵巢癌SK-OV-3细胞内微管分布和纺锤体形态的影响。结果发现,NCTD破坏了SK-OV-3细胞的正常形态,细胞微管排列紊乱,有的细胞的纺锤体结构出现坍塌,有的细胞出现染色体多极分离的现象。微管是细胞的重要组成部分,参与细胞纺锤体的形成,细胞由分裂间期进入有丝分裂期时,细胞质中的微管解聚成微管蛋白,微管蛋白在中心体周围重新装配为纺锤体,介导染色体的运动;分裂进入末期后,纺锤体解聚形成游离的微管蛋白,重新参与微管的组装[21]。由此可见,微管处于一种动态的聚合-解聚状态是非常重要的,任何干扰微管这种动态平衡的行为,均会引起有丝分裂阻滞,并可能通过一系列的信号转导诱导细胞凋亡[22]。我们体外研究已发现,NCTD在一定浓度范围内可以抑制微管蛋白聚合,并在 SK-OV-3细胞中得到验证[23],由此推测NCTD引起纺锤体结构的紊乱可能与抑制微管蛋白的聚合有关。
本研究利用对凋亡细胞敏感的AnnexinⅤ和细胞核特异性染色剂PI双染试剂盒,流式细胞术检测NCTD诱导SK-OV-3细胞凋亡情况,结果发现,细胞凋亡率明显呈时间依赖性增加。用温和震荡的方法把NCTD作用12 h后的SK-OV-3细胞分成悬浮和贴壁两组细胞,分别测定分离当时和NCTD继续作用24 h后两组细胞中凋亡细胞所占比率,发现没有有丝分裂相细胞的贴壁细胞组在NCTD作用24 h后凋亡细胞比例大增,而悬浮组细胞则有所下降,说明NCTD诱导SK-OV-3细胞凋亡可不依赖细胞G2/M期阻滞。
有丝分裂灾变死亡是由于细胞有丝分裂异常或细胞长时间阻滞在有丝分裂期而诱发的一种细胞死亡方式,可以在电离辐射、化疗药物或高温作用下发生[24]。随着对其机制研究的日渐深入,近年来提出与细胞凋亡、坏死、自噬并列为4种主要的细胞死亡形式,其主要细胞学特点为有丝分裂异常致有丝分裂阻滞、中心体异常复制致形成多极纺锤体、染色体异常凝集等。有丝分裂灾变死亡的发生是受到多种信号通路调节的精密过程,与细胞周期检查点异常、中心体或纺锤体结构异常以及DNA损伤存在密切的联系[25-26]。本实验中NCTD通过诱导细胞有丝分裂期阻滞和细胞凋亡抑制人卵巢癌SK-OV-3细胞生长,而细胞有丝分裂期阻滞最终可能导致细胞发生有丝分裂灾变死亡。有关NCTD诱导的SK-OV-3细胞有丝分裂期阻滞与有丝分裂灾变死亡及凋亡间的相关性尚需进一步研究阐明。
参考文献:
[1]Wang GS.Medical uses of Mylabris in ancient China and recent studies[J].J Ethnopharmacol,1989,26(2):147-162.
[2]Sun W,Fang YZ,Zhang WZ,Ge CY,Zhao FD,Zhou Tt,et al.Inhibitive effect of norcantharidin on vasculogenic mimicry in three-dimensional cultures of gallbladder carcinoma cell lines GBC-SC and SGC-996 in vitro[J].Surg Res New Tech(外科研究与新技术),2012,1(1):42-48.
[3]Chu YP,Shen L,Bai Y.Efficacy observation of liver cancer at the later stage for the eldely treated with integration of norcantharidin and Chinese medicine[J].World J Integr Trad West Med(世界中西医结合杂志),2012,7(9):765-767.
[4]Sun ZX,Zhao TD,Wei YL,Li JS.Study of apoptosis of human hepatoma cells(BEL-7402)induced by norcantharidin[J].Acta Anat Sin(解剖学报),1999,30(1):65-68.
[5]Sum ZX,Zhao TD,Wei YL,Li JS.Study on apoptosis of K562 human myeloid leukemia cells induced by norcantharidin[J].Chin J Histochem Cytochem(中国组织化学与细胞化学杂志),1999,8(1):92-98.
[6]Sum ZX,Zhao TD,Wei YL,Li JS.Studies on apoptotic cytology of K562 human myeloid leukemia cells induced by cantharidin and norcantharidin[J].Acta Anat Sin(解剖学报),2000,31(1):56-60.
[7]Sun ZX, Ma QW, Zhao TD,Wei YL,Wang GS,Li JS,et al.Apoptosis induced by norcantharidin in human tumor cells[J].World J Gastroenterol,2000,6(2):263-265.
[8]Peng F,Wei YQ,Tian L,Yang L,Zhao X,Lu Y,et al.Induction of apoptosis by norcantharidin in human colorectal carcinoma cell lines:involvement of the CD95 receptor/ligand[J].J Cancer Res Clin Oncol,2002,128(4):223-230.
[9]An WW,Wang MW,Tashiro S,Onodera S,Ikejima T.Norcantharidin induces human melanoma A375-S2 cell apoptosis through mitochondrial and caspase pathways[J].J Korean Med Sci,2004,19(4):560-566.
[10]An WW,Wang MW,Tashiro S,Onodera S,Ikejima T.Mitogen-activated protein kinase-dependent apoptosis in norcantharidin-treated A375-S2 cells is proceeded by the activation of protein kinase C[J].Chin Med J(Engl),2005,118(3):198-203.
[11]Yang PY,Chen MF,Kao YH,Hu DN,Chang FR,Wu YC.Norcantharidin induces apoptosis of breast cancer cells:involvement of activities of mitogen activated protein kinases and signal transducers and activators of transcription[J].Toxicol In Vitro,2011,25(3):699-707.
[12]Liu S, Yu H, Kumar SM,Martin JS,Bing Z,Sheng W,et al.Norcantharidin induces melanoma cell apoptosis through activation of TR3 dependent pathway[J].Cancer Biol Ther,2011,12(11):1005-1014.
[13]Chen YN,Chen JC,Yin SC,Wang GS,Tsauer W,Hsu SF,et al.Effector mechanisms of norcantharidin-induced mitotic arrest and apoptosis in human hepatoma cells[J].Int J Cancer,2002,100(2):158-165.
[14]Huang Y,Liu Q,Liu K,Yagasaki K,Zhang G.Suppression of growth of highly-metastatic human breast cancer cells by norcantharidin and its mechanisms of action[J].Cytotechnology,2009,59(3):201-208.
[15]Yu CC,Ko FY,Yu CS,Lin CC,Huang YP,Yang JS,et al.Norcantharidin triggers cell death and DNA damage through S-phase arrest and ROS-modulated apoptotic pathways in TSGH 8301 human urinary bladder carcinoma cells[J].Int J Oncol,2012,41(3):1050-1060.
[16]Sun ZX,Zhao TD,Li JS.Recognizing apoptotic and necrotic cells by counterstaining in situ[J].Chin J Histochem Cytochem(中国组织化学与细胞化学杂志),1998,7(2):160-163.
[17]Zhang RC,Liu B,Sun ZX,Xu DY.Effects of extract of Polygonum multiflorum on cell cycle arrest and apoptosis of human liver cell line L02[J].J Chin Integr Med(中西医结合学报),2010,8(6):554-561.
[18]Wang HQ, Sun ZX. Effectof Pdcd4 tumor suppressor gene expression on cytotoxicity of hydroxycamptothecine[J].World Chin J Digestol(世界华人消化杂志),2009,17(7):647-651.
[19]Bonness K,Aragon IV,Rutland B,Ofori-Acquah S,Dean NM,Honkanen RE.Cantharidin-induced mitotic arrest is associated with the formation of aberrant mitotic spindles and lagging chromosomes resulting,in part,from the suppression of PP2Aalpha[J].Mol Cancer Ther,2006,5(11):2727-2736.
[20]Zhang RC,Zhang C,Sun ZX,Deng QH.Damage effect of Polygonum multiflorum fractions on human normal liver cells L02 and liver cancer cells HepG2[J].China J Chin Mater Med(中国中药杂志),2012.37(12):1830-1835.
[21]Jordan MA.Mechanism of action of antitumor drugs that interact with microtubules and tubulin[J].Curr Med Chem Anticancer Agents,2002,2(1):1-17.
[22]Hamel E.Natural products which interact with tubulin in the vinca domain:maytansine,rhizoxin,phomopsin A,dolastatins 10 and 15 and halichondrin B[J].Pharmacol Ther,1992,55(1):31-51.
[23]Hong XF,LI BS,Sun ZX.Inhibitory effect of norcanthari-din on tubulin polymerization in vitro[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2012,26(5):630-634.
[24]Vakifahmetoglu H,Olsson M,Zhivotovsky B.Death through a tragedy:mitotic catastrophe[J].Cell Death Differ,2008,15(7):1153-1162.
[25]Zhang B,Zhang SM,Guan H,Wang Y,Liu XD,Xu QZ,et al.The spindle damage and mitotic catastrophe induced by 6-bromoisovanillin in HeLa cells[J].Sci Technol Rev(科技导报),2010,28(10):19-23.
[26]Goto H, Izawa I, Li P, Inagaki M.Novel regulation of checkpoint kinase 1:Is checkpoint kinase 1 a good candidate for anti-cancer therapy?[J].Cancer Sci,2012,103(7):1195-1200.
