原子力显微镜研究不同刺激条件下T细胞的形态和生物力学特性*
2013-11-10邢晓波朱德斌王海燕蔡继业
邢晓波,黄 训,朱德斌,王海燕,蔡继业
(1.暨南大学化学系,广东广州 510632;2.华南师范大学生物光子学研究院激光生命科学研究所教育部重点实验室,广东广州 510631;3.暨南大学材料科学与工程系,广东广州 510632;4.广州计量检测技术研究院,广东 广州 510663)
T淋巴细胞是在胸腺中分化成熟的淋巴细胞,故称胸腺依赖性淋巴细胞(Thymus-dependent lymphocyte),简称T细胞。T细胞是淋巴细胞中数量最多,功能最复杂的一类细胞,是承担细胞免疫的活性细胞。T细胞具有抗原识别受体,因此它们必需经抗原刺激才能活化而发挥其效应细胞的作用,为特异性细胞免疫。大量的研究表明[1],病原体感染、肿瘤的发生、自身免疫性疾病的发生以及有关组织器官移植排斥等都与T细胞抗原识别和活化异常或偏离相关。抗原是一类能刺激机体产生抗体或致敏淋巴细胞,并能与相应的抗体或致敏淋巴细胞特异性结合,发生免疫应答的物质,是引起特异性免疫的激发原[2]。当T淋巴细胞识别出细胞表面存在抗原多肽时,免疫系统便将其认为异种细胞(如肿瘤细胞,病毒感染的细胞)并开始攻击。因此,T细胞的抗原识别和活化可以直接影响整个免疫应答的性质、效能和结果,在人体免疫反应中具有核心作用。T淋巴细胞活化主要表现为细胞分裂增殖,克隆扩增,并出现分化,由静止状态转变为效应细胞并执行各种功能[3]。而T淋巴细胞的静息和(不同时间的)活化期,表达在细胞膜的膜表面抗原分子的种类和数量也是不同的,同时,T淋巴细胞的形态、超微结构和生物力学特性会发生一系列的变化[4-5]。由于细胞膜表面受体和表达蛋白等都是生物大分子,特征尺寸在10~100 nm量级,细胞力学特性的变化在皮牛顿量级,这就需要有高分辨率的纳米手段和高灵敏度的测力手段对其进行研究。随着生物纳米技术的发展和扫描探针显微术的发展,使得原子力显微镜(AFM)能够分析细胞和生物材料的纳米结构和生物力学特性[6-8]。
机体的器官、组织、细胞和生物大分子在一定范围力学作用下发生相应的形态和功能改变,这是机体对力学刺激的响应过程,而机体对一定范围力学刺激的自适应对于维持正常生理功能具有重要作用。研究力对细胞的作用,是揭示器官、组织生物力学特性的基础,也是进一步研究细胞内生物大分子的生物力学特性的出发点。细胞粘附包括细胞之间的粘附以及细胞与基质之间的粘附,其中细胞之间粘附是细胞间信息交流的一种形式,细胞与基质的粘附与细胞的迁移和运动密切相关[9],其过程涉及复杂的细胞生物化学、机械性能、表面键合、电荷、自由能、疏水性等因素[10],细胞的弹性是细胞维持其形态和承受一定的压力所必须的,因此对研究T细胞活化前后粘附力和弹性模量的变化,对于揭示其生物学功能具有重要的意义。大量研究表明,力可以通过影响细胞内基因表达和蛋白质的合成来调节细胞功能,在细胞的生理、病理过程中发挥着重要作用[11]。
本实验基于AFM的力谱测量功能,对静止(resting)T淋巴细胞以及经超抗原(SEA)或植物凝集素(PHA)活化后T淋巴细胞的形态结构、表面超微结构成像和探测研究,并通过比较不同状态下T淋巴细胞表面粘附力和硬度的变化,探讨T淋巴细胞形态变化与粘附行为和细胞硬度之间的关系,以便能更深入地了解T淋巴细胞形态结构和细胞行为之间的关系。
1 材料与方法
1.1 实验材料及主要仪器
健康人外周血,收集于肝素钠抗凝的试管内;超抗原(StaphylococcalenterotoxinA,SEA)、植物凝集素(Phytohaemagglutinin,PHA)、戊二醛均购自 Sigma公司;人外周血淋巴细胞分离液,人T细胞富集液(RosetteSep®HumanT Cell Enrichment Cocktail)均购自AXIS SHIELD PoC AS公司;RPMI-1640、胎牛血清(Fetal bovine serum,FBS)及β-巯基乙醇等细胞培养试剂均为GibcoBR公司产品;其它试剂均采用国产分析纯,实验用水为超纯水。原子力显微镜 (Autoprobe CP research,thermomicroscopes公司,美国)。
1.2 T细胞的分离和活化
将2mL健康人外周血与肝素抗凝剂混匀以抗凝。具体分离步骤如下:1)将100μL T细胞富集液与2mL全血轻轻混匀,并在室温下孵育20 min;2)再用等体积(2mL)的含2%牛血清白蛋白(BSA)的PBS液轻轻稀释混匀;3)将稀释后的血轻轻铺在3mL的密度分离液(Ficoll)上面(注意让其分层,而不能混合),然后室温下以1200 g的速度离心20 min;4)取密度分离液与血浆之间的细胞富集层(白色),细胞用2%BSA+PBS溶液离心洗两次(425 g,10 min)。将分离的细胞重悬于RPMI 1640培养 液 培 养(含 10%FBS 及 50μmol/L β-巯 基 乙醇),调整细胞密度为2×106cells/mL。台盼蓝染色观察细胞活力,活细胞数占98%。T淋巴细胞设置3组:Resting组(不添加任何外源刺激剂)、SEA(10μg/mL)刺激组和 PHA(10μg/mL)刺激组。将细胞在24孔板接种后置于37℃、体积分数为5%的CO2培养箱中培养48 h。
1.3 样品的制备
分别取Resting、SEA活化和PHA活化48 h的T淋巴细胞,滴于干净的盖玻片上,使其自然铺展,吸附10 min,然后用1.5%的戊二醛固定10~15 min,用蒸馏水冲洗3次,室温自然干燥。
1.4 AFM成像及力谱测量
将制备好的样品置于AFM的XY扫描台上,用监视器定位所要扫描的样品区域,在空气中室温下,利用接触模式成像。实验采用100μm扫描器,UL20B硅探针,力常数为2.8 N/m。AFM图像仅经过自带软件(IP 2.1版)的平滑处理,以消除扫描方向上的低频背景噪音。
1.5 统计学分析
利用SPSS 13.0进行力曲线相关数据以及细胞的各项物理参数统计分析,采用 t检验方法,P<0.05被认为是有统计学意义的。取自10个细胞的所有数据用平均值±标准方差表示。
2 结果
2.1 倒置荧光显微镜观察活化前后T细胞的形态
图1a和1b为未加刺激剂培养了48 h时T细胞在倒置荧光显微镜下的形态,细胞呈规则的圆形,从40倍放大成像可以看出细胞与细胞之间没有连接到一起(图1b)。从图1c和1d可以看出经PHA刺激48 h时,细胞发生凝集,出现细胞团如图1c中红色虚线所示,细胞团大小不一如图1d中红色虚线所示。从图1e和1f也可以看到SEA活化后细胞也发生凝集但是与PHA活化相比形成的细胞团较小,与对照组相比细胞分布不均匀,有的地方细胞密度较大有的地方细胞密度较小。从40倍的放大图(图1f)可以看到有些细胞与细胞连接到一起。
2.2 T细胞形貌和膜纳米结构的AFM表征
首先,研究了静息的 T细胞的形貌结构与膜超微结构(如图2)。从图2a可以看出静息的T细胞为规则的圆形。其中图2b是图2a的三维图像,图2c为误差信号模式图,在这种成像模式下许多特化结构如细胞边缘的伪足等可以更加清楚的显示出来。从其剖面图(图2d)可以看出静息的T细胞高度为1.86μm,半高宽为 5.0μm。图 2e 和图 2f是膜表面纳米结构图像,其中图2f是图2e的三维图。静息的T细胞表面相对比较光滑(图2e和2f)。为了在纳米空间对静息的和不同活化剂活化的T细胞的细胞膜化学成分的变化进行分析,我们利用AFM的横向力显微(Lateral force microscopy,LFM)功能,对细胞膜表面的变化进行了成像。根据材料表面物理特性如表面摩擦力的差异,AFM在横向力成像模式(lateral force,LF)下可以获得材料表面具有不同物理特性的结构分布[9]。图2g为静息的T细胞膜纳米结构的LFM图,图中颜色由红到蓝表示摩擦力由大变小,从图中可以看出细胞表面摩擦力的大小分布并不是非常均匀的,这主要是由于细胞表面颗粒的高度和细胞膜成分的差异引起的。图2h是膜表面颗粒粒径的分布图,其表面颗粒粒径分布在20~60 nm之间,其中主要集中在40 nm。
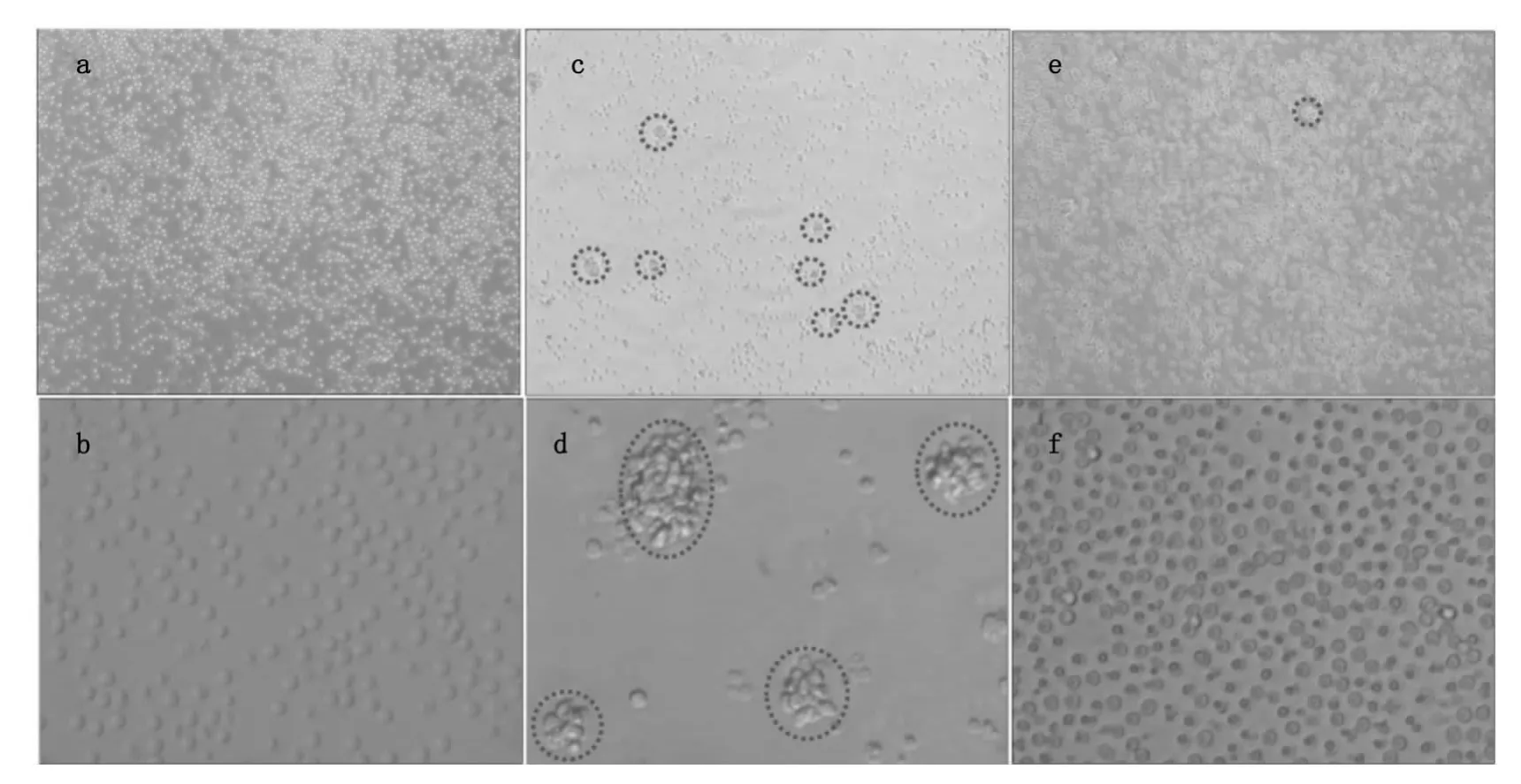
图1 倒置荧光显微镜下T细胞活化前后的形态。图(a)和图(b)是没有加刺激剂的T细胞,图(c)和图(d)是T细胞经PHA刺激48 h时的形态,图(e)和图(f)是T细胞经SEA刺激48 h时的形态Fig.1 Microscopic images of T cells before and after SEA and PHA treatment for 48 h.Concentrations of PHA and SEA used in this study were all 10μg/mL.(a,b,c,d,e and f)images of T cells before(a,b)and after PHA(c,d)and SEA(e,f)treatment

图2 静息的T细胞的形貌结构与膜纳米结构。图b是图a的三维图像,图c为误差信号模式图,图d是细胞a的剖面图,图e和图f是膜表面超微结构图像,图g是横向力(LFM)模式图,图k是膜表面颗粒粒径的分布图Fig.2 Representative AFM morphological images of resting T cells.(b)3-D image of(a).(c)The signal error mode image.(d)Height profile generated along the black line in(a).(e,f)Ultrastructural images of cell membrane.(g)Lateral force images of(e).(h)The diameter of particles distribution of membrane surface particle in(e)
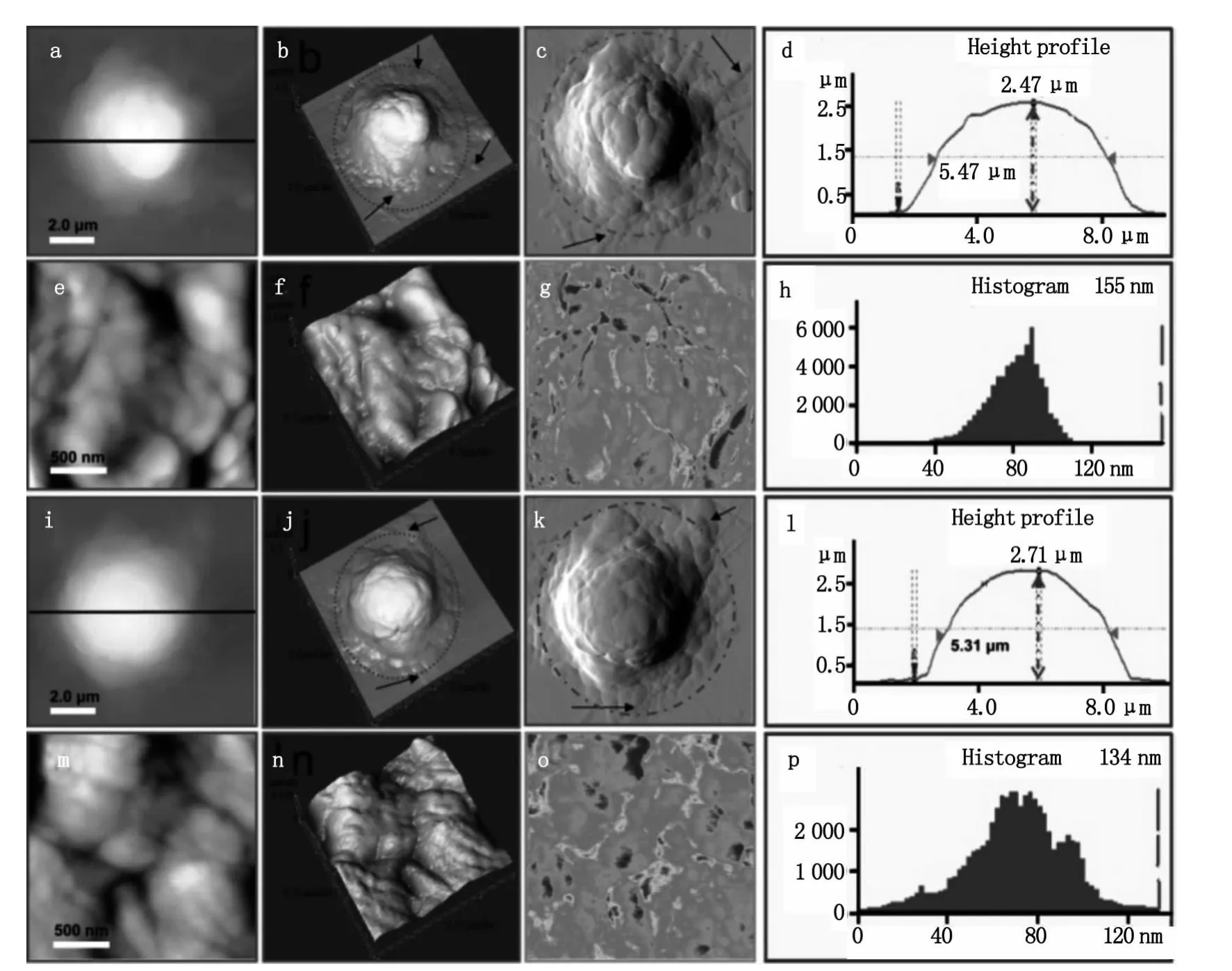
图3 经刺激剂处理后的活化的T细胞的具有代表性的形貌图和膜纳米结构图像。图a-h显示了PHA活化的T细胞的形貌和膜纳米结构结构,图i-p显示了SEA活化的T细胞的形貌和膜纳米结构Fig.3 Representative AFM images of activated T cells.(a-h)and(i-p)show the morphology and nanostructure of T cells which are activated by PHA and SEA,respectively
如图3所示是用PHA和SEA分别刺激活化后的T细胞的AFM观察结果。图3a到3c是PHA活化后T细胞的形貌图,从三维图(图3b)和误差信号图(图3c)可以明显的看到活化后细胞周围的蹼状结构,细胞膜结构变的复杂,黑色箭头所指示的是T细胞活化后伸出的类似伪足的结构。从其剖面图可以得出PHA活化后细胞高度为2.47μm,半高宽为5.47μm(图3d)。从AFM高分辨的图像可以看出,PHA活化的T细胞表面有丰富的颗粒状团簇结构如图3e和3f,团簇大小分布在100~500 nm。从 LFM模式图(图3g)可以看出,与静息细胞(图2g)相比,经PHA活化后细胞膜表面的摩擦力的分布变的不均匀,这与PHA活化后膜纳米结构的变化相吻合,活化后细胞膜变的不均一。从AFM的定量数据可以得到PHA活化后T细胞膜表面颗粒大小在40~110 nm,呈正态分布,主要集中在80 nm左右,其中较大的颗粒粒径达到155 nm如图3h。从图3i到3k可以看到SEA活化后细胞周围同样有丰富的蹼状结构和伪足结构(图中虚线和箭头所示),从图3l可以看出SEA活化后 T细胞的高度为 2.71μm,半高宽为5.31μm。从 AFM高分辨的图像可以看出,SEA活化后膜纳米结构变的复杂,表面起伏不平,与PHA活化的现象类似同样有颗粒状团簇的形成,团簇大小100 nm ~1μm(图3m和3n),膜表面摩擦力的分布也变的不均匀(图3o),组成团簇的颗粒大小在15~120 nm之间,呈正态分布,颗粒大小主要集中在75 nm左右,其中较大的颗粒达到134 nm(图3p)。
为了对活化前后T细胞形态与膜纳米结构进行定量对比分析,我们对关于细胞形态的各项物理参数做了统计分析,如图4所示,这些物理参数主要包括:细胞体积、细胞直径、细胞高度、膜表面平均粗糙度及膜表面纳米颗粒高度分布等五个指标。统计结果直观的表明:细胞经PHA和SEA刺激活化后,细胞的高度增加,细胞的直径和体积也均增大,其中体积增加幅度较大(如图4a和4b)。对于膜表面纳米结构而言,其表面平均粗糙度略有增加但变化并不明显,静息的T细胞Ra为6 nm左右,PHA活化后Ra增加到8 nm左右,SEA活化后Ra增加到近10 nm,而膜表面颗粒的平均高度则明显增大,静息的T细胞表面颗粒高度为42 nm左右,PHA活化后颗粒高度增加到78 nm左右,SEA活化后颗粒高度增加到近91 nm左右(如图4c所示),这与其超微结构的变化(图2e到图3e和图3m)相吻合。需要说明的是经SEA活化后细胞体积、细胞直径、细胞高度、膜表面平均粗糙度及膜表面纳米颗粒高度这五项指标的增加幅度均大于PHA活化后的,这说明不同的刺激剂对T细胞的活化程度不同从而会导致不同的形态结构和膜纳米结构。
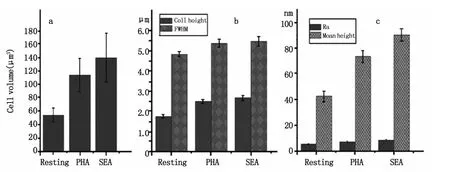
图4 对活化前后T细胞的形貌及膜表面纳米结构进行定量分析包括细胞体积,我们统计了其细胞体积(图a),半高宽和细胞高度(图b),以及膜纳米结构变化的参数平均粗糙度(Ra)和颗粒平均高度(图c)的变化Fig.4 Quantitative analysis of morphology and nanostructure about resting and activated T cells.A statistics of cell volume(a),cell height(b),full width at half maximum(FWHM)(b),average roughness(Ra)(c)and particle average height(c)was performed
2.3 不同外源刺激下T细胞膜纳米力学特性的变化
T细胞的活化实验采用PHA和SEA刺激T细胞活化。我们知道,植物凝集素(PHA)是一种从红芸豆中提取的有丝分裂原,作为一种低聚糖与蛋白质的复合物,植物凝集素有促进淋巴细胞有丝分裂、激活免疫细胞--淋巴细胞的作用。PHA刺激T细胞增殖分化产生大量效应T细胞和细胞毒T细胞;效应T细胞分泌产生大量细胞因子(如白介素-2、干扰素等)杀伤病毒[12]。超抗原(SEA)是一种蛋白激酶C的激活剂,可直接与 T细胞受体(T cell receptor,TCR)的某些Vβ区结合,不受主要组织相容性复合物(major histocompability complex,MHC)的限制,导致带有特异性Vβ节段的 T细胞大量活化增[13]。
免疫是机体针对外源性物质的防御性反应。任何外源性物质首先侵入的是细胞膜,细胞膜已经被证明参与刺激性或者细胞毒性免疫反应,所以细胞膜的改变被认为是在分子水平上对细胞行为的影响[14]。我们前面的观察结果表明了T细胞形貌及膜表面纳米结构在经PHA和SEA刺激活化后发生改变,由于特异性膜分子的表达和分泌细胞因子等导致细胞表面的蛋白质等大分子明显增多,从而引起细胞膜纳米结构的相应变化。而细胞膜受到干扰或破坏,通过一定的途径触发细胞内的一系列生理生化反应,介导细胞粘着,即增强细胞间的粘连及细胞与基质的粘连,调节细胞的形状和细胞骨架的结构。T细胞面对外源侵入,产生免疫应答,与靶细胞特异性结合,破坏靶细胞膜,直接杀伤靶细胞,其粘附力的大小直接决定着细胞免疫应答的能力。另一方面细胞膜表面蛋白等大分子含量的改变会导致细胞硬度的改变。细胞膜表面分子的变化可能会引起其力学特性的变化,这必然是与其免疫功能相适应的。以往的研究结果表明,细胞形态将会影响其机械性能[15,16],这表明,不同的形态则有着不同的机械性能。但是在AFM之前,人们还无法在纳米尺度获取细胞膜纳米力学特性变化的参数[17],AFM作为获得生物分子和细胞的纳米结构和生物力学特性的强有力的工具,早已被证明是一种强有力的非破坏性的纳米技术,AFM这一纳米力感应器的出现,从而成为研究细胞动力学过程的新工具[18-21]。
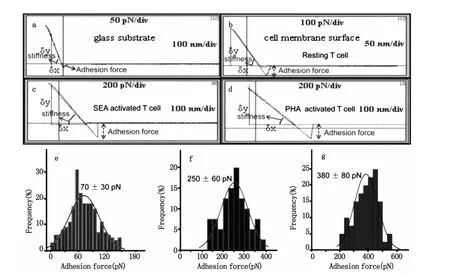
图5 AFM针尖-细胞力测量结果。图a是利用AFM探针获得的玻璃表面非特异性作用的力曲线。图b、图c和图d分别是AFM针尖和静息的T细胞、SEA活化的细胞和PHA活化的细胞之间的非特异性的力曲线。图e、图f和图g分别为静息的、SEA活化的和PHA活化的T细胞膜表面粘附力的统计图Fig.5 Measurement of the adhesion force of AFM tip-T cells,(a)Force-distance curve between AFM tip and glass surface,(b)Force-distance curve of resting T cells,(c,d)Force-distance curves of T cells which were activated by SEA and PHA for 48h,respectively.(e,f,g)Histograms of statistical results of surface adhesion force for resting groups,SEA groups and PHA groups,respectively
图5a是针尖与玻璃表面的力曲线,玻璃表面与探针的作用力不明显,从图5b可以看出Resting T细胞表面与探针间具有明显的粘附力。图5c是SEA刺激48h后,针尖和T淋巴细胞表面的力曲线,与静息的T细胞相比,SEA活化后粘附力增大;图5d是PHA刺激后T淋巴细胞与针尖之间的力曲线,与静息的T细胞和SEA活化的T细胞相比,PHA活化后细胞表面粘附力变得更大。通过定量分析可知AFM针尖与静息的(图5e)、SEA活化的(图5f)和PHA活化的(图5 g)T细胞之间的作用力分别为70 pN、250 pN和380 pN。T淋巴细胞在经过不同抗原刺激后,不但细胞形态和膜纳米结构发生了变化,而且这种变化还伴随着细胞膜纳米机械性能的变化。不同的抗原刺激会导致粘附力的增加幅度不同,通过上面的分析可知PHA活化后T细胞表面的粘附力增加幅度较大。经抗原刺激活化后细胞表面的粘附力为静息的细胞表面的粘附力的3-6倍。T细胞正是通过以上途径,把与外源性物质作用后的变化表现在细胞微观形貌上,这种变化进一步导致功能的变化,T细胞的这种变化形式可能使得其更加有效的与病原体相互作用从而进一步清除病原体。结合T淋巴细胞的超微形貌图,静息的T细胞膜表面较为平坦时,细胞的粘附力较小,当活化后随着膜分子的表达,细胞膜成分团聚形成颗粒时粘附力则随之增大。另一方面,前面的倒置显微镜图1c到图1f,显示活化后细胞出现凝集现象,这种凝集作用依赖于LFA-1/ICAM-1的相互作用,静息T淋巴细胞表面粘附分子LFA-1/ICAM-1结合较弱,T淋巴细胞在受到外来抗原刺激作用活化后,LFA-1/ICAM-1的结合显著增强[27]。T细胞经PHA活化后粘附力较SEA活化后粘附力大,与前面的倒置显微镜所显示的结果一致,即PHA活化后细胞凝聚团簇较SEA活化后细胞凝聚团簇大而且凝聚团簇多,这可能是PHA活化后LFA-1/ICAM-1的亲和力更强的缘故。已有大量研究证明活化后细胞表面LFA-1/ICAM-1这两种粘附分子的表达并没有显著增加,上述事实提示在T淋巴细胞活化后,粘附分子可能通过构型变化的方式,提高LFA-1/ICAM相互作用的亲和力,从而提高活化淋巴细胞的粘附能力[22-24]。我们可以利用力曲线探针与样品接触部分的斜率变化来分析样品表面的硬度变化,即δy/δx的比值越大,其硬度也越大。比较图5a和5b可以看出玻璃表面的硬度较细胞表面的硬度大,与静息的T细胞相比,发现SEA活化后(图5c)和PHA活化后(图5d)所测得的斜率要小于对静息细胞所测得的斜率,因为曲线斜率与细胞硬度具有相关性[25],因此斜率变小意味着活化后T细胞的硬度变小,这可能与细胞在受到抗原刺激后的变形能力有关,如更容易伸出伪足等,同时细胞硬度减小有利于细胞的运动,从而更有利于与靶细胞等相互作用。
3 讨论
细胞的超微结构与机械性能对细胞的生理学、病理学、药理学过程起着重要的作用,如细胞表面颗粒及分子的分布,细胞的增殖、活化、凋亡、信号传导等均与细胞的超微结构与机械性能相关。原子力显微镜这一科学研究工具不仅在细胞形态和膜纳米结构研究中具有极大应用价值,而且在生物样品,如细胞、生物大分子等纳米力学测量等方面也具有无可比拟的优势。
T细胞是免疫系统的重要组成部分,机体一旦受到病原体的攻击,T细胞会迅速做出反应,从而导致其处于活化增殖状态。我们首先利用PHA和SEA刺激活化T细胞,启动机体多种免疫反应,并应用AFM的高空间分辨率比较了静息、PHA活化和SEA活化的T淋巴细胞的超微形貌结构,并测量了细胞的纳米机械性能。分析静息的T细胞和活化的T细胞的形态结构和膜纳米结构有利于进一步了解T细胞活化的机制和免疫突触的形成以及整个免疫反应的过程。分析静息的T细胞的AFM图可以得知,静息的T细胞膜表面较光滑(图2a到2c),纳米结构表明膜表面的分子排列紧密(图2e和2f),测量表明膜表面平均粗糙度(Ra)分布为6.7 nm。静息的细胞膜表面结构比较光滑、紧密,与之对应的LFM模式图也表明静息细胞的膜结构光滑的特点,其摩擦力的分布相对均匀(图2g),这说明膜表面的各种生物大分子比较均匀的分布于膜表面,这与我们前面的成像结果相符合。虽然静息的T细胞表面大部分地方摩擦力相同且较小,但是有的地方摩擦力要高于周围的摩擦力,有的地方摩擦力低于周围的摩擦力这是由于细胞表面颗粒高度的不同(图2h)和细胞膜成分的不同引起的。与静息的T细胞相比,经过PHA和SEA活化后,细胞的高度和体积明显增大(图4),这是T细胞经过刺激剂活化后增殖、分化而增大的表现。从其纳米结构图(图3e和3m)可以看出活化后的T细胞表面布满颗粒状团簇(100 nm~1μm),这些微纳结构域可能是在细胞活化与增殖的过程中,多种细胞因子和标志分子开始表达分泌,细胞表面的蛋白质等大分子明显增多,T细胞表面分子会由疏散分布转而聚集成簇从而形成免疫突触[26],同时T细胞之间的相互作用和信息传导也逐渐增加,细胞膜结构重排形成的具有其特殊功能的膜纳米结构域,这对于免疫细胞的功能发挥是至关重要的。
经过PHA和SEA活化后的T细胞表面粘附力增大,是静息的T细胞的3-6倍,结合其超微结构分析,活化后T细胞表面形成大小不一的颗粒状物质,这些物质均为细胞表面蛋白和脂糖等的聚集物,细胞的这些形态变化引起其粘附力的变化;结合其功能分析,粘附力增大有利于加强T细胞与病原体的相互作用。另一方面活化后细胞硬度减小,这可能与细胞在受到抗原刺激后的变形能力有关,如更容易伸出伪足等,同时硬度减小有利于细胞的迁移,从而更有利于与靶细胞等相互作用从而进一步清除病原体。通过AFM的研究,可以进一步的了解T淋巴细胞形态变化与细胞行为之间的关系,为更好地理解T细胞的结构与功能提供了更多可视化的依据。
[1]MYERS M D,SOSINOWSKI T,DRAGONE L L,et al.Src-like adaptor protein regulates tcr expression on thymocytes by linking the ubiquitin ligase c-Cbl to the TCR complex[J].Nat Imm,2006,7(1):57-66.
[2]胡明铅,蔡继业.T细胞抗原识别与活化研究[J].生命科学研究,2008,12(3):190-192.HU Mingqian,CAI Jiye.Research on T cell antigen recognition and activation[J].Life Science Research,2008,12(3):190-192.
[3]SU Y T,MICHAEL L D.T-Cell Activation:A multidimensional signaling network[J].Curr Opin Cell Biol,2002,14(5):575-580.
[4]ZHONG L Y,LIAO W T,WANG X P,et al.Detection the specific marker of CD3 molecules of human peripheral blood t lymphocytes using SNOM and quantum Qots[J].Colloids Surf,A:Physicochem Eng Aspects,2008,313:642-646.
[5]廖问陶,钟丽云,查庆兵,等.人外周血淋巴细胞体外刺激活化的原子力显微镜研究[J].激光杂志,2006,27(5):89-90.LIAO Wentao,ZHONG Liyun,CHA Qingbing,et al.Observation of the activation of human peripheral blood lymphocytes with atomic force microscopy[J].Laser Journal,2006,27(5):89-90.
[6]HUANG X,LI X,CHEN L,et al.Single-Molecule level binding force between collagen and collagen binding domain-growth factor conjugates[J].Biomaterials,2013,34:6139-6146.
[7]黄训,金花,赵宏霞,等.原子力显微镜对中性粒细胞与K562细胞超微结构及机械性能的探测[J].分析测试学报,2009,28(11):1255-1259.HUANG Xun,JIN Hua,ZHAO Hongxia,et al.Ultrastructure and mechanical property of neutroph ilic granulocyte and leukem ia cellk562 detected by AFM[J].Journal of Instrumental Analysis,2009,28(11):1255-1259.
[8]GREGORY F,SARAH L,DAVID A,et al.Detection,localization,and conformational analysis of single polysaccharide molecules on live bacteria[J].ACS Nano,2008,2(9):1921-1928.
[9]MICHAEL L,DUSTIN A R.Reprograming t cells:the role of extracellular matrix in coordination of t cell activation and migration[J].Curr Opin Immunol,2001,13(3):286-290.
[10]EVANS E A,CALDERWOOD D A.Forces and bond dynamics in celladhesion[J]. Science, 2007, 316(5828):1148-1153.
[11]MALEK A M,IZUMO S.Control of endothelial cell gene expression by flow[J].J Biomechan,1995,28(12):1515.
[12]DONALD M,SIMONS E M,GARDNER P I.Sub-mitogenic phorbol myristate acetate co-stimulation rescues the pha induced activation of both naÏve and memory t cells cultured in the rotating-wall vessel bioreactor[J]. Cell Biology International,2009,33(8):882-886.
[13]CRAIG T,MORITA H M,LI J G,et al.Superantigen Recognition by γδ T Cells:SEA recognition site for human Vγ2 T cell receptors[J].Immunity,2001,14(3):331-344.
[14]ROOZEMOND R C,BONAVIDA B.Effect of altered membrane fluidity on NK cell-mediated cyto-toxicity selective-inhibition of the recognition or post recognition events in the cytolytic pathway of NK cells[J].J Immunol,1985,134(4):2209-2214.
[15]ADDAE-MENSAH K A,WIKSWO J P.Measurement techniques for cellular biomechanics in vitro[J].Exp Biol Med,2008,233(7):792-809.
[16]SCHMITZ J,GOTTSCHALK K E.Mechanical regulation of cell adhesion[J].Soft Matter,2008,4(7):1373-1387.
[17]ZHANG X,WOJCIKIEWICZ E,MOY V T.Force spectroscopy of the leukocyte function-associated antigen-1/intercellular adhesion molecule-1 interaction[J].Biophys J,2002,83:2270-2279.
[18]DUFRENE Y F.Atomic force microscopy,a powerful tool in microbiology[J].J Bact,2002,184(19):5205-5213.
[19]DUFRENE Y F.Using nanotechniques to explore microbial surfaces[J].Nat Rev Microbiol,2004,2(6):451-460.
[20]GREENLEAF W J,WOODSIDE M T,BLOCK S M.High-resolution,single-molecule measurements of biomolecular motion[J].Annu Rev Biophys Biomol Stru,2007,36:171-190.
[21]SURESH S.Biomechanics and biophysics of cancer cells[J].Acta Biomater,2007,3(4):413-438.
[22]LUPHER M L,HARRIS E A S,BEALS C R,et al.Cellular activation of leukocyte function-associated antigen-1 and its affinity are regulated at the i domain allosteric site[J].J Immunol,2001,167(3):1431-1439.
[23]SCOTT A T,SEETHARAMA D S,SIAHAAN T J,et al.Linear and cyclic lfa-1 and icam-1peptides inhibit t cell adhesion and function[J].Peptides,2000,21(8):1161-1167.
[24]ZHANG W Y,SHAO Y,FANG D Y,et al.Negative regulation of t cell antigen receptor-mediated crk-l-c3g signaling and cell adhesion by Cbl-b[J].J Biol Chem,2003,278(26):23978-23983.
[25]ABU-LAIL N I,CAMESANO T A.Role of ionic strength on the relationship of biopolymer conformation,DLVO contributions,and steric interactions to bioadhesion of pseudomonas putida KT2442[J].Biomacromolecules,2003,4:1000-1012.
[26]MICHELLE K,JOHANNES B,HUPPA M A,et al.Linking molecular and cellular events in t-cell activation and synapse formation[J].Sem Immunol,2003,15(6):307-315.
